TiH1.971催化Mg纳米晶储氢性能研究
张刘挺,颜年华,陆 雄,孙 泽,俞海杰,卢志禹
(江苏科技大学 能源与动力学院,镇江 212003)
在人类社会快速发展的同时,化石能源枯竭及环境污染等问题也愈演愈烈.因此,寻找清洁可再生的能源来替代即将消耗殆尽的化石能源已成为全人类不得不共同面对的难题[1].在众多新能源中,氢能因其来源丰富、燃烧热值高及能够应用于燃料电池等优点,被认为是最有前景的能源之一[2].然而,如何实现安全高效的储氢仍是氢能大规模应用的关键难题.
金属氢化物由于具有储氢密度高、安全且便于运输等优点,受到了国内、外学者的广泛关注[3].其中,氢化镁(MgH2)由于储氢质量百分比高达7.6%、可逆性能较好,同时Mg的在地球上的储量丰富等优点,成为了储氢领域的研究重点[4].然而,较为稳定的热力学性能和缓慢的动力学性能限制了其在实际中的应用[5].因此,需要通过有效的手段来对其进行改性.
目前,对Mg+H体系的有效改性手段主要包括纳米化[6]、催化掺杂[7]、合金化[8]及纳米限域[9]等.近期的研究表明,纳米化对Mg+H体系的储氢性能有着显著的改善作用.同时,国内外学者的研究表明,在添加了过渡金属Ti或其化合物后,构筑的复合体系表现出了更为优异的储氢性能.文献[10]合成了Mg+Ti纳米颗粒,并发现吸氢后该样品在280 ℃开始放氢,且吸放氢活化能分别降至68 kJ/mol和78 kJ/mol.文献[11]制得了MgH2+TiO2@C(w(TiO2@C)=10%),该复合体系在205 ℃开始放氢,并在300 ℃下,7min内的放氢量为6.5%.文献[12]合成了MgH2+TiC(w(TiC)=10%),并测得此样品在300 ℃下的放氢量为6.3%,放氢活化能降至144.62 kJ/mol(MgH2为191.27 kJ/mol).
研究表明,添加Ti基催化剂球磨会对Mg+H体系的储氢性能产生明显的提升.此前,本课题组已通过一种湿化学球磨法制备了Mg纳米晶,现将TiH1.971作为催化剂掺入其中,构筑Mg+TiH1.971纳米晶粒复合体系,系统研究了TiH1.971对Mg纳米晶储氢性能的改性.
1 实验
1.1 Mg纳米晶制备及Mg+TiH1.971复合体系的合成
为使球磨样品的晶粒尺寸更小且纯度更高,Mg纳米晶制备及Mg+TiH1.971复合体系的合成均通过一种湿化学球磨法.具体过程如下,将9 mL庚烷(Sinopharm)、0.45 mL油酸(Sinopharm)及0.15 mL油胺(Sinopharm)与3 g镁粉(Sinopharm)混合在球磨罐中,然后以400 r/min的转速球磨40 h.待球磨结束后,将罐中样品加入15 mL庚烷和1 mL油酸进行清洗,并转移至50 mL离心管中以9 000 r/min的转速离心10 min.离心完成后,倒出上层液体并加入3~5 mL庚烷清洗沉淀.将清洗过后的沉淀转移至另一带阀门的球磨罐中,在100 ℃(庚烷的沸点为98.42 ℃)下抽真空除溶剂30 min.此制备过程除球磨、离心及抽真空外,均在氩气氛围的手套箱中进行.对于Mg+TiH1.971(w(TiH1.971)=5%)复合体系的合成,将3 g镁粉替换成2.85 g镁粉和0.15 g TiH1.971粉(Alfa Aesar)即可.为使实验测量仪器所带来的误差最小化,每次吸放氢测试均重复多次.文中仅采用多次测量下误差可忽略的数据.
1.2 样品表征
对样品进行X射线衍射分析(XRD)的设备为X'Pert Pro(PANalytical, the Netherlands)型衍射仪,其通过 40 kV、40 mA 的 Cu K辐射,将样品以5 °/min的扫描速度,在20°至80°范围内连续扫描.为观测样品的形貌结构实验使用了Hitachi SU-70型的扫描电子显微镜(SEM)对样品进行测试.此外,实验通过Netzsch STA449F3分析仪测得各样品的差示扫描量热分析(DSC)曲线,以便计算样品放氢时的表观活化能.Mg纳米晶制备及Mg+TiH1.971纳米复合体系的储氢性能测试是在实验室自制的Sieverts式储氢性能测试仪上进行.关于非等温吸放氢实验,样品在3 MPa氢压下以1 ℃/min的升温速率从室温升至350 ℃以获取吸氢数据.待样品冷却后,又将其在静态真空下以2 ℃/min的升温速率从室温升至430 ℃以获取放氢数据.样品的吸、放氢动力学性能通过等温吸放氢实验测得.在3 MPa氢压下,样品被分别在75、100、125 ℃恒温温度下进行吸氢.而放氢时,在静态真空中,样品被分别维持在不同温度下.相关的记录设备全程记录着氢压、温度及时间变化.
2 结果与讨论
2.1 Mg纳米晶制备及Mg+TiH1.971复合体系的表征与形貌结构
图1为通过湿化学球磨法制备的Mg及Mg+TiH1.971(w(TiH1.971)=5%)的球磨态XRD图谱.从图中可以明显得知,两样品中Mg的峰与PDF卡片完全匹配,而Mg+TiH1.971(w(TiH1.971)=5%)复合体系的TiH1.971峰出现在35°左右的位置,这是因为该样品中仅添加了5%的TiH1.971.根据谢乐公式及XRD数据,球磨态的Mg和Mg+TiH1.971(w(TiH1.971)=5%)的平均晶粒尺寸分别为22.1、36.4 nm.图2为两样品在吸氢后的SEM图像,从图2中看出吸氢后Mg和Mg+TiH1.971(w(TiH1.971)=5%)都呈现出类似珊瑚礁状的颗粒形貌.上述结果表明文中通过湿化学球磨法成功制备了Mg纳米晶和Mg+TiH1.971复合体系.

图2 样品在吸氢后的SEM图像Fig.2 SEM images of hydrogenated samples

图1 制备的Mg纳米晶及Mg+TiH1.971(w(TiH1.971)=5%)复合体系的XRD图谱Fig.1 XRD pattern of preparednanocrystallineMg and Mg+TiH1.971(w(TiH1.971)=5%) composit
2.2 TiH1.971对Mg纳米晶吸氢性能的改性
为了研究TiH1.971对Mg纳米晶吸氢的影响,制备的Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系在3 MPa氢压下,从室温以1 ℃/min的加热速率升温至300 ℃,进行非等温吸氢测试,所测结果如图3.

图3 制备的Mg纳米晶及Mg+TiH1.971(w(TiH1.971)=5%)的非等温吸氢曲线Fig.3 Non-isothermal hydrogenation curves of theprepared nanocrystalline Mg and Mg+TiH1.971(w(TiH1.971)=5%) composite
从图中可以看出,加入5% TiH1.971后,样品起始吸氢温度从原来的40 ℃降低至20 ℃左右,已能在室温下进行吸氢.图4、5分别为Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系在温度T(T=75、100、125 ℃)下的等温吸氢曲线.根据吸氢曲线可知,在75℃、100 ℃和125 ℃下,相比于Mg纳米晶,Mg+TiH1.971(w(TiH1.971)=5%)复合体系的吸氢动力学性能得到了明显提升.此外,图6为根据图4、5中图像数据拟合的Arrhenius曲线,从中可知加入了5% TiH1.971后,样品的吸氢表观活化能Ea由Mg纳米晶的26.7±0.1 kJ/mol降低至20.9±1.8 kJ/mol,降低幅度为21.7%.这些实验结果证明了TiH1.971的掺入对Mg纳米晶的吸氢性能有较为明显地改善作用.

图6 Mg纳米晶及Mg+TiH1.971(w(TiH1.971)=5%)复合体系拟合的Arrhenius曲线Fig.6 Correspoding Arrhenius plots of the samples

图4 Mg纳米晶的等温吸氢曲线Fig.4 Isothermal hydrogenation curver of theprepared nanocrystalline Mg
2.3 TiH1.971对Mg纳米晶放氢性能的改性
为了研究TiH1.971对Mg纳米晶放氢性能的影响,完全吸氢后的Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系在静态真空下,以2 ℃/min的加热速率从室温升温至430 ℃,进行非等温放氢测试,所测结果如图7.从放氢曲线图中可以明显地看到,吸氢后的Mg纳米晶在275 ℃开始放氢,而吸氢后的Mg+TiH1.971(w(TiH1.971)=5%)复合体系的起始放氢温度为220 ℃,降低了55 ℃.放氢量的减少是由于TiH1.971的加入降低了有效储氢量.图8、9分别为完全吸氢后Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系在不同温度下的等温放氢曲线.从等温放氢曲线中观察到,在325 ℃下,吸氢后的Mg纳米晶需20 min才能完全放氢,而吸氢后的Mg+TiH1.971(w(TiH1.971)=5%)复合体系仅需10 min便可放出全部氢气.图10、11分别为吸氢后Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系的DSC曲线.图12是根据DSC数据按Kissinger方程拟合的曲线.根据拟合曲线可以看出,样品的放氢表观活化能由吸氢后Mg纳米晶的176.7±9.1 kJ/mol降低至吸氢后Mg+TiH1.971(w(TiH1.971)=5%)复合体系的150.1±11.8 kJ/mol,降幅较小.这表明TiH1.971对该体系的放氢动力学的改善有限.

图5 Mg+TiH1.971(w(TiH1.971)=5%)复合体系的等温吸氢曲线Fig.5 Isothermal hydrogenation curver of Mg+TiH1.971(w(TiH1.971)=5%) compostie

图7 吸氢后Mg纳米晶和Mg+TiH1.971(w(TiH1.971)=5%)复合体系的非等温放氢曲线Fig.7 Non-isothermal dehydrogenation corves of thehydrogenation nanocrystalline Mg and Mg+TiH1.971(w(TiH1.971)=5%) composite

图8 吸氢后的Mg纳米晶的等温放氢曲线Fig.8 Isothermal hydrogenation curves of thehydrogenated nanocrystalline Mg

图9 吸氢后Mg+TiH1.971(w(TiH1.971)=5%)复合体系等温放氢曲线Fig.9 Isothermal hydrogeration curves of thehydrogenated Mg+TiH1.971(w(TiH1.971)=5%) composite
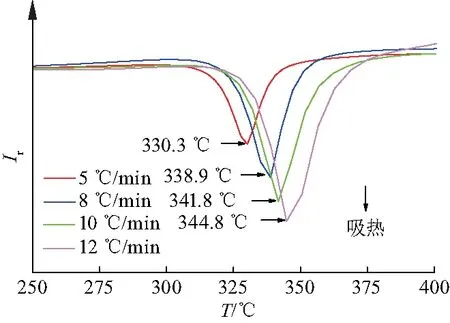
图10 吸氢后Mg纳米晶的DCS曲线Fig.10 DCS images of the hydrogenated nanocrystalline Mg

图11 吸氢后Mg+TiH1.971(w(TiH1.971)=5%)复合体系的DSC曲线Fig.11 DCS images of the hydrogenatedMg+TiH1.971(w(TiH1.971)=5%) compostie

图12 根据DCS参数和Kissinger方程拟合的曲线Fig.12 Estimations of the apparent activation energiesusing the Kissinger method with the parameters obtainedfrom DCS measurements
3 结论
(1) 将TiH1.971作为催化剂添入Mg纳米晶中,以对Mg纳米晶储氢性能进行改性研究.在吸氢性能方面,加入5% TiH1.971后的Mg+TiH1.971(w(TiH1.971)=5%)在室温下就开始吸氢,并在100 ℃下,10 min内能吸收超过2%的氢气.吸氢表观活化能降至20.9±1.8 kJ/mol.
(2) 在放氢性能方面,吸氢后的Mg+TiH1.971(w(TiH1.971)=5%)复合体系在220 ℃开始放氢,相比于Mg纳米晶降低了55 ℃.同时,该复合体系在300 ℃下, 15min内的放氢量超过5%.文中的创新性在于将TiH1.971通过湿化学球磨法与Mg复合,制备Mg+TiH1.971(w(TiH1.971)=5%)体系来对Mg的储氢性能进行改性.
参考文献(References)
[1] 周虎,张健,季东,等.纳米金属负载的ZIF-8复合材料制备与室温储氢性能[J].江苏科技大学学报(自然科学版),2017,31(3):381-384. DOI:10.3969/j.issn.1673-4807.2017.03.022.
ZHOU Hu,ZHANG Jian,JI Dong,et al. Fabrication and room-temperature hydrogen storage performances of nanoparticles-doped ZIF-8 composites[J]. Journal of Jiangsu University of Science and Technology(Natural Science Edition) 2017,31(3):381-384. DOI:10.3969/j.issn.1673-4807.2017.03.022.
[2] SADHASIVAM T, KIM H T, JUNG S, et al. Dimensional effects of nanostructured Mg/MgH2for hydrogen storage applications: a review[J]. Renew Sust Energ Rev, 2017(72):523-534. DOI: 10.1016/j.rser.2017.01.107.
[3] LIU J, LIU Y, LIU Z, et al. Effect ofrGO supported NiCu derived from layered double hydroxide on hydrogen sorption kinetics of MgH2[J]. J Alloys Compd, 2019(789):768-776. DOI: 10.1016/j.jallcom.2019.03.149.
[4] WANG Z, REN Z, JIAN N, et al. Vanadium oxide nanoparticles supported on cubic carbon nanoboxes as highly active catalyst precursors for hydrogen storage in MgH2[J]. J Mater Chem A, 2018(6):16177-16185. DOI:10.1039/c8ta05437a.
[5] LIU Y, DU H, ZHANG X, et al. Superior catalytic activity derived from a two-dimensional Ti3C2precursor towards the hydrogen storage reaction of magnesium hydride[J]. Chem Commun(Camb), 2016, 52:705-708. DOI:10.1039/c5cc08801a.
[6] XIAO X, LIU Z, YARAHMADI S S, et al. Facile preparation of beta-/gamma-MgH2nanocomposites under mild conditions and pathways to rapid dehydrogenation[J]. Phys Chem Chem Phys, 2016(18):10492-10498. DOI:10.1039/c5cp07762a.
[7] ZHANG M, XIAO X, WANG X, et al. Excellent catalysis of TiO2nanosheets with high-surface-energy {001} facets on the hydrogen storage properties of MgH2[J]. Nanoscale, 2019(11):7465-7473. DOI:10.1039/c8nr10275a.
[8] DING X, CHEN R, CHEN X, et al. Dependence and mechanism of hydrogenation behavior on absorption conditions in hypo-eutectic Mg-Ni-Cu alloy[J]. Int J Hydrogen Energy, 2018(43):16617-16622. DOI:10.1016/j.ijhydene.2018.07.083.
[9] ZHANG J, ZHU Y, LIN H, et al. Metal hydride nanoparticles with ultrahigh structural stability and hydrogen storage activity derived from microencapsulated nanoconfinement[J]. Adv Mater, 2017(29):1700760-1700765. DOI:10.1002/adma.201700760.
[10] CALIZZI M, CHERICONI D, JEPSEN L H, et al. Mg-Ti nanoparticles with superior kinetics for hydrogen storage[J]. Int J Hydrogen Energy, 2016(41):14447-14454. DOI: 10.1016/j.ijhydene.2016.03.071.
[11] ZHANG X, LENG Z, GAO M, et al. Enhanced hydrogen storage properties of MgH2catalyzed with carbon-supported nanocrystalline TiO2[J]. J Power Sources, 2018(398):183-192. DOI: 10.1016/j.jpowsour.2018.07.072.
[12] FAN M Q, LIU S S, ZHANG Y, et al. Superior hydrogen storage properties of MgH2-10 wt.% TiC composite[J]. Energy, 2010(35):3417-3421. DOI: 10.1016/j.energy.2010.04.034.

