HNRNPU通过调控衰老相关基因CDK2表达促进胃癌的进展
李红君 郑丽端
(华中科技大学同济医学院附属协和医院 病理科, 湖北 武汉 430022)
胃癌是全球肿瘤死亡的第三大原因,严重威胁人类健康。寻找胃癌早期诊断的特异性标记物和新的治疗靶点是当前的研究热点[1]。我们前期研究发现,RNA结合蛋白核不均一核糖核蛋白U(heterogeneous nuclear ribonucleoprotein U, HNRNPU)在胃癌组织中高表达,HPSE eRNA/HNRNPU/p300/EGR1/HPSE轴可以作为胃癌临床治疗的潜在靶标[2]。但是HNRNPU对胃癌增殖侵袭的直接作用没有进行深入探讨。本研究拟探讨过表达或敲低HNRNPU对胃癌细胞增殖侵袭等生物学功能的影响,通过对公用数据库的综合分析,挖掘HNRNPU可能调控的靶基因以及生物学过程。
1 材料和方法
1.1 材料
1.1.1 细胞株
人胃癌细胞系MGC-803来源于美国典型培养物保藏中心(American Type Culture Collection,ATCC),且具备细胞STR鉴定报告。
1.1.2 实验试剂
RPMI-1640细胞培养基(美国Thermo公司);胎牛血清(美国Thermo公司);青-链霉素溶液(美国Thermo公司);胰酶(武汉谷歌生物公司);PBS缓冲液(武汉谷歌生物公司);Trizol试剂(美国Invitrogen公司);PrimeScriptTMRT Master Mix试剂盒(日本TaKaRa公司);2×Taq Master Mix(南京诺唯赞公司);PVDF膜(美国Millipore公司);SDS-PAGE凝胶配制试剂盒(碧云天生物技术公司);Neofect转染试剂(北京零客创智生物公司);Matrix基底膜基质胶(美国BD公司);抗体(爱博泰克生物公司)。引物由武汉擎科生物公司合成(表1)。
1.2 方法
1.2.1 细胞培养与转染
采用RPMI-1640和DMEM培养基(含10%胎牛血清,1%青-链霉素溶液)培养人胃癌细胞系MGC-803,培养条件为37℃恒温、5%的CO2。人类HNRNPU真核表达载体及RNA干扰载体购自上海吉凯基因科技有限公司。将细胞用胰酶消化并接种于6孔板,待细胞密度达60%~70%,处于对数增长期时行转染实验。转染体系为:200 μL无血清培养基,2 μg质粒和2 μL Neofect转染试剂。培养48 h后,给予嘌呤霉素进行筛选,获得HNRNPU稳定过表达或敲低的细胞株。稳筛细胞株用于后续实验。
1.2.2 Western Blot
收集处理后的细胞,制备蛋白样品,BCA法测定蛋白浓度,按照每孔30 μg上样。80 V恒压电泳至蛋白Maker分开,120 V恒压电泳1 h左右。300 mA恒流冰浴转膜1 h,封闭后,一抗4℃孵育过夜,二抗室温孵育2 h,使用UVP凝胶成像系统显像。
1.2.3 实时定量PCR
采用Trizol法抽提细胞样品中的总RNA,逆转录合成cDNA,在冰上配置实时定量PCR的反应体系,加入96孔PCR检测板后上机。PCR反应条件:预变性95℃,5 min;变性95℃,10 s;退火50~65℃,10 s;延伸72℃,延伸时间根据产物长度调整;循环重复扩增30~40次;以β-actin为内参,2-ΔΔCt法计算。
1.2.4 MTT
取处于对数生长期的稳筛细胞,以合适的密度接种于96孔板,分别在相应的观察时间点(24 h、48 h、72 h以及96 h)更换培养基,每孔加入20 μL的 5 mg/mL MTT溶液,继续培养4 h。终止培养,弃去上清,每孔加入150 μL二甲基亚砜,震荡10 min。使用酶联免疫检测仪测量490 nm处各孔的吸光值。
1.2.5 软琼脂克隆形成实验(Soft Agar Assay)
将1.2%的琼脂糖液和2×DMEM(加入2×抗生素和20%的胎牛血清)等比例混合,6孔板的每个孔中加入3 mL,冷却凝固形成下层琼脂凝胶。等比例配置0.5%的琼脂糖液和上述2×DMEM完全培养基,待冷却至35~40℃时,迅速加入200 μL细胞悬液,轻柔混匀后,各取3 mL加入上述已经冷却的下层凝胶之上。培养箱中培养4周后,MTT染色,计数克隆形成数量。
1.2.6 基质胶侵袭实验(Transwell)
向24孔板的每个孔中加入500 μL完全培养基,将基质胶包被的Transwell小室放入孔中。向小室内加入用无血清重悬的细胞悬液(1×104个),培养箱中培养48 h。棉签轻柔擦去上室内的细胞后,结晶紫染色,倒置显微镜下拍照计数。
1.3 统计学方法
所有的数据均以均值±标准差表示,使用t检验分析两组之间的差异。利用Pearson相关系数测定法分析两个基因之间的表达相关性。P<0.05认为差异有统计学意义。
2 结果
2.1 HNRNPU促进胃癌细胞的增殖和侵袭
通过实时定量RCR和Western Blot,分别在转录和翻译水平上证实了HNRNPU在体外能够被有效地过表达或敲低(见图1)。MTT、软琼脂克隆形成和基质胶侵袭实验结果显示,与对照组相比,过表达HNRNPU能够显著地提高胃癌细胞的增殖和侵袭活性;反之,敲低HNRNPU则明显地抑制了胃癌细胞的增殖和侵袭(见图2~4)。上述结果提示,HNRNPU是胃癌发生发展中重要的促癌分子。
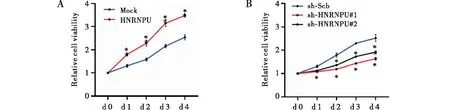
注:A:MGC-803细胞系稳定转染空载体(Mock)或HNRNPU,与Mock相比,*P<0.05;B:MGC-803细胞系稳定转染对照组(sh-Scb)或sh-HNRNPU,与sh-Scb组相比,*P<0.05图2 MTT检测HNRNPU对胃癌MGC-803细胞增殖的影响
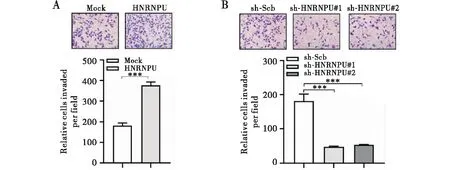
注:A:MGC-803细胞系稳定转染空载体(Mock)或HNRNPU;B:MGC-803细胞系稳定转染对照组(sh-Scb)或sh-HNRNPU;两组间比较,***P<0.001图4 Transwell检测HNRNPU对胃癌细胞MGC-803侵袭的影响(结晶紫染色)
2.2 HNRNPU在胃癌中调控衰老相关基因
为了进一步探索HNRNPU调控胃癌发生发展可能的分子机制,我们进行了数据库的挖掘和分析。通过解析GEO公用数据库,我们分析了敲低HNRNPU后肿瘤细胞的RNA-seq测序数据(GSE 88498和GSE 88178),与对照组测序数据(GSE 88272和GSE 88174)进行比对,得到了表达水平一致变化的8155个差异基因[3]。结合ENCORI数据库[4]中HNRNPU靶向的mRNA做重合分析,我们获取了HNRNPU可能调控的3 737个靶基因(见图5)。应用在线工具KOBAS[5]对这些变化基因进行通路富集分析,我们发现这些基因参与许多肿瘤相关信号通路和生物学过程,其中有41个靶基因与细胞衰老相关(见图5)。
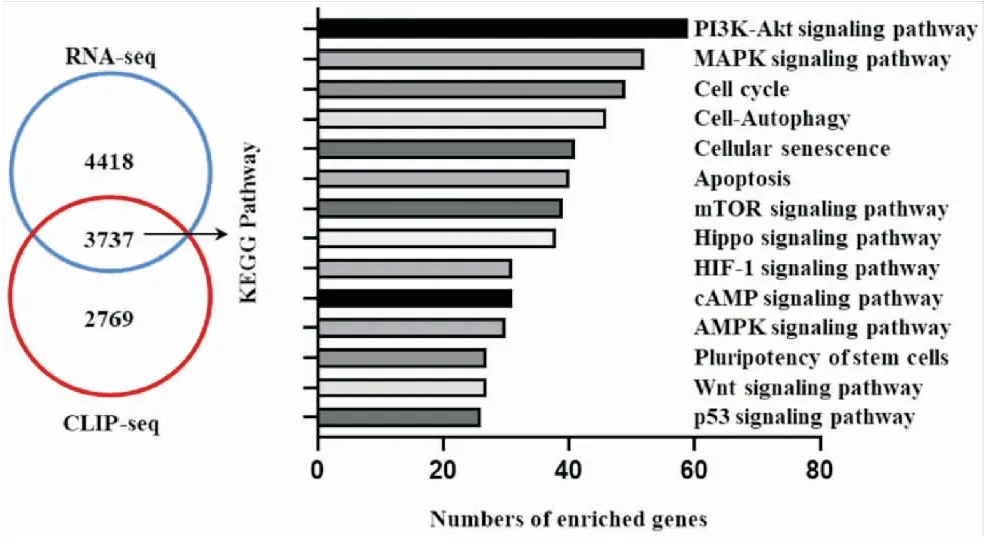
图5 数据库分析HNRNPU可能调控的下游靶基因以及HNRNPU下游靶标基因富集分析
通过深入挖掘CSGene数据库[6],我们明确了14个HNRNPU调控的已有文献报道的衰老相关靶基因。运用GEO数据库中胃癌基因表达谱数据集(GSE15459),进一步分析这14个基因的表达水平与生存的相关性,筛选出与胃癌患者生存密切相关的7个基因(见图6)。基于RNA-seq表达水平、生存相关性以及与HNRNPU表达相关性的一致性分析,我们最终确定了在胃癌中,细胞周期蛋白依赖性激酶2(cyclin dependent kinase 2, CDK2)和哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin kinase, MTOR)可能是HNRNPU调控衰老的重要靶基因[7-10](见图6和7)。
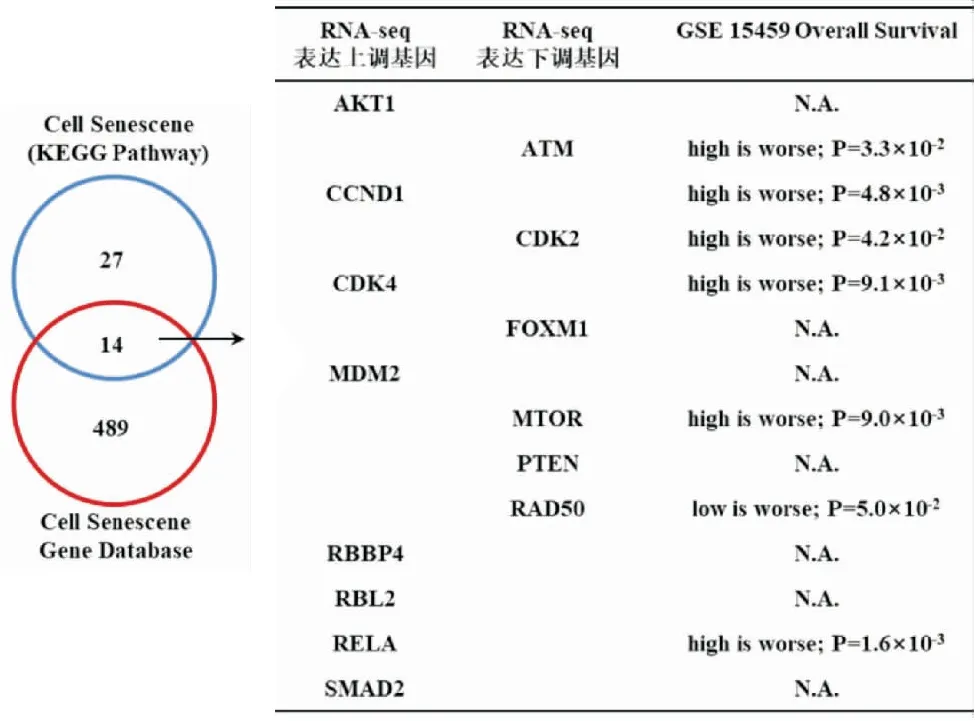
图6 衰老相关靶基因与胃癌患者生存的关系
2.3 HNRNPU促进CDK2在胃癌细胞中表达
基于上述分析,我们认为RNA结合蛋白HNRNPU通过调控CDK2和MTOR的表达,抵抗胃癌细胞衰老,从而促进胃癌的发生和进展。为了验证这一假设,我们使用过表达或敲低HNRNPU的稳筛细胞株,利用实时定量RCR和Western Blot,在mRNA和蛋白水平上检测了CDK2和MTOR的表达。我们发现,在胃癌中,CDK2与HNRNPU的表达水平保持一致,而MTOR的表达不受影响(见图8)。因此,CDK2是HNRNPU发挥作用的重要靶基因。
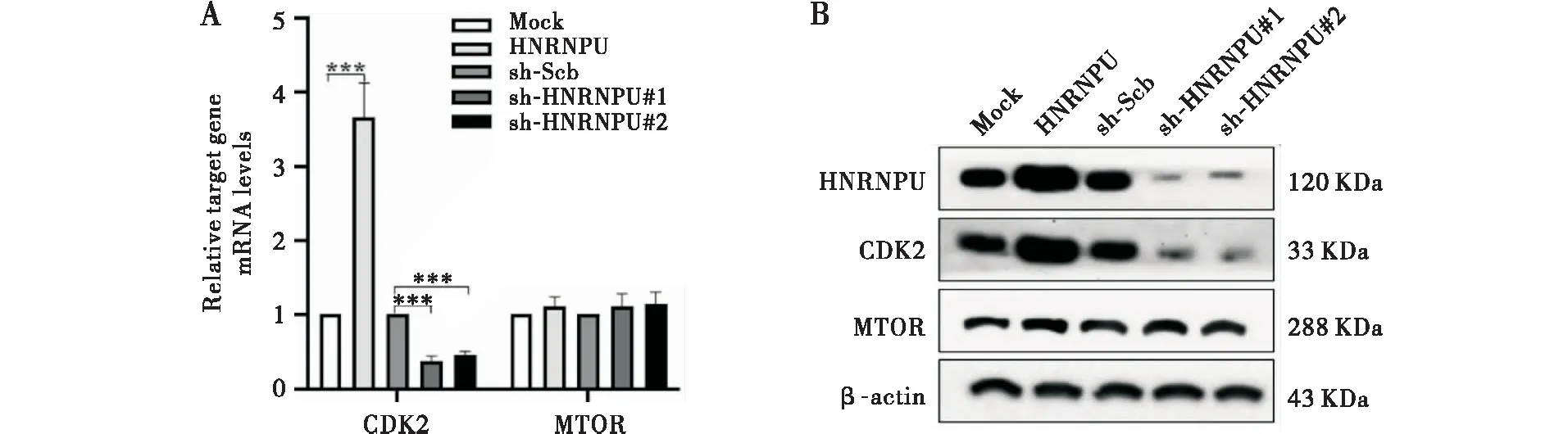
注:MGC-803细胞系稳定转染对照载体(Mock或sh-Scb)、HNRNPU或sh-HNRNPU,实时定量PCR(A)和Western Blot(B)分别在转录和翻译水平检测过表达或敲低HNRNPU对胃癌细胞MGC-803靶基因表达水平的影响;两组间比较,***P<0.001图8 PCR和Western Blot检测HNRNPU对胃癌细胞MGC-803靶基因表达水平的影响
3 讨论
胃癌是全球肿瘤发病率排名第五、死亡率高居第三的恶性肿瘤,在亚太地区尤其是中国死亡率更高[1]。胃癌发病隐匿,早期诊断困难,易于侵袭转移,因而积极探索胃癌发生发展的分子机制,寻找新的诊断标记物和治疗靶点具有重要的临床意义。
HNRNPU是核不均一核糖核蛋白家族(HNRNPs)的重要成员[11, 12],参与选择性剪切[13]、RNA加工修饰运输、转录翻译调控[14, 15]、DNA损伤修复等重要生物学过程[16]。HNRNPU的异常表达与胃癌[2]、肺癌[17]、肝癌[18]、神经母细胞瘤[19]等多种肿瘤的侵袭进展以及患者不良预后密切相关。我们之前的研究发现,HNRNPU在发生局部浸润、淋巴结以及远处转移的胃癌患者的组织标本中表达升高,具有重要的临床诊断和治疗意义[2]。作为RNA结合蛋白,HNRNPU可以与一种组蛋白乙酰化酶p300相互作用,富集于超级增强子,促进超级增强子与启动子之间染色质环的形成,进而促进靶基因的表达[2]。但是目前在胃癌中,HNRNPU调控的生物学过程鲜有报道。
本研究通过体外功能实验,发现HNRNPU表达上调会促进胃癌细胞的增殖和侵袭。通过整合紫外交联免疫沉淀测序(crosslinking-immunoprecipitation and high-throughput sequencing, CLIP-seq)数据和敲低HNRNPU后的差异表达基因,结合通路分析发现,HNRNPU调控衰老相关基因,影响细胞衰老的生物学过程。细胞衰老是具有增殖能力的细胞在遭受到端粒功能障碍、氧化应激、染色质结构变化、蛋白毒性等应急信号时诱发的一种细胞周期停滞的状态[20]。衰老细胞的特征是发生形态变化,染色质重塑和代谢重编程,基因表达改变以及出现一种称为衰老相关分泌表型(senescence-associated secretory phenotype, SASP)的促炎症表型[21]。细胞衰老与肿瘤之间的关系具有两面性,衰老可以作为一种有效的抑癌机制,衰老细胞和SASP会造成局部或全身性炎症,破坏正常组织结构和功能,促进肿瘤的恶性表型、转移以及复发[22]。我们的研究发现,在胃癌中,HNRNPU与衰老相关基因CDK2的表达水平呈正相关。HNRNPU通过对抗肿瘤细胞的衰老,促进胃癌的增殖和侵袭。但是对于HNRNPU如何调控CDK2的表达,如何调控细胞衰老进而促进胃癌进展,都有待进一步研究探讨。相信随着对胃癌发生机制研究的不断深入,胃癌的早期诊断和靶向治疗会迎来新的突破。

