金沙江上游苏洼龙水电站建设期影响区域浮游植物群落结构与水质现状分析
陈俭勇,孙婷婷,李红涛,李妮娅,张俊华,张 亚,陶 敏,汤 婷,陈 征,胡江军
(1.武汉中科瑞华生态科技股份有限公司,武汉 430080;2.华电金沙江上游水电开发有限公司,成都 610000)
金沙江是长江的上游河段,一般将玉树直门达至云南石鼓河段称为金沙江上游。上游流域处于昌都地区与川西地槽之间,复式褶皱和斜冲断层发育;流域径流主要来自降雨及融雪补给,年内分配与降水的季节变化基本一致[1,2]。鉴于其地理位置独特、水力资源丰富的特点以及“西电东送”的需求,早期流域内的水电开发规划在近些年逐步进入项目施工期。苏洼龙水电站为金沙江上游流域水电开发规划的13个梯级中的第10级,上游为巴塘水电站,下游为昌波水电站。电站坝址位于四川省巴塘县苏洼龙乡苏洼龙村上游约1 km,坝址左岸为四川省巴塘县,右岸为西藏自治区芒康县。预计形成库区后水库正常蓄水位2 475 m,控制流域面积18.3万km2,库容6.38亿m3,调节库容0.72亿m3,装机容量1 200 MW,电站保证出力306 MW,多年平均发电量54.29亿kW·h[3]。
浮游植物不仅是水域生态系统中重要的初级生产者和食物链的基础环节,而且是水中溶解氧的主要供应者;此外,浮游植物对水环境的变化响应明显,水体水质的变化等直接影响浮游植物的种类组成、群落结构及物种丰富[4,5]。金沙江上游流域地质条件恶劣,公开的水生态环境本底调查资料十分匮乏,加之流域内近些年的水电开发建设逐步落实,从水生生态大保护的角度出发,掌握苏洼龙水电站建设期水生态现状十分必要。本研究通过探究工程建设期影响区域浮游植物群落结构与水质的综合状况,以期为流域水生生态环境和水生生物多样性的保护提供科学依据。
1 材料与方法
1.1 调查范围及采样点位设置
鉴于电站已于2017年11月实现大江截流,导流洞开始导流,河流自然连通性依旧存在;故根据后期库区形成后的回水长度分析,本阶段的调查范围确定为下起坝址下游3.5 km至库尾上游共约60 km的江段。调查小组分别于2019年5月和8月根据代表性原则,在该调查范围内设置5个采样点,由上至下依次为苏洼龙库尾上游6 km(S1,N 29°54′07.00″;E 99°03′11.98″)、苏洼龙库尾(S2,N 29°51′02.65″;E 99°01′26.72″)、苏洼龙库中(S3,N 29°46′07.47″;E 99°00′39.39″)、苏洼龙坝前(S4,N 29°27′24.71″;E 99°03′28.32″)和苏洼龙坝下(S5,N 29°25′06.23″;E 99°03′29.00″),点位详情见图1。
1.2 样品采集及实验室处理方法
根据《水库渔业资源调查规范》(SL167-2014)[6]及《淡水浮游生物研究方法》[7]等相关技术要求及规范进行样品的采集及处理。
浮游植物定性采集采用25号筛绢制成的浮游生物网在水中顺江向拖曳2~3 min收集;定量采集则采用2 500 mL采水器取上、中、下层水样,经充分混合后,保留1 000 mL水样。定性、定量样品均加入1.5%鲁哥氏液固定,经过48 h静置沉淀,浓缩至约30 mL,后期于实验室进行藻细胞密度计数及藻种类鉴定。
水质相关参数的调查方法如下:采用常规的水温计测量水温;LJD-10流速仪测量流速;多参数水质监测仪(YSI 6600)测量pH、电导率、盐度及溶解氧;总氮、氨氮、亚硝酸盐氮、硝酸盐氮和磷酸盐的检测水样均采集1 000 mL并加浓硫酸调至pH为2.0左右后带回实验室按照标准方法进行检测。总氮采用碱性过硫酸钾消解紫外分光光度法(GB11894-89)测定;氨氮采用纳氏试剂分光光度法(GB7479-87)测定;亚硝酸盐氮采用分光光度法(GB7498-87)测定;硝酸盐氮采用酚二磺酸分光光度法(GB7480-87)测定;磷酸盐采用钼酸铵分光光度法(GB11893-89)测定。
1.3 浮游植物密度法评价水质
根据况琪军等[8]的评价方法:当浮游植物细胞密度小于或等于0.5×106cells/L,为极贫营养型;0.5×106~1.0×106cells/L,为贫营养型;1.0×106~9.0×106cells/L,为贫中营养型;10.0×106~40.0×106cells/L,为中营养型;41.0×106~80.0×106cells/L,为中富养型;81.0×106~99.0×106cells/L,为富营养型;大于100.0×106cells/L,为极富营养型。
1.4 浮游植物多样性指数法评价水质
浮游植物调查数据的多样性指数计算处理预分析采用Shannon-wiener物种多样性指数、Margalef物种丰富度指数、Pielou均匀度指数和优势度来分析[9,10,11]。
1)Shannon-wiener多样性指数
式中:S为样品中生物的种类总数;pi为第i种的生物量(Wi)与总生物量(W)的比值(Wi/W)。H与水质的关系为:H≥3.0,清洁;1≥H>3.0,中度污染;H<1,重度污染[12]。
2)Margalef物种丰富度指数
Dma=(S-1)/lnN
式中:S为样品中生物种类数;N为样品中个体总数。Dma与水质的关系为:Dma≥3.0,清洁;1≥Dma>3.0,轻度污染;Dma<1,较重污染[12]。
3)Pielou均匀度指数
J=H/Hmax
式中:H为多样性指数值;Hmax为log2S,表示多样性指数的最大值,S为样品中总种类数。
J与水质的关系为:0
4)优势度(Y)
Y=(ni/N)fi
式中:ni为第i种藻类的个体数,N为所有藻类总个体数;fi为第i种藻类出现的频率。
将优势度Y>0.02的藻类定为优势种[12]。
1.5 数据处理分析
运用SPSS19.0统计学软件进行数据统计分析;采用独立样本t检验分析两个不同时间点多样性指数之间的差异性;采用Pearson相关性分析法分析水质相关参数与浮游植物密度、各门类藻种数的相关性。
2 结果与分析
2.1 浮游植物种类组成
2次调查共采集到浮游植物88种(包括变种),隶属于4门31属。硅藻门为调查水域浮游植物的绝对的优势类群,共79种,占种类总数的89.77%;蓝藻门5种,占种类总数的5.68%;绿藻门3种,占种类总数的5.68%;裸藻门仅1种,占种类总数的1.14%。其中,2019年5月共采集到浮游植物52种,占2次采集浮游植物总种数的59.09%;其中,蓝藻门4种,硅藻门47种,裸藻门1种,未采集到绿藻门。2019年8月共采集到浮游植物70种,占2次采集浮游植物总种数的79.55%;其中,蓝藻门2种,绿藻门3种,硅藻门65种,未采集到裸藻门(图2)。2019年8月浮游植物种类数量显著大于2019年5月;同时,两时期浮游植物种类组成差异较大。

图2 浮游植物的时间分布Fig.2 Temporal distribution of phytoplankton community composition
2019年5月和8月的2次调查中,S1~S5点位依次共调查到浮游植物39种、44种、51种、46种和45种,其中,S1点位和S2点位2次均未采集到绿藻门和裸藻门;S3点位2次均未采集到蓝藻门和裸藻门,S4点位2次均未采集到裸藻门。由图4可看出,5个点位2次调查到的浮游植物总数差异不大,种类组成均以硅藻门为主,蓝藻门和绿藻门次之,裸藻门极少(图3)。浮游植物名录见表1。
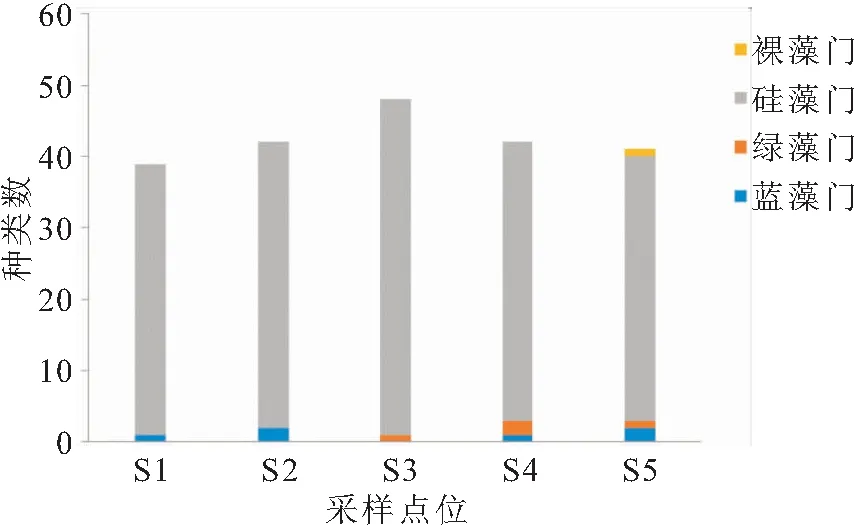
图3 浮游植物的空间分布Fig.3 Spatial distribution of phytoplankton community composition

表1 浮游植物名录Tab.1 Species list of phytoplankton community

续表1

续表1
2.2 浮游植物密度
不同月份各点位中蓝藻细胞密度在0~0.03×106cells/L变化,平均值为0.003×106cells/L;绿藻细胞密度在0~0.02×106cells/L变化,平均值为0.002×106cells/L;硅藻细胞密度在0.05×106~0.20×106cells/L变化,平均值为0.11×106cells/L。由此可得,在浮游植物细胞密度中,硅藻占主要优势,所占比例为96.19%;其次为蓝藻,所占比例为2.41%;绿藻占比最小,为1.40%。从时间来看,5月份各点位浮游植物细胞密度均低于8月。而从采样点位来看,5月份,S3和S4采样点位浮游植物密度最高,S2点位最低;8月份,S3点位浮游植物密度最高,S4点位最低。不同月份各采样点位浮游植物密度见图4。

图4 浮游植物密度变化Fig.4 Temporal and spatial changes of phytoplankton density
2.3 浮游植物多样性分析
根据调查结果,对采集数据进行Shannon-wiener多样性、Margalef丰富度和Pielou均匀度分析(表2)。结果显示,2019年5月Shannon-wiener指数显著小于8月(t=-3.66,P=0.006),说明8月份金沙江苏洼龙段浮游植物物种多样性高于5月份;2019年5月Margalef丰富度指数明显小于8月(t=-3.93,P=0.004),说明8月金沙江苏洼龙段浮游植物整体分布较5月要丰富;2019年8月Pielou指数调查结果与5月相比,总体差异不大(t=0.371,P=0.720),说明5月和8月浮游植物分布均较均匀。
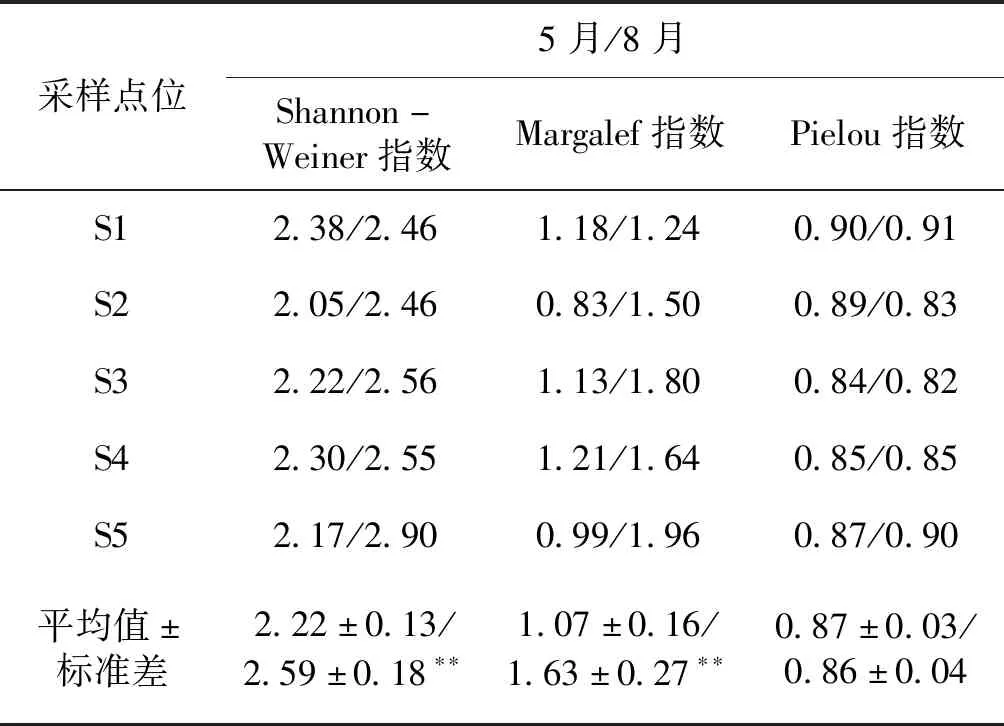
表2 各采样点位浮游植物生物多样性指数Tab.2 Phytoplankton biodiversity indices at each sampling site
2.4 优势种
统计分析得,金沙江苏洼龙段调查期间的浮游植物优势种共10种,2019年5月调查的优势种有6种,均为硅藻门类;2019年8月调查的优势种有8种,均为硅藻门类;其中纤细等片藻、念珠等片藻、极细微曲壳藻和小内丝藻在两次调查期间均表现为优势种。具体结果见表3。
2.5 水质状况
两次调查5个点位的水质相关指标变化如表4。结果可知,各点位8月水温均高于5月水温,两月份水温平均值分别为13.1 ℃和15.9 ℃;同时,各调查点位水温差异不大,在±3.5 ℃范围内波动。S1~S3点位8月份的溶解氧均略低于5月份,而S4和S5点位8月份的溶解氧均略高于5月份。同点位不同时间点的电导率及盐度稍有变化,8月电导率及盐度均低于5月份。除S4点位外,其余点位pH随时间波动不大。各点位硝态氮和氨氮水平均表现为8月份高于5月份,各监测点位的氨氮浓度变化波动较大,范围在0.009~0.329 mg/L之间。总氮浓度变化波动不大,范围在0.494~1.114 mg/L之间。
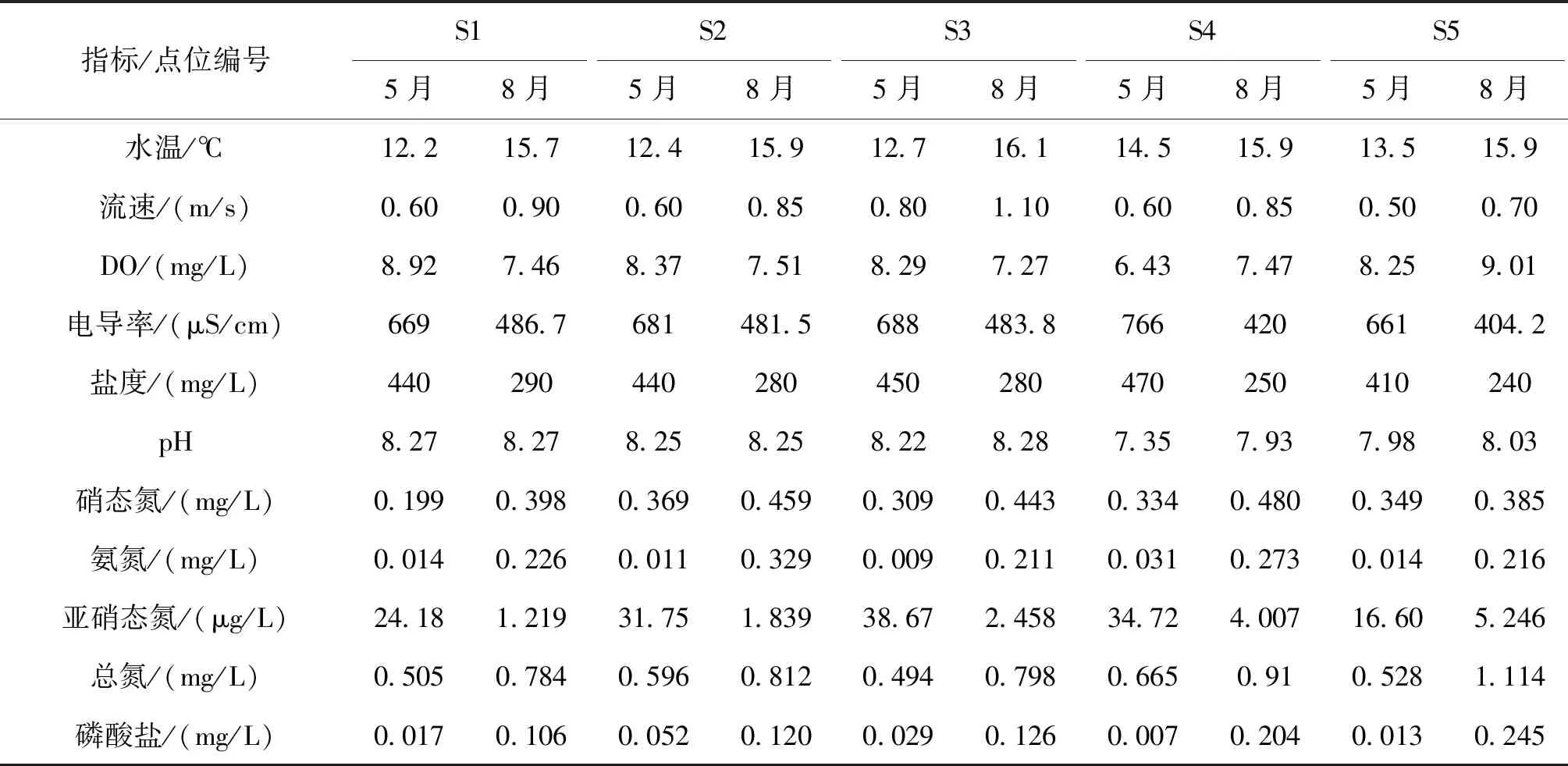
表4 不同调查时间5个点位的水质相关指标变化Tab.4 Water quality-related indicators at each sampling site during different survey period
2.6 浮游植物群落结构与水质指标的相关性分析
运用SPSS19.0对金沙江苏洼龙段浮游植物密度及种类与水质指标进行了Pearson相关性分析(表5),结果显示,在一定范围内,浮游植物密度与水温、氨氮、总氮和磷酸盐浓度呈显著正相关,与电导率和盐度呈显著负相关。受水质影响较大的为硅藻门,硅藻门藻类种数与水温、流速、硝态氮、氨氮、总氮及磷酸盐呈显著正相关,而与电导率、盐度和亚硝态氮呈显著负相关。绿藻门受水质影响次之,绿藻门藻类种数仅与总氮和磷酸盐呈显著正相关,而与电导率和盐度呈显著负相关。蓝藻门和裸藻门藻类种数与水质各指标无显著相关性。
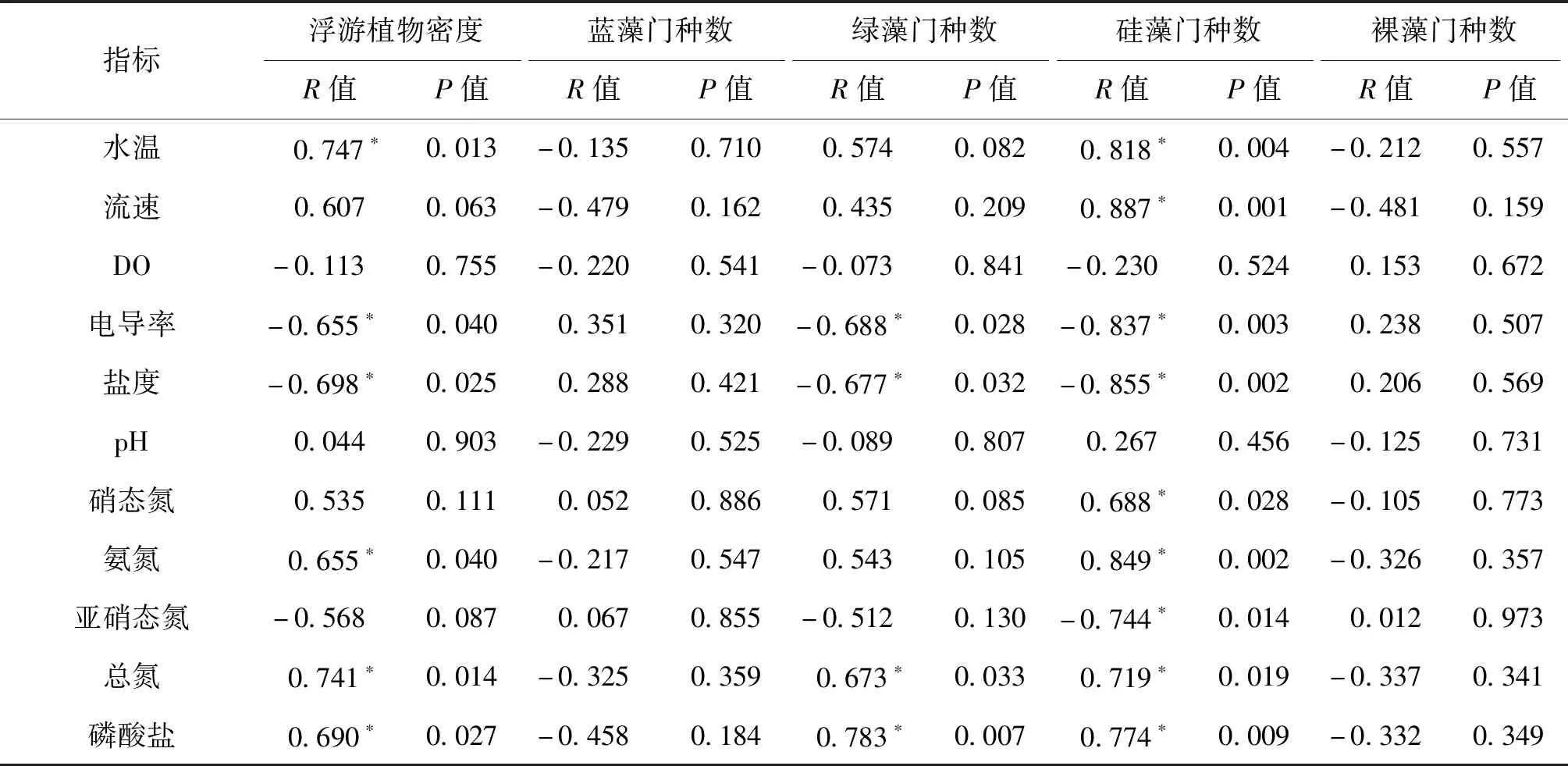
表5 水质指标与浮游植物密度及种数的Pearson相关性分析Tab.5 Pearson correlation analysis of water quality indicators with phytoplankton density and species number
3 讨论
3.1 浮游植物群落特征分析
本研究结果显示,不同季节金沙江上游苏洼龙段浮游植物无论从种类组成还是优势种组成上,硅藻门均呈现绝对优势,可初步判断该河段属典型的硅藻型。与现有的金沙江下游流域数据对比发现,其与金沙江下游水富段硅藻占绝大多数的特征类似[13],分析呈现这一特征的主要原因可能是水温变化影响水体营养盐溶解度、离解度以及藻类对营养盐的吸收率进而间接影响藻类的生长[14]。一般认为,藻类生长存在一定的水温阈值,当水温在20 ℃左右时,水体中以硅藻门为主,当水温在30 ℃左右时,水体中以绿藻门为主,当水温在40 ℃左右时,水体中以蓝藻门为主[15]。本研究中,调查区域水温最高为16.1 ℃,这与水体中以硅藻门为主相符合。
藻类细胞密度研究结果显示,不同月份浮游植物细胞密度平均值均小于0.5×106cells/L,初步判定其水质营养水平属于极贫营养级[8]。此外,蓝藻和绿藻细胞密度平均值分别为0.003×106cells/L和0.002×106cells/L,而硅藻细胞密度平均值为0.11×106cells/L,高出蓝藻和绿藻两个数量级,且8月份丰水期各点位藻类密度均高于5月份平水期,分析这可能与硅藻占藻类种类的绝大多数以及丰水期带来的营养盐物质稍加丰富,且气温较高更适合藻类生长繁殖有关。浮游硅藻群落被认为是湍流期或在低光照、低温和非极度贫营养的水体中的有利竞争者[16]。而两次调查的优势种均为硅藻门类,因此,本研究中优势种的表现与金沙江上游河段水体及流态特征相符。金沙江中下游(石鼓-宜宾)典型河段的浮游植物群落分析结果显示,硅藻是优势门类,从细胞密度和生物量来看,优势种均为硅藻门类的曲壳藻、尖针杆藻和小环藻等[17],这与本研究具有一定相似性,说明金沙江的硅藻群落在河流生态系统中占有重要地位。综上所述,金沙江上游低温低营养盐水质直接促进了水体中的硅藻型浮游植物群落。
3.2 金沙江苏洼龙段水质特征分析
一般来讲,浮游植物多样性指数是常用的水质评价指标,水质较好的水体拥有较为稳定的浮游植物群落,且这些浮游植物均具有较高的生物多样性指数及均匀度指数[18]。相反地,当水质受到污染时,敏感种大量消失,抗性种取代其成为优势种,群落结构趋于单一化,稳定性降低,多样性指数明显减小[19]。Pielou均匀度指数反映了各物种个体数目分配的均匀程度,每种的个体数越接近,则各种个体数分布的均匀度就越高,反之则越低;而Margalef指数通常反映一个群落或环境中物种数目的多寡,亦表示生物群聚中种类丰富度程度[20]。本研究Shannon-wiener指数、Margalef丰富度指数比较说明8月份丰水期金沙江苏洼龙段浮游植物群落结构及丰富度均优于5月份平水期;Pielou指数说明2季节浮游植物均匀度总体差异不大。按各类指数与水质关系的评价标准得出,1≥Shannon-Weiner指数>3.0,中度污染;1≥Margalef指数>3.0,轻度污染;1>Pielou指数≥0.5,轻度或无污染;结合浮游植物细胞密度分析,综合评价说明金沙江苏洼龙段水质目前为轻污染极贫营养型。而根据水质调查现状分析可得,各点位的氨氮浓度在0.009~0.329 mg/L波动,波动较大,但符合《地表水环境质量标准》中的Ⅱ类水标准。各监测点位的总氮浓度在0.494~1.114 mg/L波动,波动不大,符合《地表水环境质量标准》中的Ⅳ类水标准。整体来看,水质基本满足Ⅲ类水标准,存在较轻污染,这与浮游植物多样性指数评价水质的结果基本吻合。
3.3 浮游植物与环境因子的关系分析
研究表明,浮游硅藻的主要生长调节因子是湍流、小气候、温度、营养物质(硅、磷、氮和铁)和生物相互作用等[21]。本研究中浮游植物以硅藻门为绝对优势种,结果显示硅藻门藻类种数与水温、流速、硝态氮、氨氮、总氮及磷酸盐呈显著正相关,而与电导率、盐度和亚硝态氮呈显著负相关。在大渡河相关调查研究中,Pearson相关性分析显示,影响浮游植物密度的主要因子是水温、流速和透明度[22]。对三峡水库干流的底栖硅藻进行研究时发现,非蓄水期显著影响长江干流底栖硅藻群落组成的环境因子是pH、流速和正磷酸盐[23]。本研究与这些结果具有一定相似性。温度是藻类生长和光合作用等生命活动的重要影响因素,且水的比热容大,对气温的响应迅速,所以在高海拔、低气温的高原地区,适应性较强的硅藻能发挥绝对优势。流速作为重要的水动力学指标之一,其对水体溶解氧及营养盐的带动作用十分明显。在不同水动力条件下的河流硅藻群落分布的相关研究中发现,流速是影响硅藻群落分布最主要的水动力学因素之一[24],这与本研究中流速与硅藻种类数呈正相关具有一定相似性。氮磷营养盐会影响藻类群落构建,对鄱阳湖浮游植物群落的研究发现,藻类群落的分布主要受总磷、硝氮、氨氮的影响[25]。而在贵州三板溪水库的相关研究发现,氮磷营养盐主要通过促进硅藻及抑制蓝藻来影响浮游植物群落动态[26]。而本研究发现浮游植物密度与氨氮和总氮呈正相关,而硅藻种类数则与硝态氮、氨氮、总氮及磷酸盐均呈显著正相关。一般来讲,水体盐度和电导率呈正比,盐度越高电导率越大。在研究长江口浮游植物群落特征时发现,浮游植物物种数和总细胞丰富度与盐度呈负相关,对调查水域浮游植物种类和密度的分布影响较为显著的环境因子为盐度、电导率、溶氧量、温度和叶绿素a[27],这与本研究中浮游植物密度以及硅藻种类数与盐度和电导率呈负相关的结论具有一定的一致性。
此外,浮游植物群落结构不仅受水温、流速以及氮磷营养盐等因素的限制,还受水文条件的影响较大。比如,在研究三峡水库175 m蓄水前后香溪河库湾浮游植物的群落结构时发现,蓄水前后浮游植物密度随时间变化呈降低趋势;浮游植物时间差异显著,由绿藻向硅藻演替;营养物质、光热条件等环境因子时间差异明显[28]。在研究坝式水电站蓄水前后对浮游植物的影响时发现,蓄水后浮游植物的种类数量和种类组成发生较大变化,优势种群发生变化,库区具有向湖泊化演化的趋势,枢纽建设营运后浮游植物种类显著增加,浮游植物中适应静水生活的小型种类增加[29]。苏洼龙水电站属于典型的坝式水电站,工程完工蓄水运行时,河流连通性遭到破坏,蓄水将导致库区河道水面明显变宽,水域面积大幅度增加,水位抬高,库区水流变缓,天然河流变成了有大坝阻隔的不连续水体,届时浮游植物的群落结构势必会发生改变,库区浮游植物群落将逐渐由适应流水类型向适应静水类型转变。此外,水库蓄水后,流速减小,使污染物扩散能力降低,水体复氧能力减弱,深层水体溶解氧含量偏低。蓄水初期,由于库底残留的有机物分解,土壤中氮、磷、有机质等进入水体,短期内营养物质含量可能会有所增加,进而影响浮游植物群落结构。因此本研究是在金沙江上游河流连通性尚完整的情况下对局部河段浮游植物群落现状进行的简要描述分析,对后期研究库区浮游植物群落演变具有参考意义。但影响该区域浮游植物群落结构及水质的因素较多,如何客观地评价二者之间的关系还应从数据的周年性变化及整个流域的生态层面出发进行进一步有效调查研究。

