聚乳酸-己内酯/纤维蛋白原纳米纤维基补片的制备与表征
杨 刚, 李海迪, 乔燕莎, 李 彦, 王 璐, 何红兵
(1. 东华大学 纺织学院, 上海 201620; 2. 东华大学 纺织面料技术教育部重点实验室, 上海 201620;3. 上海松力生物技术有限公司, 上海 201100)
疝气属于普外科常见的疾病[1],统计显示全球范围内的发病率为3%~5%[2],高于任何一种恶性肿瘤[3]。目前,只有通过手术才能治愈疝病,且无张力疝修补术是最主要的临床治疗方案[4],其修补原理是通过缝入疝修补材料,降低组织之间的牵拉,从而降低复发率。该手术恢复期短,但相应对疝修补片材料的各方面性能要求也较高。
疝修补片按材料可分为3类:合成补片、复合补片以及生物补片。合成补片根据其材料是否能够被宿主机体吸收又分为可吸收补片和不可吸收补片。可吸收补片因植入体内后发生降解,在力学性能的持久性上存在问题,易导致疝的复发[5]。不可吸收补片力学性能虽稳定可靠,但往往会导致异物反应且伴随着一系列的并发症[6-7]。相比之下,结合不同材料优势的复合疝气修补片改善了单一材质补片存在的上述缺陷,但也面临制备工艺过于复杂、顺应性较差等不足,限制了其在市场上大规模推广与应用。在巨大市场需求的推动下,取材异体或异种的生物补片应运而生。如利用猪小肠黏膜组织制备的猪小肠黏膜下层(SIS)生物补片,该补片含多层结构,具有细胞外基质的超高生物活性且极易被机体完全吸收[8]。该类补片所具有的生物相容性是其他类型补片无法相比的,然而有限的供体来源使得该类补片价格十分昂贵,且具有免疫原性风险,降解过程受患者自身情况影响过大,植入机体后补片本身的降解与组织重建是否可达到平衡存在不确定性,最终导致修补重建失败[9]。因此,如何完善补片材料的结构与性能,为腹壁组织的再生长提供良好条件,是当前疝修补领域亟需解决的关键问题之一。
静电纺纳米纤维膜可构建与生物补片相近的三维网络结构,可为细胞黏附和组织再生提供充足的空间[10-11]。聚乳酸-己内酯(P(LLA-CL))是一种具有良好力学性能、组织相容性、生物可降解性且易加工成形性的材料,在构建韧带、软骨、血管等的研究中作为组织工程支架引起了广泛关注[12]。速溶型外科用冻干纤维蛋白胶(商品名:创恤封®)取材广泛,均来自于猪血浆,含有丰富的生长因子。在临床使用中具有减少术后失血量、降低术后感染率、减少黏连、减少疤痕形成促进创伤愈合等特点[13]。
本文拟将以P(LLA-CL)和纤维蛋白原为原料,利用静电纺丝技术构建一种生物相容性良好,且具有一定力学性能、可诱导组织再生的新型疝修补片,从而有望满足疝修补领域的临床需求。
1 实验部分
1.1 实验材料与仪器
聚乳酸-己内酯(P(LLA-CL))聚合物(山东济南岱罡生物科技有限公司),六氟异丙醇(上海多氟新材料科技有限公司),猪血浆中提取的纤维蛋白原(上海松力生物技术有限公司),10倍浓度杜氏改良Eagle培养基(DMEM)(上海源叶生物科技有限公司),CCK-8细胞计数试剂盒(同仁化学研究所,日本)。
NEU静电纺丝机(捷克Elmarco公司);FlexSEM1000型扫描电子显微镜(日本日立公司);Nicolet 6700型傅里叶变换红外光谱仪(美国Thermo Scientific公司);Escalab 250Xi 型X射线光电子能谱(美国Thermo Scientific公司);OCA15EC型水接触角测量仪(美国Dataphysics公司);CMT6104型万能电子试验机(美国Instron公司)。
1.2 P(LLA-CL)/纤维蛋白原补片的制备
用六氟异丙醇配制体积质量分数为8%的P(LLA-CL)溶液,用六氟异丙醇/去离子水(体积比为9∶1)配制100 mg/mL的纤维蛋白原溶液。把P(LLA-CL)溶液与纤维蛋白原溶液分别按1∶0、2∶1、1∶1、1∶2、0∶1体积比进行混合,静电纺丝机参数设置为:电纺距离12 cm,纺丝电压3 kV,纺丝液喷出速度1 mL/h,接收滚筒转速300 r/min,喷头横移速度15 cm/min。将最终得到的静电纺丝膜于干燥条件下保存备用。
1.3 性能表征
1.3.1 微观形貌表征
将5组不同比例的P(LLA-CL)/纤维蛋白原静电纺丝膜喷金镀膜后用扫描电镜观察纤维的微观形貌。纤维直径用图像分析软件Adobe Acrobat Reader测定。
1.3.2 孔隙率测定
将各组样品裁剪成长方形,采用称量法,通过精确测量静电纺丝膜的尺寸和厚度计算体积,称量得到各自的干态质量,最终算出静电纺丝膜的密度和孔隙率,每组测量3个样品并计算平均值。
1.3.3 表面成分测定
将5组不同比例的P(LLA-CL)/纤维蛋白原静电纺丝膜进行红外和光电子能谱测试,分析对应样品表面化学键和元素类别与分布。
1.3.4 水接触角测试
水接触角可反映不同配比的P(LLA-CL)和纤维蛋白原对补片表面亲疏水性的影响。在静电纺丝膜样品表面滴上约5 μL的去离子水,稳定10 s后拍摄。每种样品随机选择5个区域测试。
1.3.5 力学性能测试
将各组静电纺丝膜裁剪成长为45 mm,宽为7.5 mm,最窄处2 mm的哑铃状,厚度精确到0.01 mm。拉伸速率为10 mm/min。每组测试5个样品,根据应力-应变曲线计算各组静电纺丝膜的断裂强度、弹性模量及断裂伸长率。
1.4 细胞实验
1.4.1 细胞毒性实验
为验证P(LLA-CL)/纤维蛋白原静电纺丝膜对细胞有无毒性,将小鼠成纤维细胞(L929)以每孔5 000个置于96孔细胞培养板中培养24 h,之后弃去原培养液,更换成P(LLA-CL)与纤维蛋白原体积比为1∶1的静电纺丝膜浸提液100 μL进行培养,并设置阴性对照(0.2 mg/mL高密度聚乙烯浸提液)、阳性对照(含5%甲基亚砜的细胞培养液)以及空白对照(细胞培养液)样本。每2 d更换培养液,每组设3个复孔。以24、48、72 h为3个时间节点培养后,采用CCK-8细胞计数试剂盒进行评价。为评价细胞毒性,通过下式计算相对增殖率:
RGR=A/A0×100%
其中:A为样品组培养不同时间点的细胞的吸光度;A0为对应时间点空白对照组的细胞的吸光度。
根据RGR值按表1进行分级标准判定,其中毒性反应级别在Ⅰ级以下可判断材料合格。

表1 细胞毒性反应分级
1.4.2 细胞黏附与增殖实验
为探究细胞在不同比例的P(LLA-CL)/纤维蛋白原补片上的黏附与增殖情况,将已灭菌的各组静电纺丝膜片置于96孔板中,并设置空白对照,重复5块孔板。将L929以4×104个/mL细胞浓度接种于96孔板中,每孔150 μL,稳定后置于37 ℃、5% CO2的培养箱内静置培养。在4、24、72、120、168 h时,仍采用CCK-8细胞计数试剂盒进行评价。细胞黏附率Rv的计算公式为
Rv=AXT/ABC×100%
式中:AXT为各样品培养的各时间点的表面黏附细胞的吸光度值;ABC为培养时间最长的空白板表面黏附细胞的吸光度值。
2 结果与讨论
2.1 P(LLA-CL)/纤维蛋白原补片的形貌
图1示出各组复合静电纺丝膜纤维的SEM照片。图2示出纤维的平均直径分布。

图2 纤维的直径分布图
图1显示,各组样品均具有连续、完整的电纺纤维网,大量纤维无规律交叉分布,形成较为松散的结构。纯P(LLA-CL)及纤维蛋白原膜片纤维平均直径分别为(415±83)nm及(197±53) nm,体积比为2∶1、1∶1及1∶2各组膜片的纤维平均直径分别为(353±75) 、(331±71)、(234±66) nm。说明通过静电纺丝制备的复合纤维直径分布离散较大,既有纳米级纤维形成又同时分布有亚微米级纤维,且随着纤维蛋白原比例的逐渐提高,静电纺丝膜的纤维直径逐渐减小。导致这一现象的主要原因是纤维蛋白原改变了电纺溶液的电荷密度,使得电场对喷出溶液的拉伸作用增强,导致静电纺丝膜的纤维直径随纤维蛋白原比例的升高而减小,进而孔隙率也随之升高。
2.2 孔隙率分析
各组样品的孔隙率如表2所示。由数据可知,各组不同比例的静电纺丝膜样品的孔隙率均较高,也基本符合SEM照片所观察到的结果。通过对比数据可知,膜片的孔隙率随着纤维蛋白原比例的增加呈增高趋势。

表2 不同体积比下P(LLA-CL)/纤维蛋白原静电纺丝膜孔隙率
2.3 成分分析

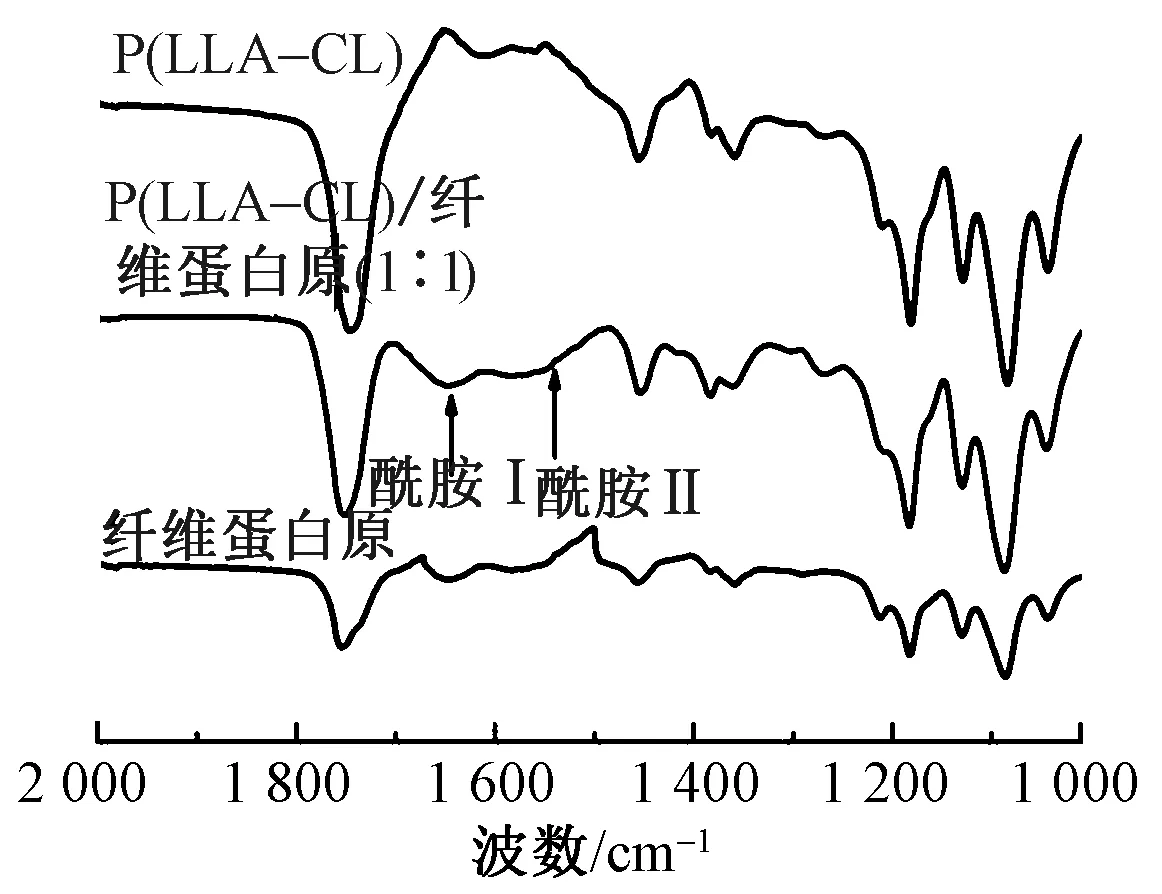
图3 不同样品的红外光谱图
为进一步证实P(LLA-CL)与纤维蛋白原的成功结合,表3示出通过XPS分析的每组静电纺丝膜的元素构成比例情况。结果表明,P(LLA-CL)表面只有C元素和O元素,加入纤维蛋白原后,标志着N元素和S元素的新峰出现,并且随着纤维蛋白原比例的提高,N、S峰值逐渐增加,进一步表明了纤维蛋白原的成功负载。
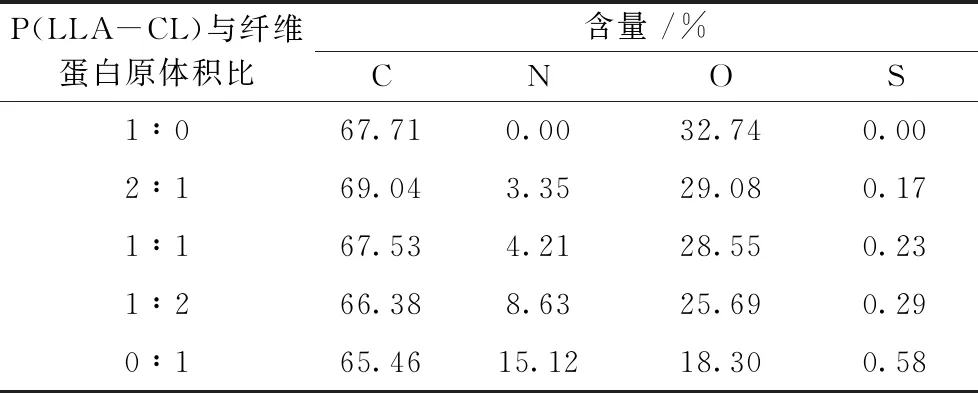
表3 不同体积比P(LLA-CL)/纤维蛋白原复合静电纺丝膜各元素相对含量
2.4 接触角分析
图4、表4示出各组膜片上水接触角的照片及数值。可以看出,因P(LLA-CL)为疏水材料,其接触角为137°±4.5°,且随着纤维蛋白原比例的增加,接触角逐渐变小。在纯纤维蛋白原膜片上水接触角降至最低,为19.3°±3.3°。由于纤维蛋白原的氨基酸组成中含有羧基,氨基等亲水基团,进而使得复合静电纺丝膜的亲水性提高。
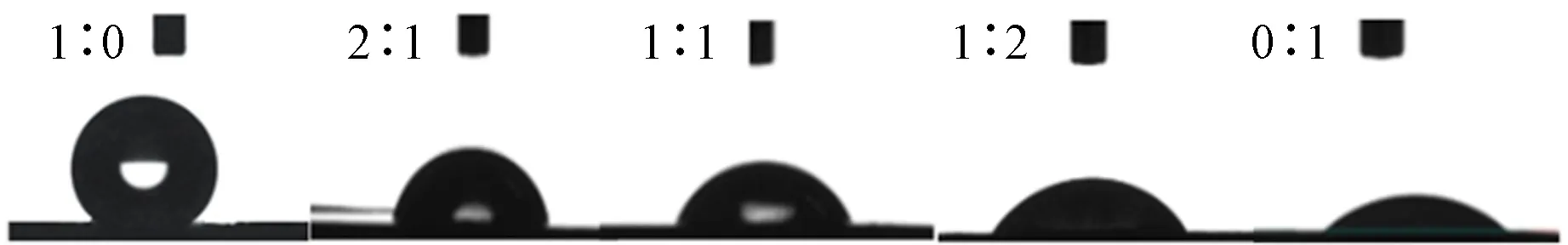
图4 不同样品的水接触角图片
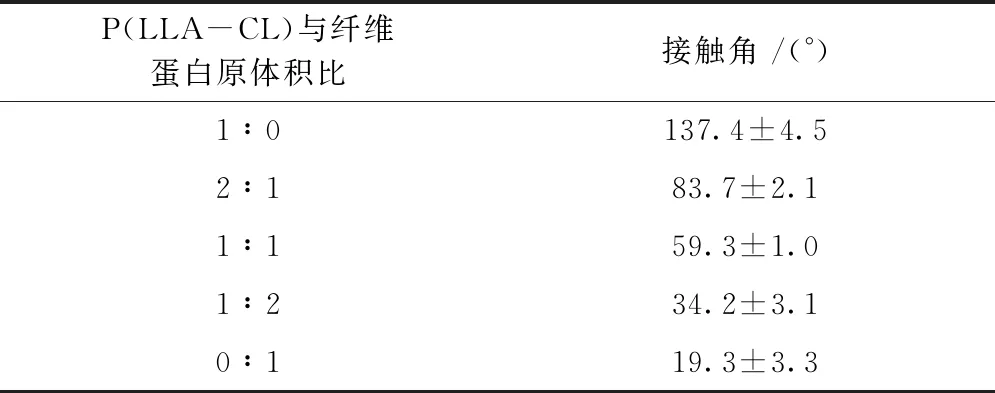
表4 不同体积比P(LLA-CL)/纤维蛋白原复合静电纺丝膜的接触角
2.5 力学性能分析
图5示出P(LLA-CL)/纤维蛋白原复合静电纺丝膜的应力-应变曲线。表5示出通过曲线得到的各组样品的拉伸强度、弹性模量及断裂伸长率。应力-应变曲线显示,纯P(LLA-CL)静电纺丝膜具有较高的拉伸强度(8.1±0.14)MPa、断裂伸长率(190.23±15.14)%和较低的弹性模量(5.48±0.35) MPa具备弹性材料的一般特点。抗拉强度高于脱细胞处理后的SIS(约7.5 MPa)。而纯纺的纤维蛋白原静电纺丝膜拉伸强度只有1.36 MPa,断裂伸长率为(21.34±4.23)%,表现出脆性的特征。P(LLA-CL)在与纤维蛋白原结合后,会发生降低断裂伸长率,增高弹性模量的力学性能变化;但拉伸强度表现尤为不同,当体积比为2∶1及1∶1时,复合膜片拉伸强度变化不大,但由于纤维蛋白原本身的力学性能不足,所以当其比例增大到一定程度,即体积比达到1∶2时,则可引起拉伸强度显著降低。P(LLA-CL)/纤维蛋白原复合静电纺丝膜的力学性能优于脱细胞处理后的小肠黏膜,通过增加纺丝时间和纺丝液使用量,适当增加补片的厚度,有望进一步提升力学强度。
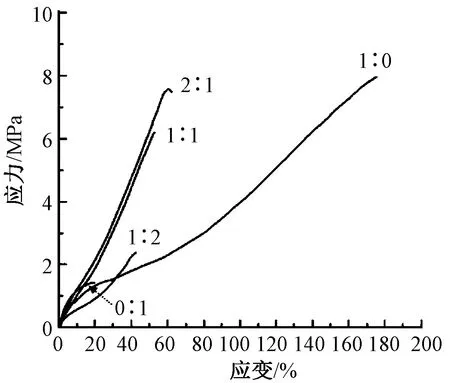
图5 不同比例下静电纺丝膜应力-应变曲线

表5 不同体积比P(LLA-CL)/纤维蛋白原静电纺丝膜力学性能
2.6 细胞毒性分析
各实验组不同时间点的吸光度见图6。由此测算出的相对增值率值见表6。P(LLA-CL)/纤维蛋白原组的L929相对增殖率均在80%以上,与阴性对照组均无明显差异。根据评分标准,分值均在I级以下。阳性对照组均在30%以下,评级为IV。由此可知,P(LLA-CL)/纤维蛋白静电纺丝膜的细胞相容性良好,无细胞毒性。
2.7 细胞黏附与增殖分析
L929在不同基底上黏附与增殖结果见图7及表7。
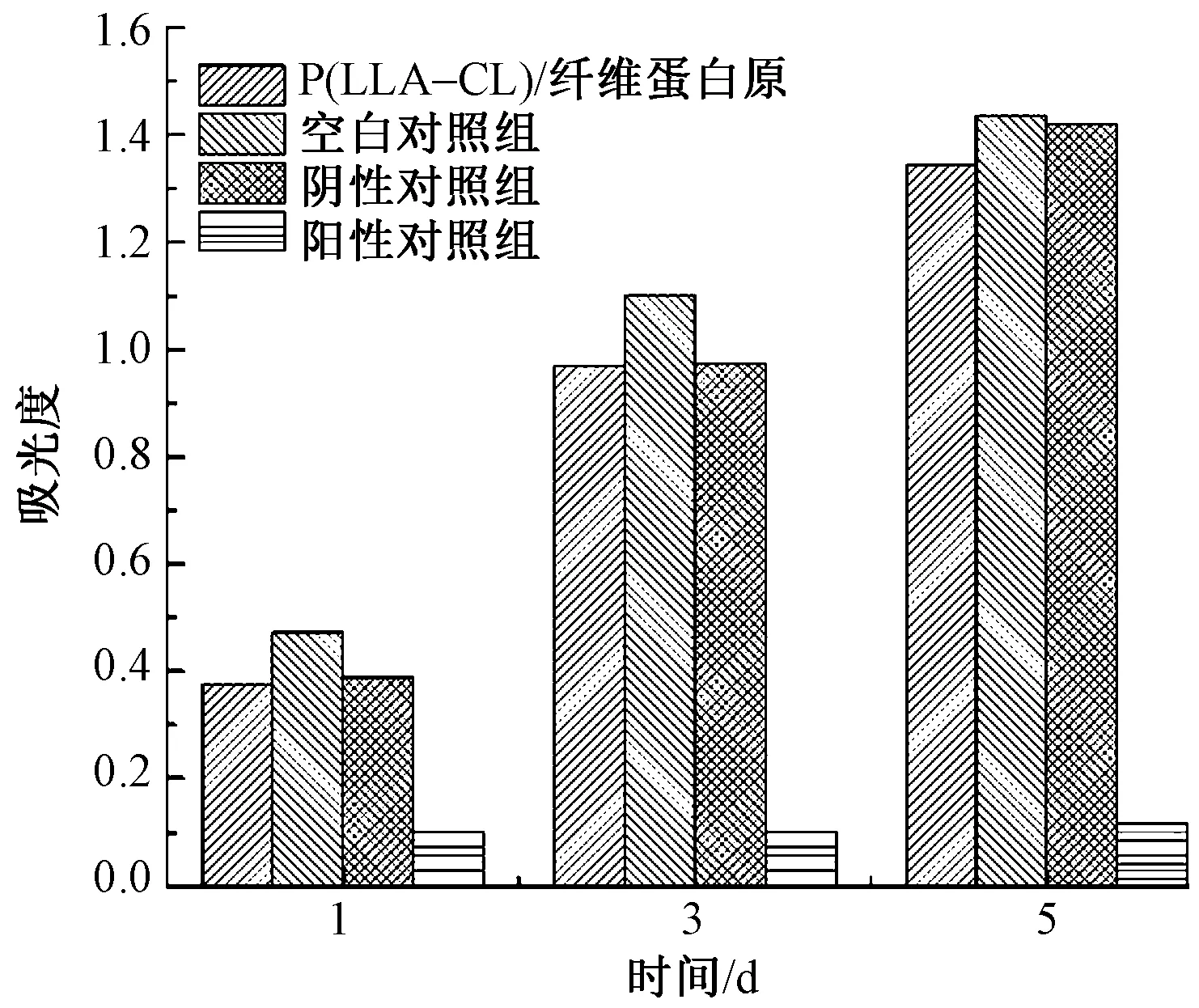
图6 不同样品的细胞毒性
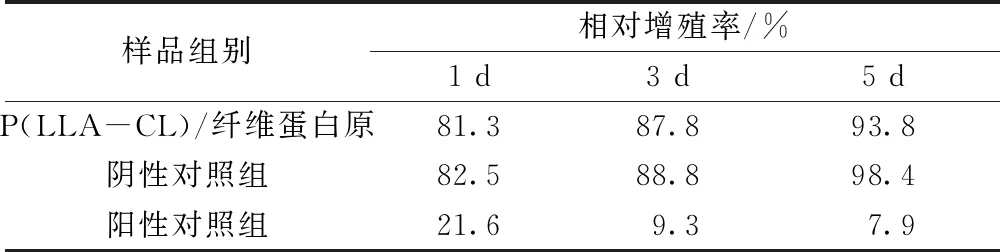
表6 不同样品的相对增殖率值
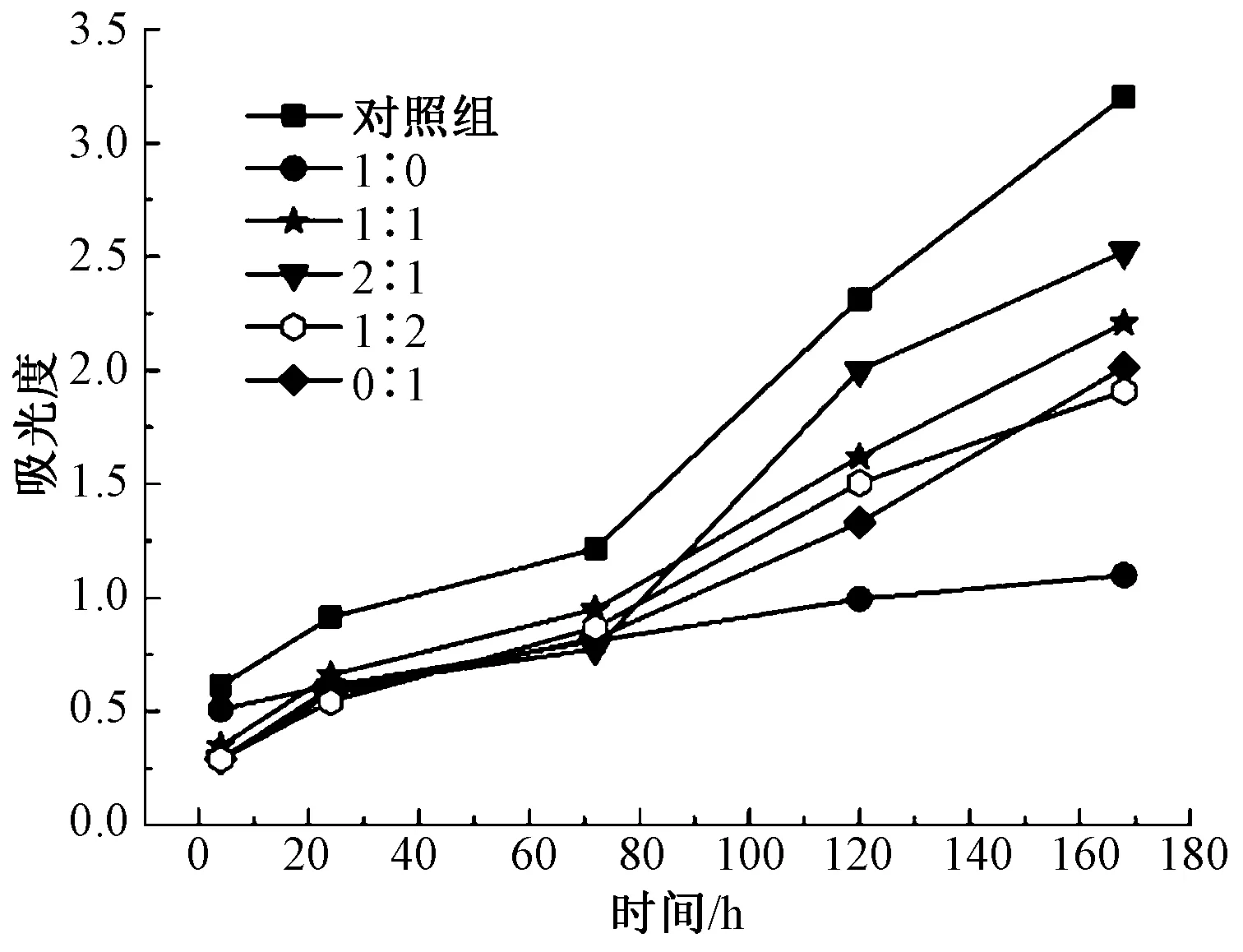
图7 L929在不同基底上的黏附细胞的吸光度值
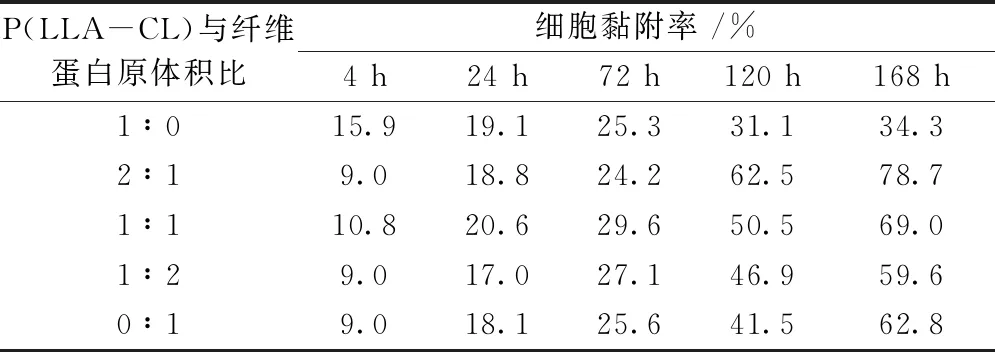
表7 L929细胞在不同样品表面培养后的黏附率
种植后的细胞会先后发生黏附与增殖现象,4 h时吸光度值基本可以反映细胞在静电纺丝膜上的黏附数量。图中显示培养4 h后P(LLA-CL)膜片上的细胞数比其他实验组多,表明细胞在P(LLA-CL)黏附能力更好。空白对照组中的L929细胞在3 d后逐渐进入到对数生长期,与P(LLA-CL)膜片上的L929不同,黏附在P(LLA-CL)/纤维蛋白原复合膜上的L929细胞在3 d后增殖明显变快。第7天后,体积比为2∶1的P(LLA-CL)/纤维蛋白原静电纺丝膜组的细胞增殖速度最快,其次是体积比为1∶1、1∶2的静电纺丝膜组,而黏附在P(LLA-CL)静电纺丝膜上的细胞增殖速度慢。这种现象的发生可能和纤维蛋白原表面上与细胞黏附有关的位点逐渐暴露有关,有报道称纤维蛋白原的氨基基团在细胞增殖中逐渐发挥生长因子的作用[14]。Lee等[15]也证实,10%的明胶浓度使复合膜具有更好的NIH-3T3细胞相容性。
3 结 论
1)聚乳酸-己内酯(P(LLA-CL))与纤维蛋白原共混后进行静电纺丝,成功制备了高孔隙率的纳米纤维膜,且证实了纤维蛋白原的存在。同时,实验结果表明,纤维蛋白原的加入改变了P(LLA-CL)原有的力学性能,并提高了其亲水性。
2)P(LLA-CL)/纤维蛋白原复合膜具有良好的细胞相容性,且因纤维蛋白原富含生长因子,促进了细胞的增殖。
3)通过P(LLA-CL)与纤维蛋白原复合构建的纳米纤维膜,具有潜在的诱导组织再生能力,有望应用于疝修补领域中。

