NLRCs基因在乳腺癌中的表达和预后判断中的价值*
禚映辰,张培国,张李婷,封卫毅
710061西安,西安交通大学第一附属医院 药学部(禚映辰、张李婷、封卫毅); 255000山东 淄博,淄博市中心医院 疼痛科(张培国)
乳腺癌是全世界妇女目前面临的最为常见的癌症。世界卫生组织数据显示,2018年全球约63万人死于乳腺癌,新增病例209万[1]。尽管在诊断和治疗水平方面取得了很大的进步,但乳腺癌仍然是女性癌症死亡的主要原因,约占女性癌症死亡的25%[1]。因此,寻找乳腺癌预后判断的潜在指标和药物靶点具有重要的临床意义。
越来越多的研究表明,肿瘤的发生和进展与免疫相关分子密切相关[2]。核苷酸结合寡聚化结构域样受体家族[nucleotide-binding oligomerization domain(NOD)-like receptors,NLRs]是一类存在于胞质中的模式识别受体,可分为5个亚家族:NLRA、NLRB、NLRC、NLRP和NLRX[3]。NLRs家族成员参与免疫和炎症相关的程序识别,在调节病原体感染以及细胞损伤引起的炎症反应方面起着重要作用[3]。其中NLRC家族共有五个成员,即NLRC1、NLRC2、NLRC3、NLRC4和NLRC5。研究表明,NLRCs大多为固有免疫细胞炎症信号通路的调节剂[4],但目前对于NLRCs在乳腺癌预后中的价值仍知之甚少。因此,本研究将利用学术界广泛认可的生物信息数据平台,深入研究NLRCs与乳腺癌特别是浸润性乳腺癌的关系,探讨其在乳腺癌诊断和预后评估中的价值,以期为进一步研究乳腺癌发生发展中的作用机制提供有价值的佐证。
1 资料与方法
1.1 Oncomine 数据库提取数据
Oncomine数据库是一个在线癌基因芯片数据库,包括715个数据集和86 733个样本(www.oncomine.org)[5]。本研究中,设定的以下检索条件:1)“gene:NLRC1”;2)“cancer type:breast cancer”;3)“data type:all”;4)“analysis type:cancervsnormal analysis”;5)“threshold by:P<0.05,fold change>2,gene rank=top 10%”。NLRC2、NLRC3、NLRC4和NLRC5基因依次按上述方法检索。
1.2 TIMER数据库进行生存分析
TIMER数据库是系统性分析不同癌症类型免疫细胞浸润的在线数据库(https://cistrome.shinyapps.io/timer/)。本研究中,应用Survival模块探究基因表达和临床结局之间的关系。
1.3 生物信息学数据库提取数据
从UCSC-Xenc下载TCGA-BRCA数据集,筛选浸润性乳腺癌NLRC3基因表达谱及患者的临床信息数据(https://xenabrowser.net/)。以NLRCsmRNA表达水平中位数为界,将患者分为高表达组和低表达组,结合患者临床病理参数,如性别、年龄、TNM分期和肿瘤分级,进行统计分析。
1.4 Kaplan-Meier Plotter数据库进行生存分析
使用Kaplan-Meier Plotter在线数据库的3 951个breast cancer数据集(http://kmplot.com/analysis/index.php?p=service),分析5个NLRCs基因表达数据与患者生存时间的关系。本研究中,设定的以下检索条件:1)“cancer:breast cancer”;2)“gene symbol:NLRC1”;3)“split patients by:median”;4)“survival: RFS ”或“OS”;由“follow up threshold:180 months”。NLRC2、NLRC3、NLRC4和NLRC5基因依次按上述方法检索。无复发生存期(recurrence-free survival,RFS)、总生存期(overall survival,OS)。
1.5 统计学方法
本研究采用独立样本t检验比较乳腺癌组织与正常乳腺组织中NLRCsmRNA的表达量的差异;采用 Kaplan-Meier Plotter方法和Log-rank检验分析NLRCs表达与浸润性乳腺癌预后的关系;采用GraphPad Prism 8软件和χ2检验或Fisher确切概率法分析NLRC3表达与临床病理特征的关系。P<0.05被认为具有统计学意义。
2 结 果
2.1 临床常见肿瘤中NLRCs 的转录水平
Oncomine数据库中共收集了1 514项关于NLRCs基因在不同类型癌组织和正常组织样本中差异表达的研究数据(图1),表达差异有统计学意义的研究结果有91项,其中表达升高47项,表达降低44项。在乳腺癌中表达升高13项,表达降低2项。

图1 NLRCs在不同肿瘤组织中mRNA的转录水平
2.2 NLRCs基因在乳腺癌和正常组织中的表达差异
对15项关于乳腺癌组织和乳腺正常组织NLRCs基因有差异表达的研究数据进行分析(表1),发现乳腺癌患者的NLRC2mRNA表达水平在5项研究数据集中显著上调(P<0.05)。在TCGA数据集中,浸润性乳腺癌NLRC2mRNA的转录水平为正常组织的3.053倍,浸润性小叶癌为2.165倍,浸润性导管癌为2.655倍。在Curtis等[6]和Finak等[7]数据集中,乳腺髓样癌和浸润性乳腺癌NLRC2mRNA的转录水平分别为正常组织的2.192和3.692倍。
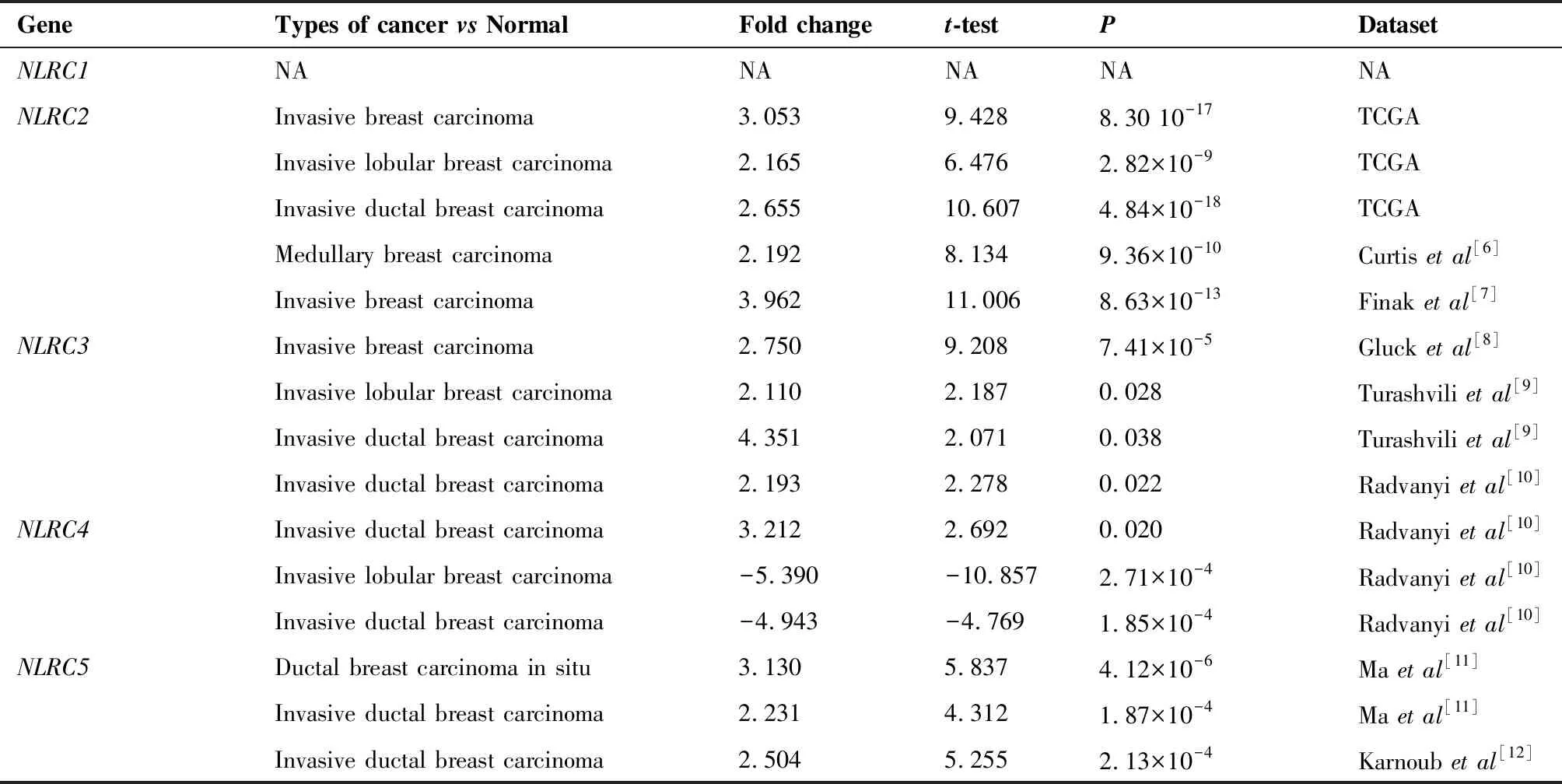
表1 NLRCs基因在乳腺癌组织和正常组织中的表达差异
乳腺癌患者的NLRC3mRNA表达水平在4项研究数据集中显著上调(P<0.05)。在Gluck等[8]数据集中,浸润性乳腺癌NLRC3mRNA的转录水平为正常组织的2.750倍;在Turashvili等[9]数据集中,浸润性小叶癌和浸润性导管癌NLRC3mRNA的转录水平分别为正常组织的2.110和4.351倍;在Radvanyi等[10]数据集中,浸润性导管癌NLRC3mRNA的转录分别为正常组织的2.193倍。
NLRC4mRNA表达在1项数据集中明显地上调,而在2项数据集中显著下调(P<0.05)。在Radvanyi等[10]数据集中,浸润性导管癌NLRC4mRNA的表达既表现为上调又表现为下调,而正常组织中NLRC4mRNA的表达是浸润性小叶癌的5.390倍。
NLRC5mRNA表达水平在3项研究数据集中显著上调(P<0.05)。在Ma等[11]数据集中,乳腺导管原位癌和浸润性导管癌NLRC5mRNA的转录水平分别为正常组织的3.130和2.231倍;在Karnoub[12]数据集中,浸润性导管癌NLRC5mRNA的转录水平为正常组织的2.504倍。
2.3 NLRCs在浸润性乳腺癌(非特殊型)中的表达
乳腺癌病理分型众多,NLRCs基因对不同分型乳腺癌的影响存有差异。为了使研究更加具有针对性,我们将以浸润性乳腺癌(非特殊型,约占整个乳腺癌的80%~90%)为研究对象,进一步细化研究。通过对Oncomine数据挖掘,发现共有15项关于NLRCs在浸润性乳腺癌与正常组织中的表达差异分析的研究,整合这15项的研究结果显示(图2),NLRC2/3/4/5在浸润性乳腺癌中表达量显著高于正常组织(P<0.05);NLRC1在浸润性乳腺癌中的表达与正常组织差异无统计学意义(P>0.05)。
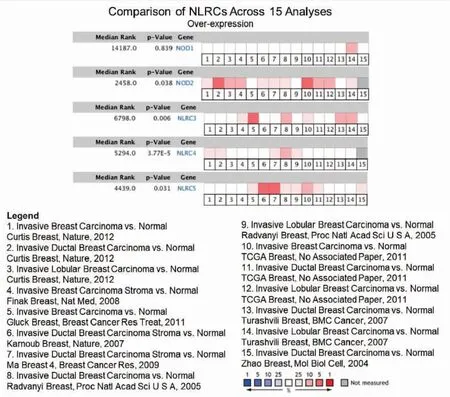
图2 NLRCs在浸润性乳腺癌中mRNA的转录水平
2.4 NLRCs基因表达与浸润性乳腺癌患者生存预后的关系
对1 099例TCGA数据集中浸润性乳腺癌RNA-seq数据进行分析,如图3所示,高NLRC3表达与浸润性乳腺癌较好的预后相关(Log-rankP=0.028),即NLRC3高表达延长浸润性乳腺癌患者的OS,而乳腺癌组织NLRC1/2/4/5的表达与患者预后无关(Log-rankP>0.05)。提示NLRC3的表达与浸润性乳腺癌的发生发展有关。
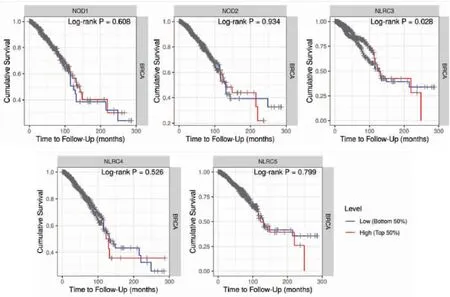
图3 NLRCs表达水平与浸润性乳腺癌患者OS的关系
2.5 NLRC3 mRNA水平与浸润性乳腺癌患者临床病理参数的关系
对1 143例TCGA数据集中浸润性乳腺癌RNA-seq数据并结合临床病理参数进行分析,如表2所示,浸润性乳腺癌组织中NLRC3表达与T分期(P=0.011)和肿瘤分级(P=0.040)显著性相关,与性别(P=0.081)、年龄(P=0.443)、淋巴结受累程度和范围(P=0.393)以及远处转移(P=0.052)无关。同时我们还观察到,NLRC3高表达组浸润性乳腺癌患者的临床病理特征明显优于低表达组的患者,因此NLRC3与浸润性乳腺癌的恶性程度密切相关。
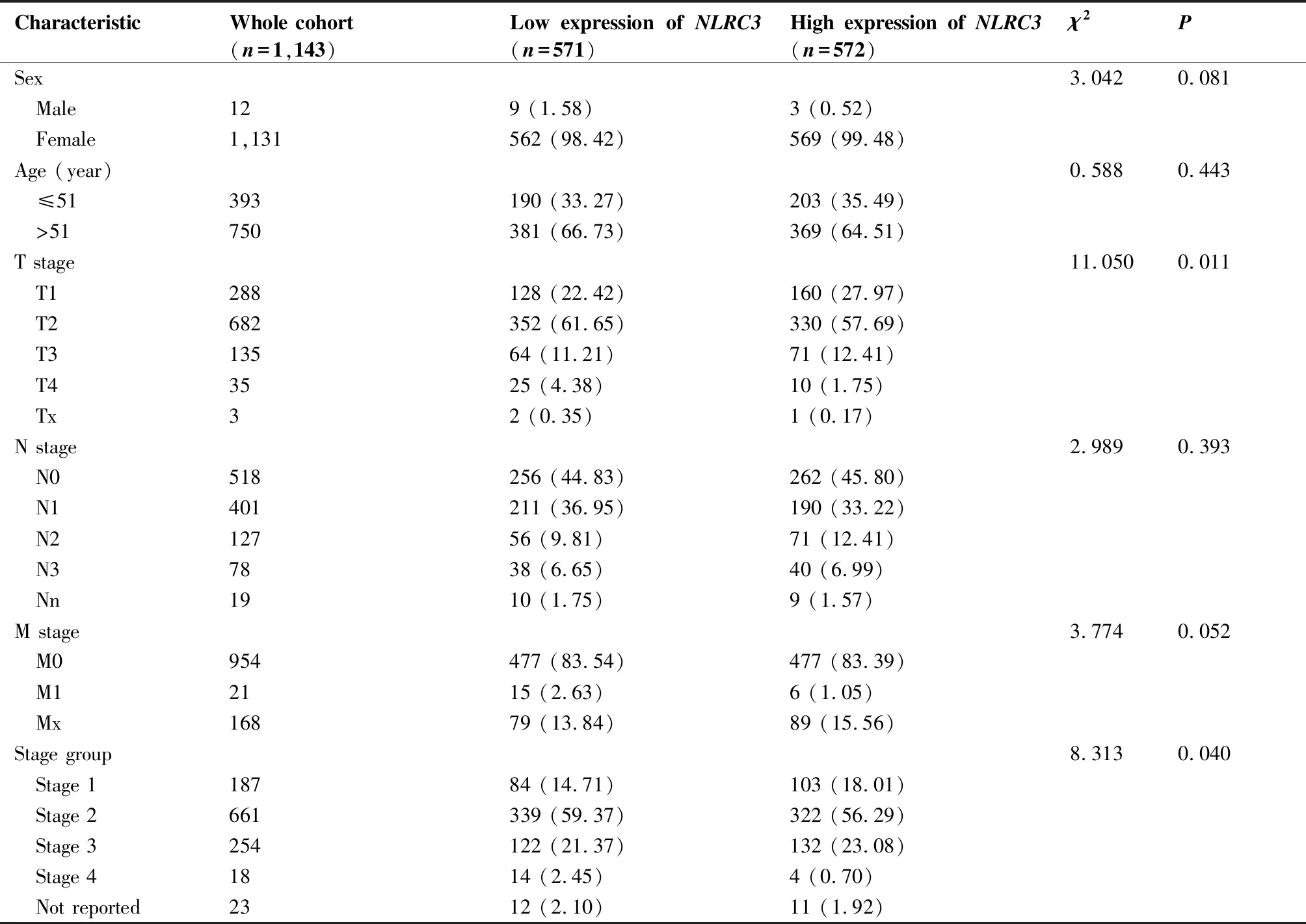
表2 NLRC3与浸润性乳腺癌患者临床病理参数的关系
2.6 不同分子亚型中乳腺癌NLRC3 mRNA表达的预后价值
基因组分析可将乳腺癌分为4个分子亚型,luminal A型、luminal B型、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达型和基底细胞样(basal-like)型。通过Kaplan-Meier Plotter数据库获取了3 951例乳腺癌患者的生存数据,分析NLRC3基因在乳腺癌不同分子亚型中的表达对患者RFS和OS的影响(图4),分析发现NLRC3高转录组与低转录组相比,4种分子亚型患者RFS和basal-like型患者OS均显著延长(P<0.05)。
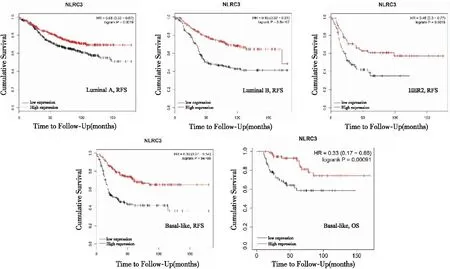
图4 NLRC3基因表达与不同分子亚型乳腺癌患者RFS或OS的关系
3 讨 论
NLRCs是一类感应病毒入侵和机体自身细胞损伤(或应激)的先天免疫“传感器”[13]。 近年来,NLRCs在影响癌症生物学过程中的作用正受到关注。例如,NLRC1和NLRC2可直接调节NF-κB和MAPK促炎途径,影响肿瘤细胞的增殖、凋亡、迁移和血管生成[14];NLRC3通过抑制PI3K-mTOR信号通路的激活阻断结肠肿瘤的生成[15];NLRC4对癌症的进展具有双重调控作用[16];NLRC5与直肠癌、宫颈癌、膀胱癌、黑色素瘤和头颈癌的患者生存预后高度相关[17]。然而,NLRCs对乳腺癌的进一步生物信息学分析尚未完成。
鉴于此,本研究分析已收录在Oncomine中人乳腺癌组织NLRCs基因的转录水平,发现在乳腺癌中有13项研究数据显示NLRCs基因转录水平明显上调,2项显著下调,提示NLRCs的表达可能与乳腺癌的发生发展有关。然而,乳腺癌的组织学分型很多,不同分型存在病理特征上的差异,为此本研究主要探讨5个NLRC分子在最常见的乳腺癌类型—非特殊型浸润性乳腺癌中mRNA表达及其预后价值。研究结果显示NLRC1在浸润性乳腺癌中的表达与正常组织差异无统计学意义;NLRC2/3/4/5在浸润性乳腺癌中表达量显著高于正常组织。然而,浸润性乳腺癌患者预后仅与NLRC3的表达呈正相关,与NLRC1/2/4/5的表达无关,这表明NLRC3可能在浸润性乳腺癌中发挥抑癌作用。进一步亚组分析显示NLRC3高表达组浸润性乳腺癌患者的临床病理特征明显优于低表达组的患者。因此,NLRC3有望成为浸润性乳腺癌潜在的诊断和预测癌症患者生存预后的重要生物标志物。今后拟开展实验性研究,为NLRC3成为浸润性乳腺癌治疗靶点提供实验依据。
浸润性乳腺癌是一类异质性极强的肿瘤,通常情况下,相同组织学分型的乳腺癌可能表现为不同的分子病理特征。如果只参照癌症的组织学分型和临床病理参数则不足以预测乳腺癌病理生理学的真实行为,多数研究更侧重于分析乳腺癌的分子模式[18]。基于基因表达谱,Perou,Sorlie等将乳腺癌分为4种临床相关分子亚型:luminal A型、luminal B型、HER2过表达型和basal-like型[19]。
由于大约80%的乳腺癌在组织学上被归类为浸润性导管癌,其次是浸润性小叶癌(约占病例的10%~15%),因此NLRC3对不同分子亚型乳腺癌的预后价值,基本可以认为是NLRC3对不同分子亚型浸润性乳腺癌的预后价值。分析结果显示NLRC3对4种亚型乳腺癌患者的预后均起积极作用,其中分子型为basal-like型的NLRC3高表达组患者RFS和OS均显著延长。因此,高NLRC3表达似乎极大改善了basal-like表型乳腺癌患者的预后。
综上所述,本研究采用国际广泛认可的数据库系统性地分析了NLRC家族成员在乳腺癌中的表达和预后价值,并对不同亚型乳腺癌进行深入分析,结合本研究可以推测,NLRC3可能是浸润性乳腺癌的抑癌基因(特别是basal-like分型),有望成为有价值的患者预后评估新型生物标志物,但其具体机制仍有待进一步阐明。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

