川芎嗪联合顺铂通过调控PI3K/AKT/mTOR通路对人肺癌A549细胞侵袭能力及线粒体功能的影响*
庞皓玥,胡凯文,孙满强,周天
100029 北京,北京中医药大学 第二临床医学院(庞皓玥、孙满强);100078 北京,北京中医药大学东方医院 肿瘤科(胡凯文、周天)
肿瘤转移是癌症致死的主要原因,如何有效抗转移仍是临床肿瘤治疗难以攻克的关键问题。有研究发现,代谢模式变化在肿瘤转移中必不可少[1]。癌细胞在有氧状态下,糖酵解途径供能增强,而有氧磷酸化供能比例下降,这种代谢模式可以通过保证缺氧条件下的供能、提供大量合成原料、形成酸性微环境抑制免疫等途径[2],为癌细胞的侵袭转移创造有利条件。线粒体损伤是肿瘤代谢模式变化的基础,如线粒体内酶表达异常、膜通透性改变、ROS生成异常等,均有助于肿瘤侵袭转移[3]。因此,从能量代谢与线粒体损伤角度进行研究,对抑制肿瘤转移侵袭能力具有重要意义。
长期以来,中医活血化瘀法被广泛应用于晚期癌症患者的临床治疗中。川芎嗪(Tetramethylpyrazine,TMP)是经典活血化瘀药川芎的主要成分,具有抑制多种肿瘤细胞增殖的药理作用。顺铂(Cisplatin,DDP)是传统化疗药物,经研究证实,TMP与DDP的联合,可以增强对非小细胞肺癌的抑制作用[4-6]。本课题组前期研究表明,TMP联合DDP可以调控Twist表达,从而抑制细胞增殖[7],而PI3K/AKT/mTOR通路为Twist上游,是细胞能量代谢的关键调控因子。因此,本研究从能量代谢角度,探讨TMP联合DDP的抗肿瘤增殖与转移机制。
1 材料与方法
1.1 细胞株及试剂
人肺腺癌A549细胞株购于上海盖宁生物科技有限公司。TMP标准品购自上海源叶生物科技有限公司(货号:B20203);DDP标准品购自上海源叶生物科技有限公司(货号:B24462);JC-1试剂盒购于江苏凯基生物技术有限公司(货号:KGA602)。一抗:GAPDH monoclonal antibody、mTOR polyclonal Rabbit antibody、Phospho-mTOR(Ser2448) Rabbit Antibody、PI3K p85 Monoclonal antibody、AKT Monoclonal antibody购于Proteintech公司(货号:60004-1-Ig、20657-1-AP、AF3308、60225-1-Ig、60203-2-Ig);二抗:Goat Anti-Rabbit IgG H+L、Goat Anti-Mouse IgG H+L购于中杉金桥公司(货号:ZB-2301、ZB-2305)
1.2 细胞培养及分组
人肺腺癌A549细胞采用含10%胎牛血清、1%双抗的DMEM(高糖)培养基于37℃、5%CO2培养箱中培养,每日观察其生长情况,取对数生长期细胞用于实验。将细胞分为空白对照组、DDP组、DDP联合高、中、低剂量TMP组(DDP+TMP)。根据CCK-8实验结果确定TMP高、中、低剂量药物浓度,DDP药物浓度通过查找相关文献确定为2 μg/mL[8],药物处理时间24 h。
1.3 CCK-8法测定TMP对人肺腺癌A549细胞增殖的影响
以人肺腺癌A549细胞为测试细胞株,选用对数生长期的贴壁肿瘤细胞,用胰酶消化后,以含10%胎牛血清的完全培养基重悬细胞,调整细胞密度至5×104个/mL,将上述细胞悬液加入96孔板,每孔100 μL,37℃、5%CO2培养12 h后细胞贴壁。各实验组孔分别加入16 mM、8 mM、4 mM、2 mM、1 mM、0.5 mM梯度浓度的TMP标准品,对照组不加入药物,每组设置6个复孔,37℃、5%CO2培养24 h后进行增殖能力检测。检测时每孔加入CCK-8溶液10 μL,继续置于细胞培养箱中1 h。采用酶标仪在450 nm波长处测定各孔OD值,计算各组抑制率。细胞增殖抑制率=[(对照组平均OD值-实验组平均OD值)/(对照组平均OD值-空白组平均OD值)]×100%。根据实验结果确定DDP+TMP高、中、低剂量组TMP的药物浓度。
1.4 TMP联合DDP对肺癌A549细胞形态的影响
取对数生长期的肺癌A549细胞,以5×105个/mL细胞/孔的密度接种于6孔板中,待细胞贴壁生长融合至75%以上时,按照分组加入DDP及不同浓度TMP处理细胞。将干预后的细胞置于37℃、5%CO2培养箱培养24 h后,倒置显微镜下(放大倍数为200倍)观察细胞形态的变化并拍照。
1.5 Transwell小室实验测定肿瘤细胞侵袭能力
在Transwell小室上室面加入100 μL用DMEM培养基稀释的Matrigel(体积稀释比例为1∶8),下室面用移液枪头涂抹Fibronectin(浓度0.5 mg/mL),置于37℃培养箱中包被2 h,使Matrigel凝固成胶,4℃过夜风干。取对数生长期的A549细胞,加入DDP及TMP处理细胞,用药干预24 h。接种细胞前拿出小室,吸出小室中残余液体,每小室加入100 μL DMEM,37℃孵育30 min,水化基底膜。收集各组细胞,重悬于不含胎牛血清的DMEM培养液中,调整细胞浓度为5×104个/mL细胞。将各组细胞接种于Transwell小室的上室中,接种体积为200 μL(1×104个细胞),下室中加入600 μL含10%胎牛血清的DMEM培养液。37℃、5% CO2培养24 h后取出小室,PBS洗2次,加入4%多聚甲醛,室温固定15 min,PBS洗2次,用棉签擦拭小室上室面未穿过小室膜的细胞,用结晶紫染色15 min后,在倒置显微镜(放大倍数为200倍)下观察穿膜细胞数。实验独立重复2次。
1.6 透射电镜观察线粒体超微结构
取各组细胞消化,离心,制备成1×106个/mL细胞,弃上清,留下层细胞,加入3%戊二醛固定液固定2 h, 1%锇酸固定1 h,逐级乙醇、丙酮脱水后, 环氧树脂包埋, 超薄切片,经铀、铅双重染色后,1200EX透射电镜观测各组细胞线粒体超微结构变化。
1.7 JC-1线粒体膜电位检测试剂盒检测线粒体膜电位
收集DDP及TMP干预后各组细胞量为1×106个/管, 用 PBS 洗涤细胞2次(离心2 000 r/min,5 min),取100 μL 10× Incubation Buffer加900 μL灭菌去离子水稀释成1×Incubation Buffer,混匀并预热至37℃,吸取500 μL加入1 μL JC-10,涡旋混匀配成JC-10工作液,取500 μL JC-10工作液将细胞均匀悬浮,37℃,5%CO2的培养箱中孵育15~20 min;室温离心(2 000 r/min,5min)收集细胞,用1×Incubation Buffer洗两次;吸取500 μL 1×Incubation Buffer重新悬浮细胞;用流式细胞仪检测(Ex=488 nm;Em=530 nm)线粒体膜电位,设未经处理的正常细胞为阴性对照组和阳性对照组,根椐阴性和阳性对照组的双参数散点图来设定门的位置。实验独立重复2次。
1.8 Western blot 检测 PI3K、AKT、mTOR、p-mTOR的表达
取培养至对数生长期的A549细胞,调整细胞密度为5×105个/mL细胞接种于6孔板中,待细胞贴壁生长融合至75%以上时,加入DDP及相应浓度的TMP干预细胞,置于37℃、5%CO2培养箱培养24 h。各组细胞加入细胞裂解液(RIPA∶PMSF=100∶1),用细胞刮刀刮下,收集至离心管,冰上裂解25 min后,12 000 r/min,4℃,离心10 min,取上清液为蛋白样品,采用BCA蛋白浓度测定试剂盒检测蛋白浓度,将蛋白样品加入5×蛋白上样缓冲液,置于100℃水浴中变性5 min。SDS-PAGE分离蛋白,根据目的蛋白的相对分子量配制相应的分离胶浓度(10%)。加样后分别进行蛋白电泳、蛋白电转移至PVE膜,5%脱脂奶粉常温封闭1.5 h。将封闭后的膜按照目标蛋白所处位置进行剪切,分别加入对应的一抗PI3K(1∶1 000)、AKT(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000),4℃反应过夜。TBST洗膜3次,5min/次;根据一抗的种属选择相应的二抗(Goat Anti-Rabbit IgG、Goat Anti-Mouse IgG,稀释比例为1∶10 000)37℃孵育2 h。最后ECL发光、显影、拍照。相对蛋白含量用各蛋白条带灰度值/内参蛋白条带的灰度值来表示。实验独立重复2次。
1.9 统计学方法
运用软件SPSS 17.0 进行分析统计,计量资料采用均数±标准差表示。多组均数比较采用单因素分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 TMP对人肺癌A549细胞增殖的影响,确定给药浓度
CCK-8结果显示,运用梯度浓度TMP干预肺癌A549细胞后,细胞增殖抑制率呈剂量依赖性,随着TMP浓度升高,其增殖抑制率也增高。与对照组相比,TMP对A549肺癌细胞的抑制差异具有统计学意义(P<0.001)。取TMP干预肺癌A549细胞的近半数抑制浓度,确认TMP高、中、低给药剂量分别为2 mM、1 mM、0.5 mM(表1)。

表1 CCK-8测定TMP对肺癌A549细胞增殖的抑制作用(N=6)
2.2 TMP+DDP对A549肺癌细胞形态的影响
各组细胞生长状况良好,细胞呈细长梭形,细胞间排列紧密形成集落。实验组细胞随药物浓度的增高数量减少,形态改变;其中DDP+TMP(2 mM)组、DDP+TMP(1 mM)组、DDP+TMP(0.5 mM)组细胞由具有较高侵袭能力的细长梭形变为侵袭能力较弱的圆形,细胞体积缩小,部分可见细胞核固缩,胞浆内可见颗粒和碎片,细胞生长明显受到抑制(图1)。

图1 不同浓度TMP+DDP对于A549细胞形态的影响(×200)
2.3 TMP+DDP对A549细胞侵袭能力的影响
Transwell小室法检测结果显示,与对照组相比,各实验组细胞均可使穿过铺有人工基质 Matrigel 滤膜的细胞数量明显降低,DDP+TMP(2mM)组细胞穿膜数量最低。随着 TMP 浓度的增高,细胞侵袭数逐渐减少,侵袭抑制作用逐渐增强,且穿膜面细胞形态趋于圆形(图2)。
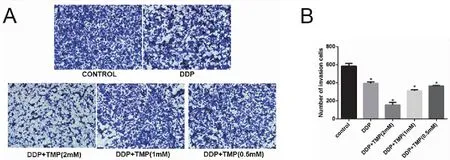
图2 不同浓度TMP+DDP对于A549细胞侵袭能力的影响(×200)
2.4 TMP+DDP对A549细胞线粒体结构的影响
运用透射电镜观察各组癌细胞线粒体结构可见,与对照组相比,应用 DDP 使细胞内出现大量空泡坏死,线粒体多呈圆形,双层膜结构模糊,线粒体嵴数量较少,排列紊乱,肌节断裂;联合应用TMP后,细胞内线粒体形状趋于椭圆形,且随TMP剂量增高,线粒体形态更加饱满,线粒体嵴数量较多,排列较清晰(图3)。
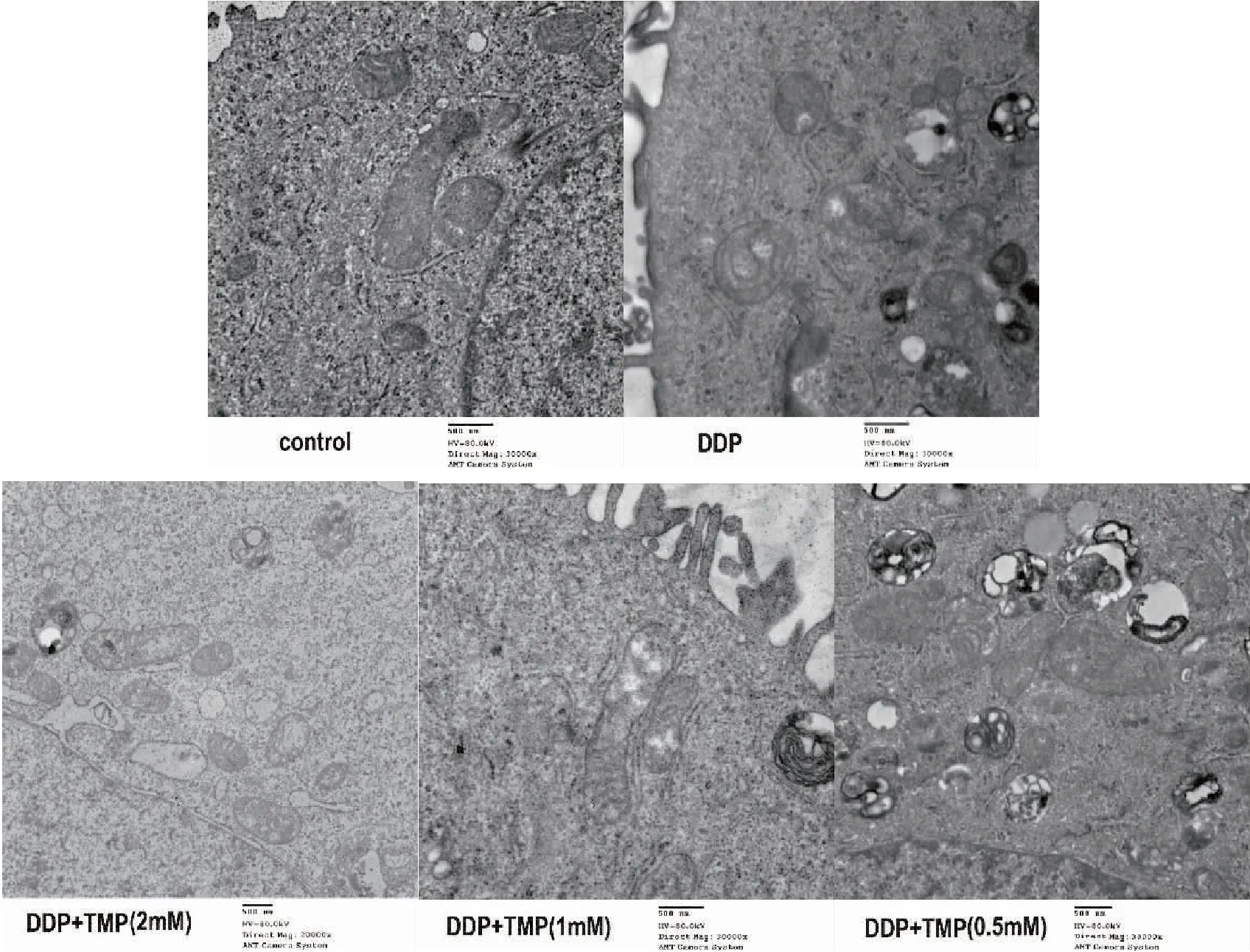
图3 电镜观察不同浓度TMP+DDP干预A549细胞线粒体结构(×30 000)
2.5 TMP+DDP对A549细胞线粒体膜电位的影响
JC-1法检测线粒体膜电位显示,与对照组相比,各组线粒体膜电位均显著降低(P<0.05),但DDP+TMP组线粒体膜电位较DDP组升高,且随TMP浓度升高,线粒体膜电位有升高的趋势,DDP+TMP(2mM)组较DDP组线粒体膜电位升高差异有统计学意义,P<0.05(图4)。
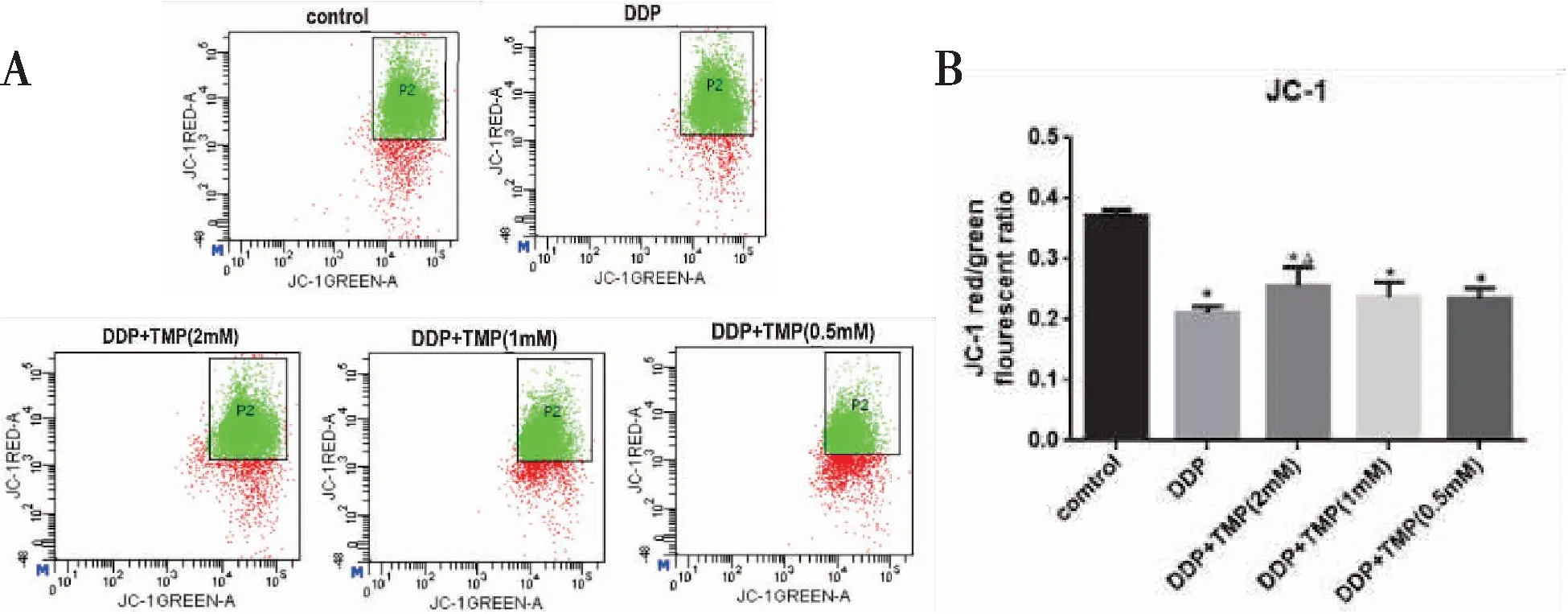
图4 不同浓度TMP+DDP干预A549细胞线粒体膜电位变化(JC-1)
2.6 TMP+DDP对A549细胞 PI3K、AKT、mTOR、p-mTOR蛋白表达的影响
Western blot检测PI3K/AKT/mTOR通路蛋白,结果显示(图5),与对照组相比,DDP组及DDP+TMP组均可下调PI3K、AKT、mTOR、p-mTOR蛋白表达(P<0.05)。DDP+TMP组在降低各蛋白表达方面优于单独应用DDP组,且随TMP浓度升高,各蛋白表达量呈现降低的趋势。与DDP组相比,DDP+TMP(2mM)组可明显下调PI3K、mTOR和p-mTOR蛋白表达(P<0.05),DDP+TMP(1mM)组可下调mTOR、p-mTOR蛋白表达(P<0.05)。
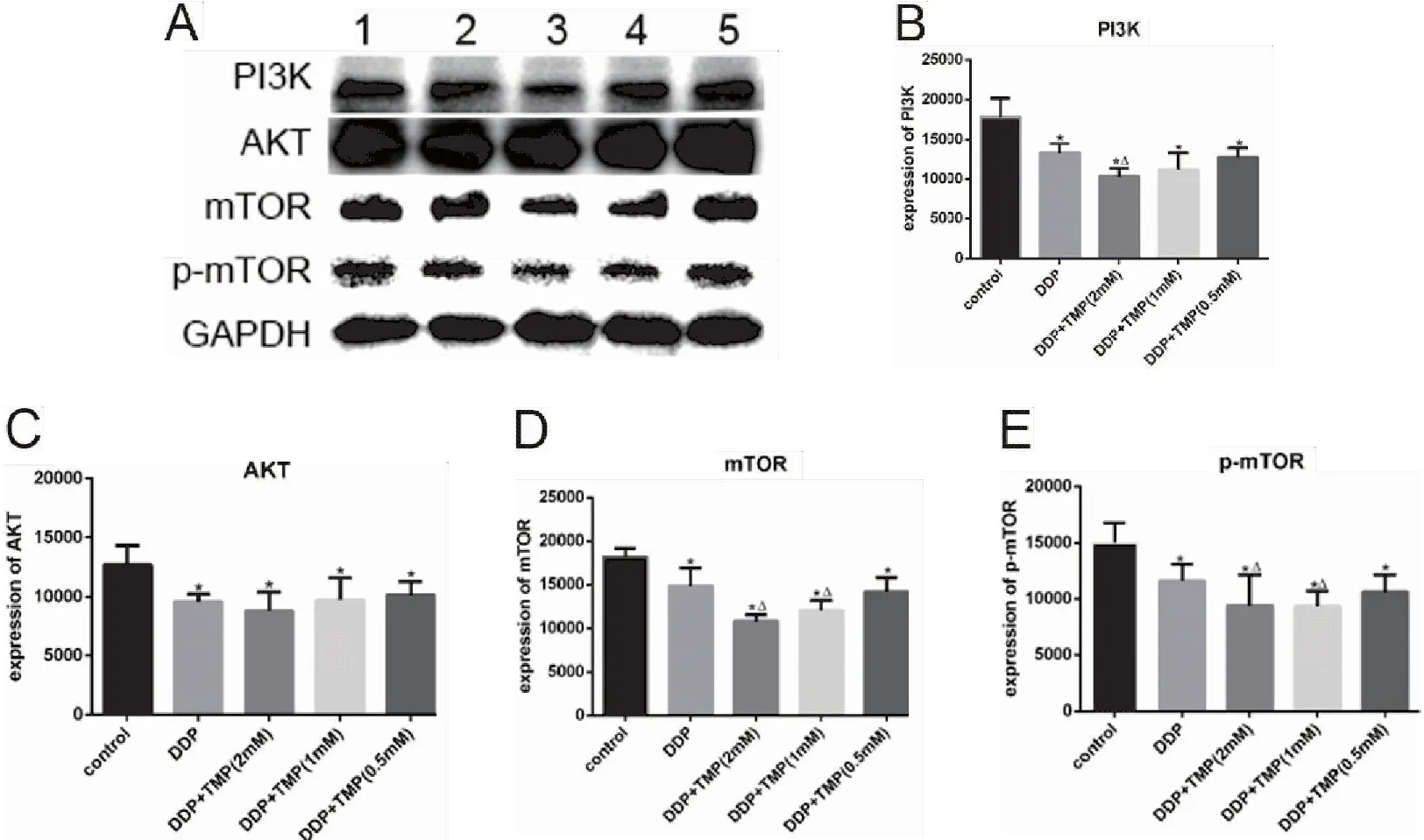
图5 DDP+TMP对A549细胞内PI3K/AKT/mTOR信号通路表达的影响
3 讨 论
近年来,有关癌细胞能量代谢特征的研究受到越来越多重视,能量代谢重构被认为参与了癌症的增殖、侵袭与转移过程。早在1920s,科学家发现肿瘤细胞能量代谢的糖酵解途径异常活跃,并认为其与线粒体损伤有关[9]。肿瘤细胞极活跃的代谢活动,造成周围环境的乏氧状态,而癌细胞线粒体功能受损,促进了糖酵解途径供能,保证了肿瘤生长及转移的能量需求[10]。线粒体功能受损还与肿瘤细胞抵抗凋亡、逃避免疫监督等有助于肿瘤转移的特性密切相关[11]。这使靶向线粒体的治疗手段成为近年来肿瘤治疗领域的热点。
中医对癌症常伴有血瘀状态的认知,与肿瘤周围低氧、酸性微环境的形成十分相似。研究表明,活血化瘀中药可以通过抑制血管生成,改善乏氧微环境等机制,发挥抗肿瘤作用[12]。而癌细胞有氧糖酵解的能量代谢异常,增强了其对周围环境的适应性。因此,我们推测中医活血化瘀药改善乏氧微环境状态,从根本上改变了线粒体损伤的环境压力,从而使线粒体有氧代谢的功能恢复,抑制糖酵解的发生,最终控制肿瘤生长转移。研究显示,活血化瘀中药改善缺氧环境作用与PI3K/AKT/mTOR信号通路密切相关[13]。其中,AKT磷酸化后可降低线粒体ATP的消耗,使组织维持较低的线粒体膜电位,进而减少钙离子进入线粒体和再灌注初期活性氧的生成[14]。因此,PI3K/AKT/mTOR通路很可能是活血化瘀中药调节线粒体功能发挥抗肿瘤作用的关键机制。目前该研究思路还鲜有报道,值得深入挖掘。
TMP是传统中医活血药川芎、当归的主要成分,可以通过改善血液高凝状态、抗肿瘤血管生成,改善乏氧微环境等方面抑制肿瘤细胞的增殖及转移[15]。DDP是治疗非小细胞肺癌常用的化疗药物,其通过阻碍肿瘤细胞DNA复制,从而抑制细胞的有丝分裂,虽然抗肿瘤效果明显但毒性较强。TMP与DDP联合使用,不仅能增强抗肿瘤效果,还能降低化疗药物引起的毒副作用,多项研究支持TMP联合DDP在肺癌治疗领域良好的应用前景[16-17]。本研究拟从改善肿瘤代谢角度,阐述DDP联合TMP抑制肺癌细胞过程中TMP发挥的作用。
本研究首先通过CCK-8法确定TMP的用药浓度,再观察TMP联合DDP对肿瘤细胞生长侵袭能力的影响。经TMP及DDP干预24 h后,显微镜下观察肺癌A549细胞体积缩小,变为圆形,部分细胞内可见颗粒和碎片,细胞增殖速度减慢,与对照组形成较大差异。Transwell小室侵袭实验显示,各实验组细胞穿膜数量均少于对照组(P<0.05),且TMP联合DDP对细胞穿膜的抑制明显增强。以上结果说明TMP联合DDP可以抑制A549细胞的生长及侵袭,且随TMP剂量升高效用更加明显。因此可以推测,TMP联合DDP增强了对A549细胞增殖及侵袭能力的抑制作用,较单独应用DDP效果更佳,且表现出剂量依赖性。
线粒体功能正常有赖于其结构的完整,已有的研究显示,肿瘤细胞的线粒体普遍存在DNA突变,拷贝数变化、线粒体膜稳定性以及线粒体结构动态改变等结构异常,而线粒体功能随之发生紊乱,并与实体肿瘤的发生发展密切相关[18]。如线粒体膜电位发生改变,增加抗凋亡蛋白的表达,延长肿瘤细胞寿命,减少转移侵袭过程中的损耗[19]。本研究通过透射电镜观察各组细胞线粒体结构发现,单独使用DDP后细胞主要发生空泡坏死,线粒体受损,表现为嵴数量较少且排列紊乱;联合应用TMP后,线粒体形态更为饱满,且形状趋于椭圆形,可见排列清晰的嵴。这提示TMP可以降低线粒体损伤程度,使其发挥正常功能。同时,本研究还对线粒体膜电位进行了检测,结果发现,与对照组相比,DDP及DDP+TMP组线粒体膜电位均显著下降(P<0.05),但联合应用TMP使线粒体膜电位较单独应用DDP有所升高,且随TMP浓度升高,线粒体膜电位有升高的趋势,其中,高剂量组线粒体膜电位升高较为明显(P<0.05)。因此,我们推测TMP可以促进线粒体的正常功能,从而影响肿瘤细胞代谢。
PI3K/AKT通路是调控细胞能量代谢的经典通路,研究表明,其可以通过调节缺氧诱导因子HIF-1α表达,从而调控癌细胞的能量代谢模式,增加癌细胞对周围乏氧环境的适应性[20]。mTOR是PI3K/AKT下游的关键激酶, PI3K/AKT/mTOR通路可以上调癌细胞糖酵解相关酶的活性,加强糖酵解过程[21]。另有一项三阴性乳腺癌细胞的研究显示,AKT的激活可以调节癌细胞的线粒体代谢和氧化磷酸化[22]。本研究利用Western blot检测肺癌A549细胞PI3K/AKT/mTOR信号通路的蛋白表达发现,TMP联合DDP可使肺癌A549细胞内PI3K、AKT及mTOR蛋白表达均显著降低(P<0.05),TMP联合DDP组对PI3K/AKT/mTOR通路的抑制作用要优于单独应用DDP组,且呈浓度依赖性。同时,mTOR磷酸化修饰(p-mTOR)减少,即mTOR蛋白活性也受到了影响。这提示TMP联合DDP增强了对PI3K/AKT/mTOR信号通路的抑制作用,与肺癌A549细胞的线粒体功能及能量代谢改变相关。
综上所述,TMP联合DDP能抑制肿瘤细胞增殖及侵袭能力,其机制可能通过调节PI3K/AKT/mTOR通路,改善线粒体功能,进而使癌细胞能量代谢模式发生改变,发挥联合抗肿瘤作用。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

