铁硫化物对高砷地下水中As(Ⅲ)的去除效果研究
易曼玲,李义连,华 骏,陆立波
(1.中国地质大学(武汉)环境学院,湖北 武汉 430078;2.武汉济美置地有限公司,湖北 武汉 430014;3.武汉中央商务区投资控股集团有限公司,湖北 武汉 430023)
高砷地下水具有极高的毒性,人类长期饮用高砷地下水可造成砷中毒。砷中毒可使人体神经系统紊乱,人体皮肤以及内脏发生癌变。因其高毒性,我国生活饮用水卫生标准与世界卫生组织均规定饮用水中砷的浓度不能超过10 μg/L。
砷(As)可能会因自然条件变化(如氧化还原条件变化)而从含砷的地下介质中释放,如大同盆地山阴地区的原生劣质高砷地下水。山阴地区地方性砷中毒均为饮水型。20世纪80年代中期以前,该地区居民的饮用水为埋深小于10 m的低砷地下水。之后因黄河断流,当地居民开始饮用埋深为20~50 m的浅层地下水(砷浓度高于50 μg/L),并逐渐开始出现人体皮肤黑色素异常、增厚、角质化过度,四肢无力,癌症高发等现象。长期饮用高砷地下水使得山阴县地方性砷中毒情况尤其严重,患病人口多达总人数的一半以上。因此,探究针对当地高砷地下水且适用于广大农村地区的修复技术已迫在眉睫。

与铁氧化物相比,铁硫化物如FeS、FeS也具有良好的固砷性能,且能在强还原环境的地下水中大量存在,故不需要将As(Ⅲ)氧化为As(Ⅴ)即可去除地下水中的砷。此外,这种方法的除砷产物毒砂及砷硫化物(雌黄、雄黄)均能在还原环境中稳定存在,不会发生还原溶解。当前,铁硫化物用于处理含铜、锌、镉、汞等废水的研究较多,而处理含砷废水的研究还较为少见。其中,大多研究关注的是自然条件下铁硫化物矿物的除砷机理,研究显示其对砷的吸附是单分子层的吸附,受温度和pH值的影响较小,而鲜有研究关注铁硫化物在强还原条件下直接去除As(Ⅲ)的机制,且由于高砷地下水种类复杂,研究铁硫化物除砷的效果与机制,必须要与实际砷污染区域的地下水数据结合。因此,本文选择我国高砷地下水的重点关注区域——山西大同盆地山阴地区为研究区,基于该地区高砷地下水中As(Ⅲ)含量超过《生活饮用水卫生标准》(GB 5749—2006)导致地下水污染这一现实问题,以及地下水中As(Ⅲ) 常以电中性的HAsO形态存在且难以被地下介质吸附这一特性,在查明山阴地区高砷地下水污染状况与性质的基础上,将室内批试验与PHREEQC软件数值模拟相结合,探究了铁硫化物去除高砷地下水中As(Ⅲ)的可行性和最佳条件,以期为高砷地下水的原位修复技术提供一定的理论依据与工艺思路。
1 材料与方法
1. 1 地下水样品采集
前人研究表明,大同盆地高砷地下水呈条带状分布在桑干河和黄水河两侧,浅层半承压含水层作为当地主要的饮用水源,是研究区砷含量最高的含水单元。为了查明研究区浅层半承压含水层中砷的空间分布情况,在前人工作的基础上,本次调查在桑干河的上游神头镇一带和恒山北麓洪积扇前沿地区——马营凹陷的边界处,以及黄水河的右岸进行了取样调查,地下水样品来自村镇居民水井,各采样村镇位置如图1所示。
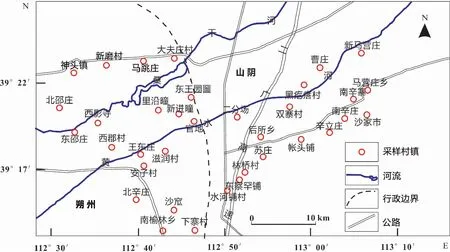
图1 研究区地下水样品采样村镇位置示意图Fig.1 Location of sampling villages and towns of groundwater samples in the study area
使用500 mL的聚乙烯瓶采集地下水样品,每个采样点采取2个平行样。采样开始前,先用去离子水清洗采样瓶,采样时再用所采水样润洗3次,采样后用0.45 μm微孔滤膜及真空泵对水样进行抽滤以去除水中的各种悬浮物,其中一个平行样加入硝酸将酸度调节至pH<2。
地下水样品的pH值采用HACH便携式水质分析仪现场测定;地下水样品中总砷的含量采用ICP-MS测定,仪器型号为PE Elan DRC II,测试方法参考《水质 65种元素的测定 电感耦合等离子体质谱法》(HJ 700—2014)。
研究区地下水样品测试结果显示:采集的35个水样中有9个水样的总砷浓度大于10 μg/L,超过我国生活饮用水卫生标准,且超标水样的总砷浓度均在17~242 μg/L之间;水样偏碱性,pH值在6.5~9.5之间,总砷浓度超标水样的pH值大多接近8(见图2)。
在实地采样时发现,该地区新鲜地下水样品中含有浓度较高的还原性气体(HS、CH),水样有比较明显的臭鸡蛋气味,部分地区的地下水因为含有浓度较高的甲烷气体可以直接点火,这一现象表明研究区地下水整体处于强还原环境。
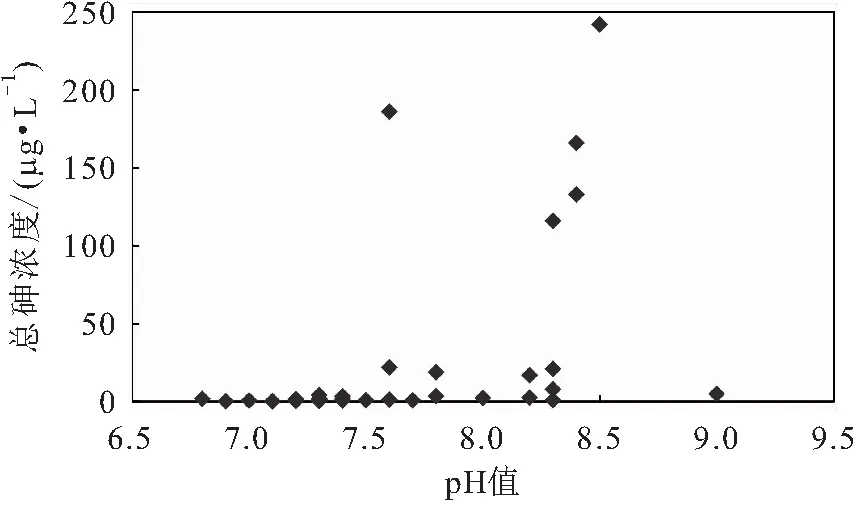
图2 研究区地下水样中总砷浓度与pH值的关系图Fig.2 Relationship between total arsenic concentration and pH in groundwater samples in the study area
1. 2 试验方法
1.2.1 试验设计
在研究区地下水强还原环境中,砷主要以难以被固定的As(Ⅲ) 的形式存在,As(Ⅲ)的平均占比为53.54%,其浓度最高可达总砷浓度的72.38%;且研究区所采集的地下水砷超标样品中总砷浓度范围为17~242 μg/L。因此,在室内试验与PHREEQC数值模拟中,均选择浓度为250 μg/L的As(Ⅲ)溶液代表研究区高砷地下水。
As(Ⅲ)与铁硫化物可能发生如下反应:
7FeS+2As(OH)→3FeS+2FeAsS+2Fe(OH)
(1)
3FeS+As(OH)→FeS+FeAsS+Fe(OH)
(2)
该反应显示铁硫化物能将As(Ⅲ)转化为含砷矿物毒砂而将砷固定下来。以该反应为基础,FeCl、NaS与As(Ⅲ)的理论最小投料比c
[FeCl∶NaS∶As(Ⅲ)]应为3∶3∶1,但实际的投料比应高于该理论值,因此在本研究中基于室内批试验与数值模拟对投料比进行了优化。先使用三氧化二砷粉末(AsO)配制浓度为250 μg/L的As(Ⅲ)溶液,取As(Ⅲ)溶液120 mL加入到150 mL注射瓶中,同时加入盐酸和氢氧化钠调节pH值,并立即密封;然后将注射瓶放置于空气恒温摇床中,设置摇床温度为25℃,转速为180 r/min,并打开氮气瓶通气5 min后维持通气状态,使溶解氧的含量维持在较低的水平,再用注射器向注射瓶中迅速推入新配制的不同浓度梯度的FeCl和NaS溶液各2 mL,不时检查实验装置,确保液面以下始终有气泡冒出;最后当反应完成后,用注射器取上清液,离心、过滤、稀释后采用电感耦合等离子体质谱法测定溶液中总砷含量。为减少试验误差,每个试验重复操作3次。
通过PHREEQC程序对各反应条件进行模拟,分析不同试验条件下矿物的饱和指数(SI
),探究室内批试验的潜在作用机制及沉淀的可能成分;同时结合室内批试验,探究铁硫化物去除As(Ⅲ)的可行性与最佳试验条件。1.2.2 分析方法
由于反应体系为强还原环境,可认为As(Ⅲ)是砷的主要存在价态,为简化测试方法,测试过程中直接测试溶液中的总砷含量。用注射器从反应溶液中吸取上清液,经离心、稀释、过滤后用ICP-MS测样。
对于不同试验条件下反应体系中的水化学组分以及各矿物的饱和指数(SI
)主要采用 PHREEQC程序进行模拟计算。2 结果与分析
2. 1 反应时间对铁硫化物除砷效果的影响
为了探究反应时间对铁硫化物除砷效果的影响,本试验选择As(Ⅲ) 溶液的初始浓度为250 μg/L,投料比c
[FeCl∶NaS∶As(Ⅲ)]为24∶24∶1,并将溶液pH值调至中性,通过改变反应时间(分别为0.5 h、1 h、2 h、4 h、6 h、8 h、10 h时),考察反应体系中总砷浓度的变化情况,其试验结果见图3。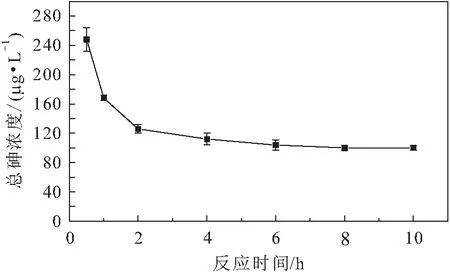
图3 溶液中总砷浓度随时间的变化Fig.3 Variation of the concentration of total arsenic in solution with time
由图3可见,在反应时间为0.5~2 h时,溶液中总砷的浓度下降较快,2 h后趋于平缓,6 h后溶液中总砷浓度基本保持不变。同时,结合试验结果可以发现,反应进行到8 h时可以认为反应体系中的各个反应已基本平衡,因此在后续试验中,反应时间均设置为8 h。
2. 2 投料比对铁硫化物除砷效果的影响
2.2.1 FeCl与NaS的投料比为1∶1的除砷效果
本试验利用PHREEQC软件模拟了地下水化学反应过程时,设置初始pH值为7,pe值为-1,As(Ⅲ)的初始浓度为250 μg/L,通过改变FeCl和NaS的浓度来模拟不同的投料比条件下矿物的饱和指数(SI
),其模拟结果见表1。由表1可知,当pH值为7时,增大投料比c
[FeCl∶NaS∶As(Ⅲ)],反应体系中除AsS和AsS以外的其他含砷矿物SI
值均小于0,在反应体系中以溶解态的形式存在,而AsS和AsS的SI
值大于0,有产生沉淀的趋势,投料比的增大使这两种矿物的SI
值增加,AsS的SI
值增加幅度整体较小,AsS的SI
值在低投料比(3~9)阶段增加较快,当投料比大于9后,AsS的SI
值虽仍有所提高,但增加并不显著;反应体系中含铁的矿物除FeS的SI
值大于0,有产生沉淀的趋势以外,其他含铁的硫化物、铁氧化物以及氢氧化物在反应体系中均以溶解态的形式存在。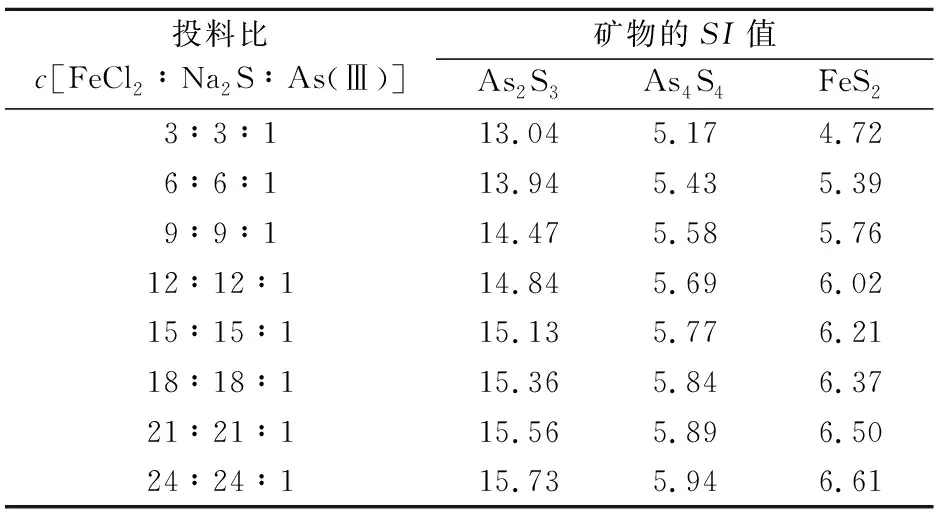
表1 FeCl2与Na2S投料比为1∶1时矿物的SI值
而相同试验条件下的室内批试验结果显示:反应8 h后,投料比c
[FeCl∶NaS∶As(Ⅲ)]小于9∶9∶1的注射瓶中沉淀产生的量较少,溶液呈无色;在投料比为12∶12∶1的注射瓶中生成了淡黄色的沉淀,并随着投料比的增大,注射瓶中沉淀的量也逐渐增多。前人研究表明,铁硫化物原位除砷产生的沉淀主要是AsS、AsS以及含砷黄铁矿的混合物,因砷硫化物的沉淀量大于铁硫化物,所以沉淀整体呈淡黄色。图4为FeCl与NaS投料比为1∶1时反应8 h后溶液中总砷的去除率。
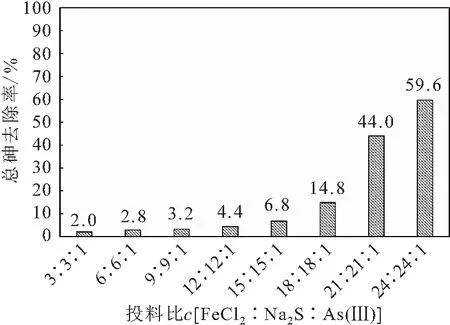
图4 FeCl2与Na2S的投料比为1∶1时反应8 h后 溶液中总砷的去除率Fig.4 Removal rate of total arsenic in solution when the feed ratio of FeCl2 and Na2S is 1∶1
由图4可见,溶液中总砷的去除率随投料比c
[FeCl∶NaS∶As(Ⅲ)]的增大而增大,且当投料比大于18∶18∶1时溶液中总砷的去除率大幅度增加,而当投料比为24∶24∶1时,溶液中总砷的去除率最大为59.6%,此时溶液中总砷的浓度为101 μg/L,仍远高于我国生活饮用水卫生标准规定的10 μg/L。这一试验结果说明,当pH值等于7,FeCl与NaS的投料比为1∶1时,铁硫化物除砷的效果不太理想,应进一步探究铁硫化物除砷的最佳投料比和pH值。2.2.2 不投加FeCl条件下NaS的除砷效果
1.3.1 比较联合组与对照组患者治疗效果。显效:患者在治疗后舒张压降低≥10mm Hg并降至正常范围,或者降低≥20mm Hg;有效:患者在治疗后舒张压降低<10mm Hg以内但血压处于正常值,或者降低10至20mm Hg;无效:患者在治疗后血压降幅未达以上标准。治疗总有效率为显效率、有效率之和。
为了分析FeCl在去除As(Ⅲ)过程中的重要性,本试验模拟了pH=7、不投加FeCl时,不同投料比c
[NaS∶As(Ⅲ)]条件下矿物的SI
值,其模拟结果见表2和图5。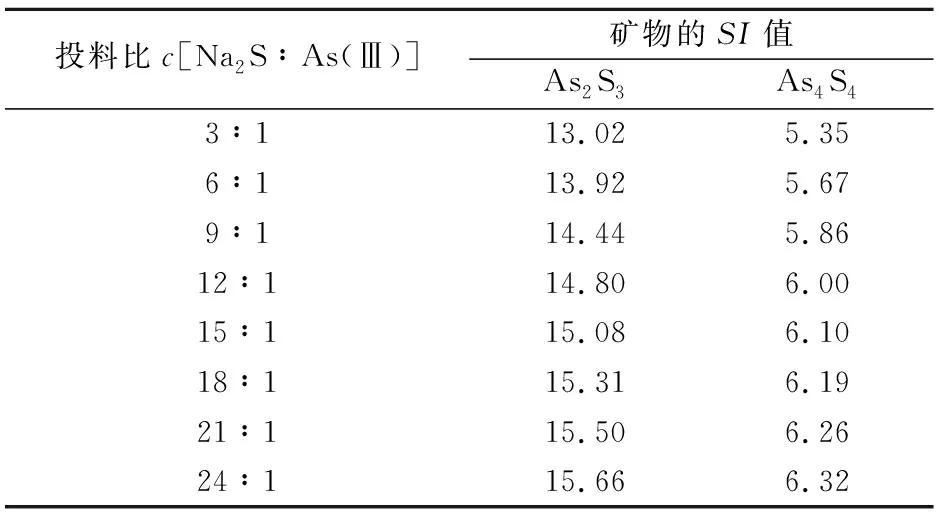
表2 不投加FeCl2条件下矿物的SI值
由表2可知,当pH值为7时,增大投料比c
[NaS∶As(Ⅲ)],反应体系中除AsS和AsS以外的其他含砷矿物SI
值均小于0,在反应体系中均以溶解态的形式存在,而AsS和AsS的SI
值大于0,有产生沉淀的趋势,投料比的增大使这两种矿物的SI
值增加,但增加的幅度较小。而相应的试验结果显示:反应8 h后,不加FeCl、只改变NaS浓度的注射瓶中始终无沉淀产生,溶液呈无色。图5为不投加FeCl条件下反应8 h后溶液中总砷的去除率。
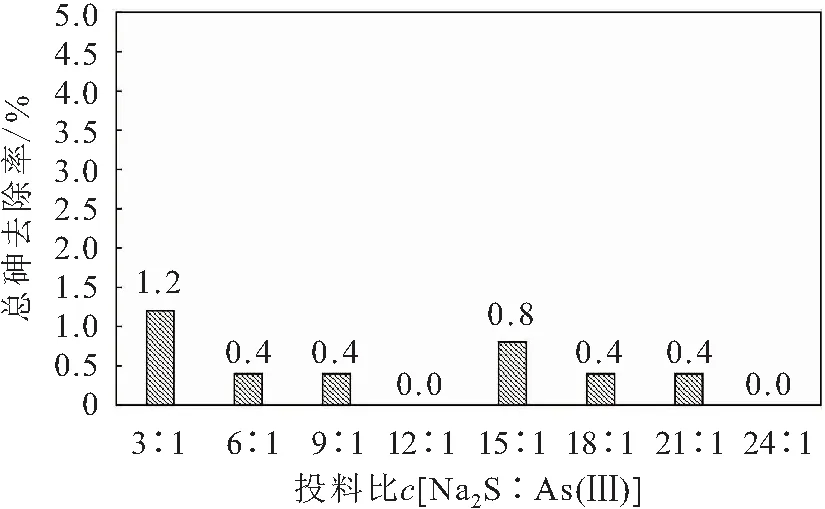
图5 不投加FeCl2条件下反应8 h后溶液中总砷的去除率Fig.5 Removal rates of total arsenic in solution without addition of FeCl2 after 8 h reaction
由图5可见,不投加FeCl条件下反应8 h后溶液中总砷的去除率均低于1.2%,说明只投加NaS的除砷效果较差。这一试验结果说明,FeCl在As(Ⅲ)的去除过程中起到了重要的作用。
结合PHREEQC软件模拟的结果和试验现象来看,PHREEQC软件模拟结果显示有产生沉淀的趋势,但实际并未产生沉淀,总体对砷的去除效果均较差,这是因为砷硫化物沉淀产生后,又快速地与过量的硫离子发生反应,生成了溶解态的含砷离子,其反应式如下:
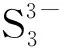
(3)
2.2.3 投加FeCl相对NaS过量时的除砷效果
为了进一步验证FeCl的重要性,本试验利用PHREEQC软件模拟pH=7、FeCl与NaS的投料比为2∶1的反应条件下矿物的SI
值,其模拟结果见表3。
表3 投加FeCl2相对Na2S过量时矿物的SI值
相应的试验现象显示:在低投料比为6∶3∶1的阶段未见沉淀,这是因为虽有产生AsS、AsS以及含砷黄铁矿的趋势,但因为其浓度过低,溶液尚未饱和,所以未产生可见的沉淀;当投料比大于6∶3∶1时,溶液中生成黑色沉淀,并随着投料比的增大,黑色沉淀的量也逐渐增多。
图6为投加FeCl相对NaS过量时反应8 h后溶液中总砷的去除率。
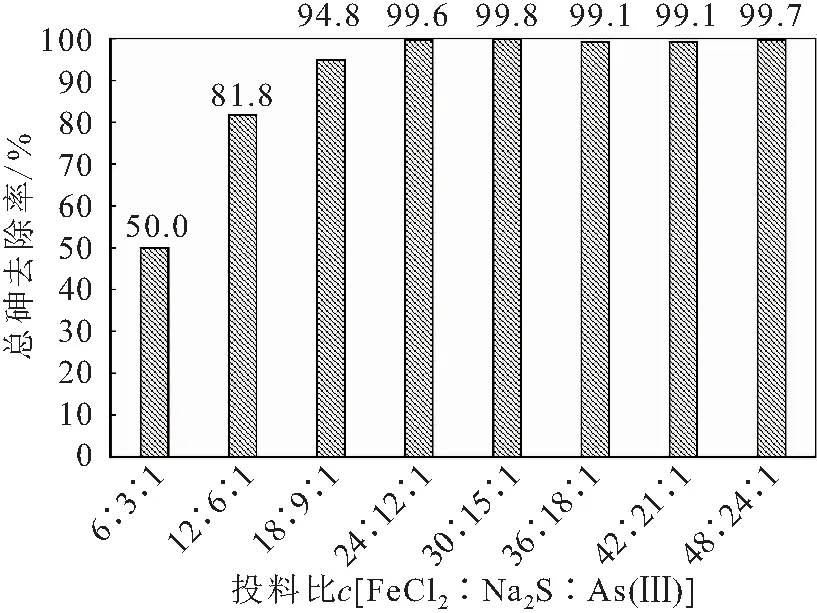
图6 投加FeCl2相对Na2S过量时反应8 h后溶液中 总砷的去除率Fig.6 Removal rates of total arsenic in solution when FeCl2 is excessive relative to Na2S after 8 h reaction
由图6可见,投加FeCl相对NaS过量时,低投料比为6∶3∶1~18∶9∶1的阶段,反应后溶液中总砷的去除率快速从50%上升到94.8%;再增大投料比,溶液中总砷的去除率增幅较小;当投料比为24∶12∶1时,溶液中总砷的去除率为99.6%,总砷的浓度为1.12 μg/L,已低于《生活饮用水卫生标准》(GB 5749—2006)中规定的10 μg/L。如果再增大投料比,溶液中总砷的浓度均在10 μg/L以下,但考虑到试剂的用量以及其除砷的效果,再增大投料比的意义不大。
结合PHREEQC软件模拟的结果和试验现象可知,产生的沉淀主要是含砷黄铁矿以及AsS、AsS的混合物,但由于投加FeCl的浓度为NaS的两倍,所以铁硫化物沉淀的量大于砷硫化物,沉淀整体呈黑色。
将投料比c
(FeCl∶NaS)从1∶1增大到2∶1,除砷效果有明显的增大,这是因为亚铁离子能与部分过量的硫离子发生反应,生成铁硫化物沉淀,从而抑制了过量硫离子对已生成的砷硫化物沉淀的溶解作用[见反应式(3)],所以溶液中总砷的去除率较高。2.3 pH值对铁硫化物除砷效果的影响
反应体系的pH值是影响溶液中组分赋存形态的关键因素,开展pH值对铁硫化物除砷效果的影响研究是十分必要的。本试验利用REEQC软件模拟投料比c
[FeCl∶NaS∶As(Ⅲ)]为24∶24∶1时,不同pH值条件下矿物的SI
值,其模拟结果见表4。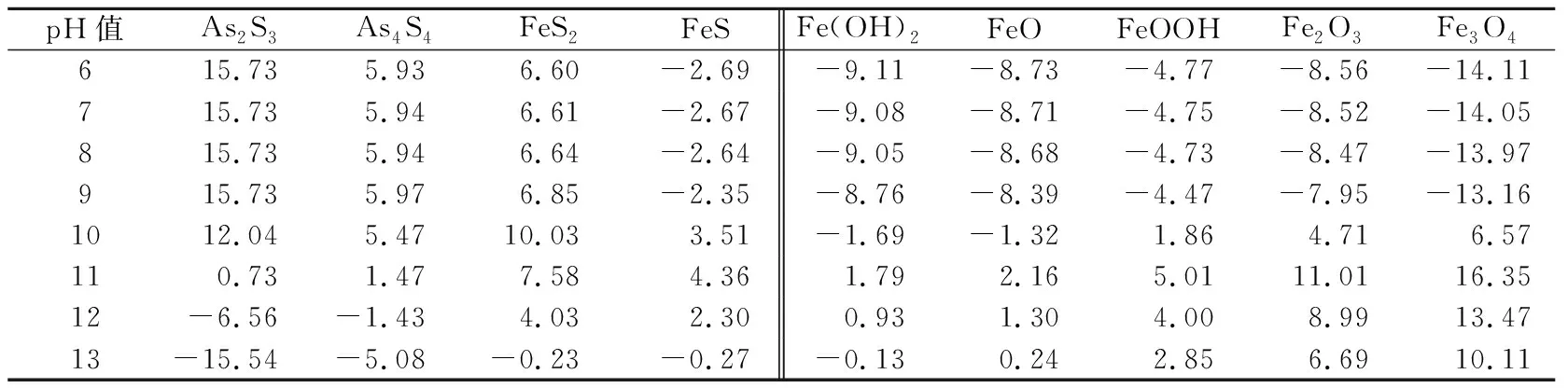
表4 不同pH值条件下矿物的SI值
由表4可以看出:
(1) 改变溶液的pH值,反应体系中除AsS和AsS以外的其他含砷矿物均以溶解态的形式存在,而AsS和AsS在pH值为6~11的范围内有产生沉淀的趋势,当pH值大于11时以溶解态的形式存在。
(2) 反应体系中FeS在整个pH值范围内均有产生沉淀的趋势,在pH=6~10时其SI
值增大,当pH=10~13时其SI
值减小至小于零;FeS在pH值为10~13的范围内有产生沉淀的趋势,在其他pH值条件下则以溶解态的形式存在。(3) 铁氧化物和氢氧化物中,FeOOH、FeO和FeO在pH值为10~13时有产生沉淀的趋势,在其他pH值条件下以溶解态的形式存在;Fe(OH)和FeO在pH值为11~12时有产生沉淀的趋势,在其他pH值条件下则以溶解态的形式存在。
相应的试验现象见图7和表5。

图7 改变pH值后溶液中的现象(沉淀沉降后)Fig.7 Phenomenon in solution after changing pH values (after sedimentation)

表5 改变pH值后溶液中的试验现象
由图7和表5可见,在pH值为7~13的范围内均有沉淀产生,且随着pH值的增大,溶液中沉淀的颜色逐渐由淡黄色过渡至黑色。
图8为改变pH值反应8 h后溶液中总砷的去除率。
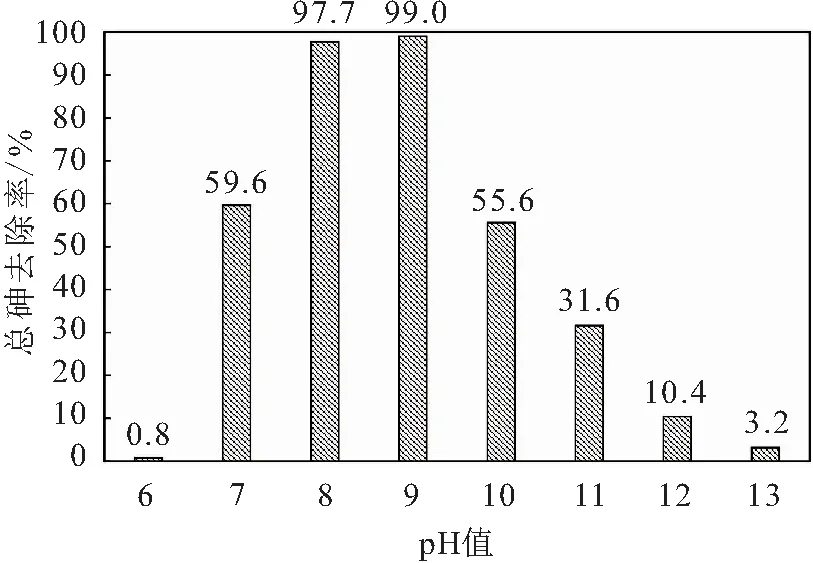
图8 改变pH值溶液中总砷的去除率Fig.8 Removal rate of total arsenic in solution after changing pH values
由图8可见,在pH值为6~9的范围内,反应溶液中总砷的去除率随pH值的增大而增大;当pH值为8时,溶液中总砷的去除率已达97.7%,而当pH值为6时,溶液中总砷的去除率仅为0.80%,说明弱酸性条件有利于S的水解,促进了反应[见反应式(3)]的发生,虽有产生砷硫化物沉淀的趋势,但过量的硫离子又与其反应生成了溶解态的含砷离子;相对而言,弱碱性(pH=8~9)条件下,S的水解受到抑制,同时也抑制了S对砷硫化物沉淀的溶解作用,使砷的去除率大幅度上升;再增大pH值到10~13,溶液中总砷的去除率反而下降。
结合PHREEQC软件数值模拟的结果和试验现象来看,当pH为7~9时产生的沉淀应为AsS、AsS以及FeS的混合物(以砷硫化物沉淀为主);当pH为10~11时产生的沉淀应为AsS、AsS、FeS、FeS以及部分铁氧化物与氢氧化物(FeO、FeO、FeOOH)的混合物;当pH为12~13时产生的沉淀应为FeS、FeS以及部分铁氧化物与氢氧化物(FeO、FeO、FeOOH)的混合物;当pH值大于9时,溶液中总砷的去除率反而下降,这是因为在强碱性环境中砷硫化物沉淀的量急剧减少,甚至不产生沉淀,逐渐形成以铁氧化物与氢氧化物、铁硫化物沉淀为主的混合沉淀,而这部分沉淀对砷的吸附作用较低。
3 结 论
针对大同盆地山阴地区地下水中砷主要以难以被固定且毒性较强的As(Ⅲ)形式存在的特点,将PHREEQC程序数值模拟与室内批试验相结合,探究了地下水中铁硫化物除砷的效果,深入分析了投料比和pH值对反应过程产生影响的内在机制,并考察铁硫化物除砷的最优试验条件,得出以下结论:
(1) 研究区地下水中砷含量超标的地下水样pH值为7.6~8.5,其总砷浓度均在17~242 μg/L之间。
(2) FeCl与NaS的投料比对地下水中总砷去除率的影响较大,而增大FeCl与NaS的投料比,能有效增大铁硫化物除砷的效果。最佳的投料比c
[FeCl∶NaS∶A(Ⅲ)]为24∶12∶1时,地下水中总砷的去除率可达99.6%,能使地下水中总砷浓度降低到《生活饮用水卫生标准》(GB 5749—2006)中规定的浓度以下。(3) 与弱酸性条件相比,弱碱性环境能抑制S的水解和其对砷硫化物沉淀的溶解作用,有利于铁硫化物除砷;但强碱性(pH>9)环境会导致砷硫化物沉淀的比例下降,使砷的去除率降低。
(4) PHREEQC软件数值模拟和试验现象显示:pH值和投料比的改变会影响含砷沉淀的种类和比例,从而影响铁硫化物除砷的效果。因此,在实际应用过程中,需要根据地下水的水化学特征,通过合理的调控来实现对As(Ⅲ)的高效去除。

