二氧化锰改性沸石对废水中Pb2+的吸附性能及其影响因素研究
余守宽,潘欢迎,梁莉莉
(中国地质大学(武汉)环境学院,湖北 武汉 430078)
随着我国人口的增长和工农业的飞速发展,环境污染问题日益严重。其中废水中重金属污染问题由于危害大、残留时间长、来源广、难去除等特点备受关注。铅(Pb)是一种对人体危害极大的有毒重金属,其化合物进入人体后少部分会随着身体代谢排出体外,其余大部分则会在体内累积,将对人体神经、血液、消化、泌尿、心血管和内分泌等多个系统造成危害。因此,去除废水中的铅、减少铅在环境中的累积就成为亟待解决的问题。目前处理含铅废水常用的方法有化学法(化学沉淀法、氧化还原法等)、吸附法和生物法。其中,化学法通常伴随二次污染,因此该方法常在废水预处理步骤使用;生物法由于废水中重金属浓度较高时易导致生物中毒,且对金属离子的去除具有选择性,因此该方法的使用具有一定的局限性;吸附法由于操作方便且重金属易于被回收,因此该方法较适合处理含高浓度重金属的废水。
沸石是一种常见的吸附剂,但天然沸石的孔径小、孔道易堵塞、连通性比较差,处理废水的能力低,因此需要将沸石进行改性后再用来吸附废水中的重金属。但是,如何通过改性来提高沸石对废水中重金属的吸附性能,也成为近年来学者们比较关注的问题。对此,国内外学者在沸石处理废水领域开展了大量的研究工作,如酸处理改性、碱处理改性、无机盐处理改性、有机物处理改性、负载改性等。虽然不同的改性方法制得的改性沸石对水体中污染物的去除效果不同,但总体而言,改性后的沸石都具有改性剂的特性,其离子交换性能和吸附性能均得到了改善。已有研究发现,锰氧化物的比表面积大、吸附位点多,但由于其较小的粒径和较细的分散状态,使得重金属被吸附后难以分离,造成溶液损失多,且处理过的溶液易浸出金属或金属氧化物,可能对环境会造成二次污染,因此纯锰氧化物基本不被用于废水处理。为了克服这些缺点,可以将锰氧化物固定在一些吸附剂表面,从而去除废水中各种重金属。本文主要对二氧化锰改性沸石对废水中Pb吸附性能的影响因素进行研究,分析了沸石与二氧化锰投料比、反应时间、溶液pH值、反应温度、Pb初始浓度等对二氧化锰改性沸石对废水中Pb吸附效果的影响,并全面探讨了二氧化锰改性沸石对Pb的吸附机理,为废水中Pb的高效去除提供重要依据。
1 材料与方法
1. 1 试验材料
试验材料:斜发沸石(200目以上颗粒)、高锰酸钾(KMnO)、硫酸锰(MnSO·HO)、盐酸、氢氧化钠、PbCl和腐殖酸。所有试验试剂均为优级纯,试验用水均为去离子水。
1. 2 试验设备
试验设备:ICP-OES(Agilent 5100)、恒温振荡器、烘箱、离心机、马弗炉、pH计、天平、红外光谱仪、扫描电子显微镜(日立SU3500)、红外光谱仪(Nicolet iS10)、250 mL锥形瓶若干、1 L容量瓶若干、坩埚若干。
1. 3 试验方法
1.3.1 二氧化锰改性沸石的制备与表征
本试验采用高锰酸钾与硫酸锰反应生成二氧化锰来达到改性沸石的目的,其反应化学方程式如下:
2KMnO+3MnSO·HO→5MnO+KSO+HO+2HSO
(1) 二氧化锰改性沸石的制备:首先称取0.5 g经过稀盐酸处理的沸石(用5%的盐酸浸泡18 h),用去离子水冲洗5遍,放入烘箱内烘干,最后用马弗炉高温处理(400℃煅烧3 h),得到预处理的沸石;然后将预处理的沸石,加入到装有100 mL浓度为0.023 2 mol/L的KMnO溶液锥形瓶中,并向其中加入100 mL浓度为0.034 5 mol/L的MnSO·HO溶液,置于恒温振荡器(温度为35℃、转速为200 r/min)上凝胶化2 h,陈化10 h,取出陈化后的溶液,离心(离心机转速为5 000 r/min)得到二氧化锰改性沸石(以下简称改性沸石);最后用去离子水清洗改性后的沸石,并放入烘箱内烘干,将烘干后的沸石放入400℃的马弗炉中煅烧3 h,取出,冷却后研磨成粉末,放入干燥皿中备用。
(2) 二氧化锰改性沸石的表征及红外光谱特征:采用日立扫描电镜(SU3500)对改性沸石样品进行表观特性表征;采用红外光谱仪(Nicolet iS10)测定改性沸石样品官能团的变化情况。
1.3.2 吸附试验
(1) 沸石与二氧化锰投料比的影响:分别称取2 g、1.5 g、1 g、0.75 g、0.5 g按上述试验步骤制备的改性沸石,加入到装有KMnO溶液的锥形瓶中,得到多种改性沸石,每种改性沸石中二氧化锰百分比含量不同。将0.1 g不同种类的改性沸石分别加入到装有100 mL浓度为150 mg/L的PbCl溶液锥形瓶中,将其放入温度为35℃、转速为200 r/min的恒温振荡器中反应16 h,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
(2) 反应时间的影响:试验步骤同上,在反应时间分别为0.5 h、1 h、2 h、4 h、8 h、12 h、16 h时,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
(3) 溶液pH值的影响:试验步骤同上,调节pH值分别为3、4、5、6、7、8,反应12 h后,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
(4) 反应温度的影响:试验步骤同上,调节pH值为5.3,分别在25℃、35℃、45℃、55℃、65℃水浴锅中反应12 h,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
(5) 初始Pb浓度的影响:在不同的锥形瓶中分别加入100 mL浓度分别为10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L、80 mg/L、90 mg/L、100 mg/L的PbCl溶液,调节pH值为5.3,再分别加入0.05 g的改性沸石,将其放入温度为35℃、转速为200 r/min的恒温振荡器中反应12 h,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
(6) 腐殖酸的影响:在锥形瓶中分别加入100 mL浓度为100 mg/L、pH值为5.3的PbCl溶液,同时加入一定量的腐殖酸,搅拌混匀,使腐殖酸浓度分别为0 mg/L、2 mg/L、4 mg/L、6 mg/L、8 mg/L、10 mg/L。准备2组锥形瓶,其中一组锥形瓶不加改性沸石作为对照组,另一组锥形瓶中分别加入0.1 g的改性沸石(沸石与二氧化锰投料比为1.5∶1),将两组锥形瓶均放入温度为35℃、转速为200 r/min的恒温振荡器中反应12 h,取出反应后的溶液,过滤,测定溶液中剩余Pb的浓度。
1. 4 计算公式
(1) 吸附量的计算公式:改性沸石对溶液中Pb的吸附率y
(%)和吸附量q
(mg/g)的计算公式如下: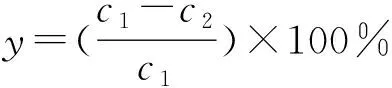
(1)
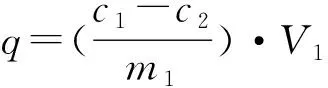
(2)
式中:c
为吸附前PbCl溶液中Pb的浓度(mg/L);c
为吸附平衡后PbCl溶液中Pb的浓度(mg/L);V
为加入PbCl溶液的体积(L);m
为加入到PbCl溶液中改性沸石的质量(g)。(2) 吸附热力学方程:热力学参数可以根据吉布斯方程来确定:
ΔG
=-RT
lnb
(3)
ΔG
=ΔH
-TΔS
(4)
式中:△G
为吸附标准吉布斯自由能变值(kJ/mol);R
为气体摩尔常数,其值为8.314 J/(mol·K);T
为绝对温度(K);b
为吸附作用平衡常数(L/mmol)。根据上式,由不同温度下的吸附平衡常数b
,可以计算出△G
的数值,进而绘制焓变△H
(kJ/mol)与熵变△S
[J/(mol·K)]曲线。(3) 等温吸附方程:用于描述吸附等温式的方程为Langmuir 吸附等温式和Freundlich吸附等温式,分别如下:
q
=Q
·b
·c
/(1+b
·c
)(5)

(6)
2 结果与讨论
2. 1 沸石的表面结构
根据第1.3.1节中的试验步骤,对沸石改性前后的表面结构进行了对比分析,沸石改性前后的表观形貌特征如图1所示。

图1 沸石改性前后的表观形貌表征Fig.1 Morphology characterization of zeolite before and after modification
由图1可见,原沸石的表面结构不平整[见图1(a)],形态各异,存在很多大小不一且相互交错的颗粒,其中板状大颗粒占大部分,其间隙分布着许多无规则形状的小颗粒;改性后的沸石明显被锰氧化物覆盖[见图1(b)],且锰氧化物颗粒为球状、絮状结合体,呈立体的多孔结构,极大地增加了改性沸石的表面积,从而提高了改性沸石对Pb的吸附能力。
采用高锰酸钾和硫酸锰氧化还原沉淀法制备的锰氧化物为 σ-MnO,其形貌为纳米球。沸石表面由于被二氧化锰覆盖形成大量的小沟壑,这些小沟壑足以使吸附质分子渗透到吸附剂结构中,并与吸附剂表面基团发生作用。扫描电子显微镜SEM的结果表明:改性后的沸石表面发生了明显的变化,表面积变大,颗粒变细,其吸附性能可能会增强。
2.2 沸石与二氧化锰投料比对改性沸石吸附性能的影响
根据第1.3.2节中多种改性沸石生成试验,得到沸石与二氧化锰不同投料比条件下改性沸石对溶液中Pb吸附性能的影响,其试验结果见图2。
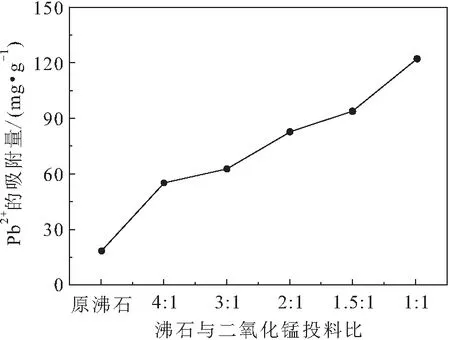
图2 沸石与二氧化锰投料比对改性沸石吸附性能的影响Fig.2 Influence of different ratios of zeolite to manga- nese dioxide on adsorption performance of modified zeolite
由图2可见,随着改性沸石中二氧化锰含量的增加,改性沸石对溶液中Pb的平衡吸附量越来越大:原沸石的平衡吸附量为18 mg/g,当沸石与二氧化锰的投料比为3∶1时,生成的改性沸石对溶液中Pb的吸附量达到62 mg/g;当沸石与二氧化锰的投料比为1∶1时,生成的改性沸石对溶液中Pb的吸附量达到123 mg/g,比原沸石对Pb的吸附量提高了105 mg/g。因此,在试验范围内,改性沸石对溶液中Pb的吸附量随着二氧化锰含量的增加而增大。
进一步分析发现,纳米二氧化锰微孔材料特殊的表面结构和化学特性使其对溶液中重金属具有很强的吸附能力,但其在溶液中很容易自发团聚而失去吸附能力。纳米二氧化锰包裹沸石后,不仅降低了等电点(受各种因素的影响,MnO等电点范围在1.5~4.6之间),使得表面带有大量的负电荷,并且增加了沸石的比表面积(合成的σ-MnO比表面积为270.8 m/g),大大提高了介孔的含量(层状σ-MnO的平均孔径为4.3 nm),同时使细小的二氧化锰颗粒团聚,易于后续处理。因此,沸石经改性后极大地提高了其对溶液中Pb的吸附量,且随着沸石与二氧化锰投料比的提高其对溶液中Pb的吸附量持续增加。
2. 3 反应时间对改性沸石吸附性能的影响
根据第1.3.2节中不同反应时间的吸附试验,得到沸石与二氧化锰不同投料比条件下反应时间对改性沸石吸附性能的影响,其试验结果见图3。

图3 沸石与二氧化锰不同投料比条件下反应时间对 改性沸石吸附性能的影响Fig.3 Influence of reaction time adsorption performance of modified zeolite produced by different ratios of zeolite to manganese dioxide
由图3可见,多种改性沸石对溶液中Pb的吸附平衡时间基本一致,反应4 h时对溶液中Pb的吸附量均达到平衡吸附量的93%左右,反应12 h后达到平衡;但对溶液中Pb的吸附速率在吸附初期有所差异。当沸石与二氧化锰投料比为1∶1时,改性沸石对溶液中Pb的吸附量在0.5 h时为81 mg/g,在2~4 h时其吸附量增加了7 mg/g,在4~16 h时其吸附量增加了11 mg/g,达到平衡状态;当沸石与二氧化锰投料比为3∶1时,改性沸石对溶液中Pb的吸附量在0.5 h时为47 mg/g,在2~4 h时其吸附量增加了3 mg/g,在4~16 h时其吸附量增加了5 mg/g,达到平衡状态。由此可以看出,改性沸石在前期对溶液中Pb的吸附速率较快,而在后期趋于平稳。吕瑞阳研究发现,天然沸石2 h对溶液中Cu、Pb、Zn、Cd和Cr的吸附率约为69.61%、46.23%、49.00%、91.00%和58.40%,6 h对溶液中Cu、Pb、Zn、Cd和Cr的吸附率大约为82.18%、84.03%、53.00%、93.00%和76.00%,结果也显示出天然沸石在前期对溶液中重金属的吸附速率较快,后期趋于稳定的变化趋势。
2.4 溶液pH值对改性沸石吸附性能的影响
根据第1.3.2节中不同溶液pH值的吸附试验,得到沸石与二氧化锰不同投料比条件下溶液pH值对改性沸石吸附性能的影响,其试验结果见图4。

图4 溶液pH值对改性沸石吸附性能的影响Fig.4 Influence of pH value on adsorption performance of modified zeolite
由图4可见,随着溶液pH值的升高,溶液中Pb平衡浓度逐渐下降,表明溶液中自由Pb浓度逐渐减少。当溶液pH值为3~6,沸石与二氧化锰投料比为3∶1时,溶液中Pb的平衡浓度由108 mg/L下降到91 mg/L,下降幅度为15.7%,当沸石与二氧化锰投料比为1.5∶1时,溶液中Pb的平衡浓度由67 mg/L下降到51 mg/L,下降幅度为23.9%;当pH值升高到8,沸石与二氧化锰投料比不同时溶液中Pb的平衡浓度都急速下降,几乎为0,溶液中基本不存在自由Pb;随着pH值的变化,多种改性沸石对溶液中自由Pb的吸附量的变化趋势基本一致,不同的是在吸附初期,改性沸石中二氧化锰的含量越低,溶液中自由Pb的浓度越高,其吸附率越低。
一般来讲,溶液pH值对吸附剂吸附金属离子的影响方式有两种:一是对溶液中金属离子的溶解度和形态的影响;二是对吸附剂总电荷的影响。当溶液pH值较低(3~4)时,溶液中存在大量H,在离子交换过程中H与Pb竞争吸附位点,沸石对溶液中Pb的吸附量较低,同时当溶液pH值低于离子的等电点时,改性沸石表面的锰羟基官能团由于质子化而带正电荷,防止带正电荷的金属离子扩散到吸附剂表层,因此在低pH值时,沸石对溶液中Pb的吸附量较低;当溶液pH值较高(4~6)时,溶液中—OH增加,同时锰羟基官能团发生去质子化而带负电荷,Pb与改性沸石中的—OH络合,促使溶液中自由Pb浓度减少;而当溶液pH值大于6时,溶液中自由Pb的浓度迅速下降,主要是形成了铅的氢氧化物沉淀。因此,为了研究改性沸石对溶液中Pb的吸附效果,在此后的试验中均将溶液pH值控制在5~6之间。
2. 5 反应温度对改性沸石吸附性能的影响
根据第1.3.2节中不同反应温度的吸附试验,得到沸石与二氧化锰不同投料比条件下反应温度对改性沸石吸附性能的影响,其试验结果见图5。
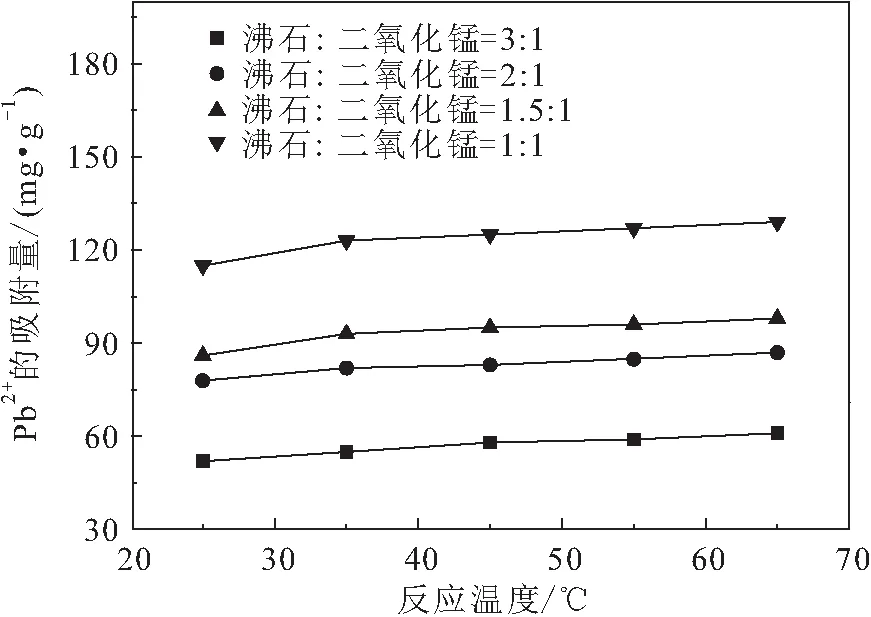
图5 反应温度对改性沸石吸附性能的影响Fig.5 Influence of reaction temperature on adsorption performance of modified zeolite
由图5可见,多种改性沸石对溶液中Pb的吸附趋势一致,改性沸石对溶液中Pb的吸附量均随反应温度的升高而增加;当沸石与二氧化锰投料比为3∶1,反应温度分别为25℃和65℃时,改性沸石对溶液中Pb的吸附量分别为52 mg/g和60 mg/g,吸附量提高了15.3%;当沸石与二氧化锰投料比为1∶1,反应温度分别为25℃和65℃时,改性沸石对溶液中Pb的吸附量分别为115 mg/g和129 mg/g,吸附量提高了12.2%;同理,当沸石与二氧化锰投料比分别为2∶1和1.5∶1,反应温度分别为25℃和65℃时,改性沸石对溶液中Pb的吸附量分别提高了11.5%和13.9%,说明沸石与二氧化锰不同比例生成的改性沸石随着温度的升高,对溶液中Pb吸附量增加的幅度基本一致。这是由于温度升高可以加快离子交换速度,溶液中Pb的动能随着反应温度的升高而增大,溶液中Pb更快地扩散到改性沸石内部的孔隙中,使得其吸附量增大。同时,改性沸石对溶液中其他重金属的吸附也有类似的现象,如采用NHNO和NaCl改性的沸石在反应温度为5~35℃时对溶液中Pb(铵型沸石吸附)、Cd(钠型沸石吸附)、Zn(钠型沸石吸附)和Cu(钠型沸石吸附)的吸附率分别提高了15%、18%、10%和12%,其吸附量分别提高了16.9 mg/g、7.9 mg/g、2.6 mg/g和3.1 mg/g,表明温度升高有利于离子交换反应的进行,从而提高了铵型和钠型沸石对溶液中重金属的吸附量。
改性沸石对溶液中Pb的吸附机理,可利用其吸附热力学参数来进行分析。吉布斯自由能变(△G
) 、焓变(△H
) 和熵变(△S
)等热力学参数,对研究吸附过程的热能改变和确定吸附的自发行为起着重要作用。重复不同热力学温度条件下的吸附试验(使用沸石与二氧化锰投料比为2∶1生成的改性沸石,其投加量为0.05 g,反应温度设定为45℃、55℃、65℃),将得到的试验结果以△G
~T
作图,可得到一条直线,焓变△H
和熵变△S
的值可以通过直线的截距和斜率求得,得到的不同热力学温度下热力学参数,见表1。由表1可知,改性沸石对溶液中Pb吸附过程的吉布斯自由能变△G
值均为负值,且随着温度升高,其值越小(△G
从-13.08 kJ/mol下降到-14.78 kJ/mol),焓变△H
值(14.09 kJ/mol)和
表1 不同热力学温度下吸附热力学参数
熵变△S
值(85 J/(mol·K))均为正值。这是由于温度升高可以使离子交换速度加快,Pb更快地扩散到改性沸石内部的孔隙中,使得吸附效果增强。Pb进入沸石相与离子的交换反应,此过程的熵变△S
值大于零,说明该离子交换过程属于熵增的反应;吉布斯自由能△G
值小于零,且随着温度的升高,△G
值越小,说明升高温度有利于改性沸石与溶液中Pb进行离子交换,为自发的吸热反应。同时也表明,在试验范围内,改性沸石对溶液中Pb的平衡吸附量随着温度的上升而增加。2.6 初始Pb2+浓度对改性沸石吸附性能的影响
根据第1.3.2节中不同初始Pb浓度的吸附试验,将不同沸石与二氧化锰投料比的改性沸石与不同初始Pb浓度的溶液,在温度为35℃、pH值为5.3的条件下进行吸附试验,反应时间为12 h,测量溶液中Pb的平衡浓度,即达到吸附平衡时溶液中Pb的浓度,并将所得的试验结果分别采用Langmuir模型和Freundlich模型进行描述,见图6。
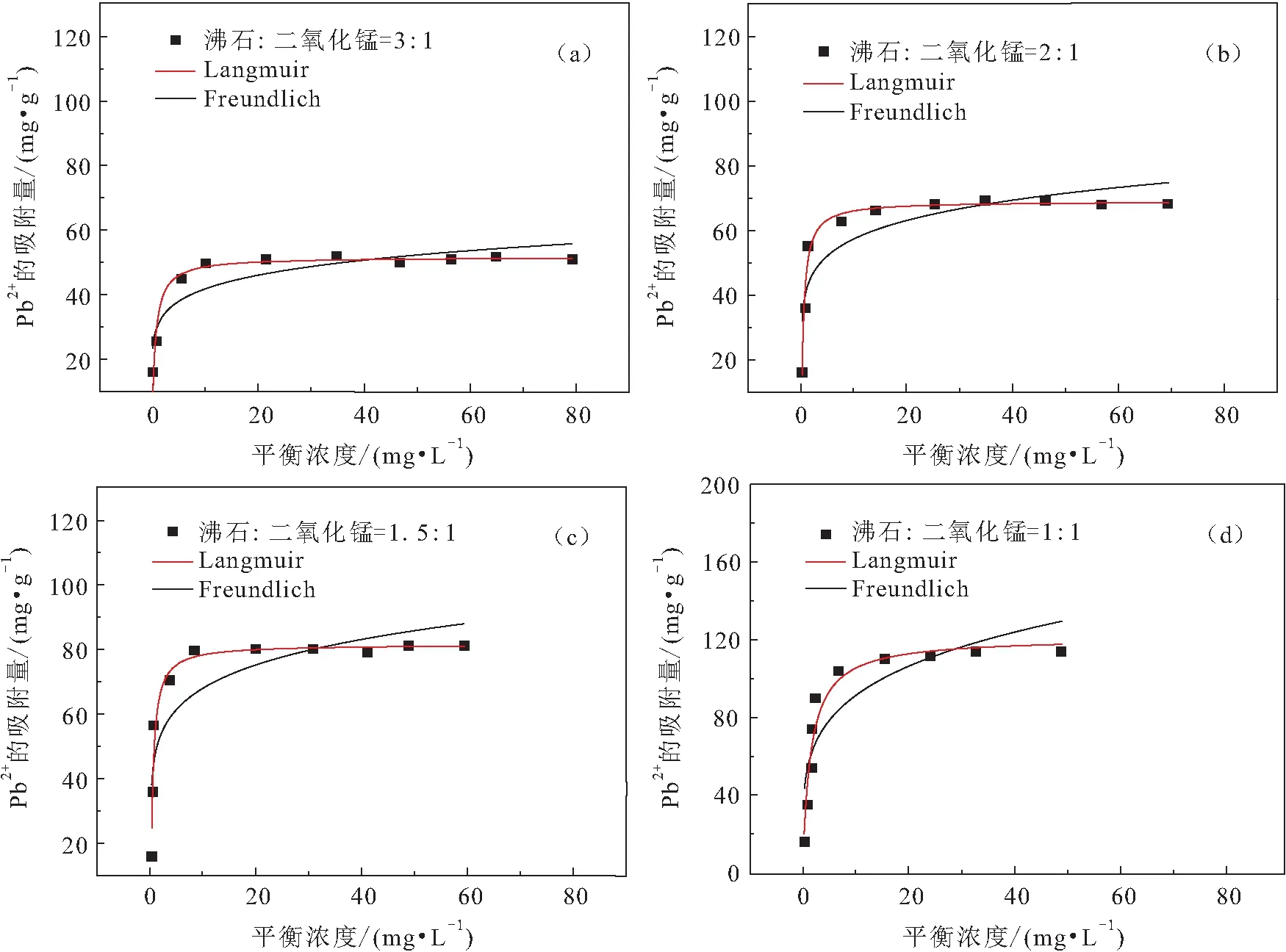
图6 初始Pb2+浓度对改性沸石吸附性能的影响Fig.6 Influence of initial Pb2+ concentration on adsorption performance of modified zeolite
由图6可见,沸石与二氧化锰不同投料比的改性沸石对溶液中Pb吸附曲线的变化趋势一致,随着初始Pb浓度的增加,溶液中Pb的平衡浓度增大,改性沸石对溶液中Pb的吸附量先上升后趋于平稳。当沸石与二氧化锰投料比为3∶1,溶液中Pb平衡浓度为0.5 mg/L时,改性沸石对溶液中Pb的吸附量为16 .4 mg/g,溶液中Pb平衡浓度为10.2 mg/L时,改性沸石对溶液中Pb的吸附量为49.2 mg/g,而增加初始Pb的浓度,当溶液中Pb平衡浓度为79.3 mg/L时,改性沸石对溶液中Pb的吸附量为51.2 mg/g,对比溶液中Pb平衡浓度为10.2 mg/L时,其吸附量提高了2 mg/g;当沸石与二氧化锰投料比为1∶1,溶液中Pb平衡浓度为0.4 mg/L时,改性沸石对溶液中Pb的吸附量为16.6 mg/g,当溶液中Pb平衡浓度为24.1 mg/L时,改性沸石对溶液中Pb的吸附量为112.3 mg/g,而增加初始Pb的浓度,当溶液中Pb平衡浓度为48.6 mg/L时,改性沸石对溶液中Pb的吸附量为115.3 mg/g,对比溶液中Pb平衡浓度为24.1 mg/L时,其吸附量提高了3 mg/g。由此可以看出,改性沸石对溶液中Pb的平衡吸附量并不是固定不变的,而是随着初始Pb浓度的变化而变化。
为了进一步研究改性沸石对溶液中Pb的吸附规律,本文利用Freundlich和Langmuir等温吸附模型分别对吸附试验数据进行了拟合,其中Freundlich等温吸附模型为多分子非均匀表面上的吸附,Langmuir等温吸附模型为单分子层均匀吸附,得到的等温吸附模型的拟合参数,见表2。

表2 等温吸附模型的拟合参数
由表2可知,随着改性沸石中二氧化锰含量的增加,改性沸石对溶液中Pb的饱和吸附量也随之增加;采用Freundlich模型拟合时,相关系数不高,均低于0.9,且相关系数变化较大;采用Langmuir模型拟合时,相关系数较高,均在0.94以上,拟合效果较好,拟合得到的不同沸石与二氧化锰投料比的改性沸石对溶液中Pb的理论饱和吸附量与吸附试验所得的平衡吸附量基本吻合,分别为51.65 mg/g、68.79 mg/g、81.41 mg/g和114.88 mg/g。因此,可以说明二氧化锰改性沸石吸附Pb为单分子层均匀吸附。
2. 7 腐殖酸对改性沸石吸附性能的影响
水体、土壤以及植物体经腐败分解后的沉积物的主要成分是腐殖质,是一种复杂的高分子有机聚合物的总称,是自然界最丰富的有机质之一。腐殖质能够吸附环境中的Pb,对溶液中Pb的浓度产生影响。为了模拟真实环境中改性沸石对溶液中Pb的吸附效果,本试验以腐殖酸代替腐殖质。根据第1.3.2节中不同浓度腐殖酸的吸附试验,得到腐殖酸存在条件下改性沸石(沸石与二氧化锰投料比为1.5∶1)对溶液中Pb的吸附量,其试验结果见图7。
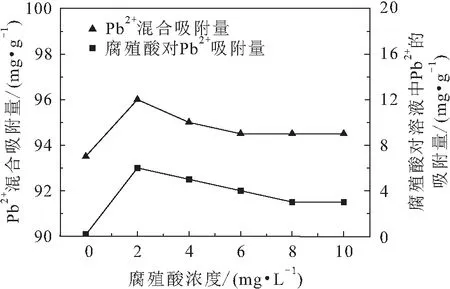
图7 腐殖酸存在条件下改性沸石对溶液中Pb2+的吸附量Fig.7 Adsorption capacity of modified zeolite to lead in the presence of humic acid
由图7可见,腐殖酸对溶液中Pb具有吸附作用,但腐殖酸对溶液中Pb的吸附量远远小于改性沸石对溶液中Pb的吸附量,当腐殖酸浓度为2 mg/L时,腐殖酸对溶液中Pb的平衡吸附量为6 mg/g,当腐殖酸浓度为10 mg/L时,腐殖酸对溶液中Pb的平衡吸附量只有3 mg/g;同时存在腐殖酸和改性沸石条件下,改性沸石对溶液中Pb的平衡吸附量有少量提高,当改性沸石单独存在时,改性沸石对溶液中Pb的平衡吸附量为93.5 mg/g,当溶液中腐殖酸浓度为2 mg/L且改性沸石存在时,改性沸石和腐殖酸对溶液中Pb的混合吸附量为96 mg/g,其吸附量增加了2.5 mg/g。以上试验结果表明,腐殖酸存在条件下,改性沸石对溶液中Pb的去除率有所提高,但也仅提高2.6%左右。
进一步分析发现,在腐殖酸中存在着许多重要的络合官能团,如羧基(—COOH)、羟基(—OH)等,络合官能团因可提供电子而与Pb形成络合物,而这些络合物中有部分是具有溶解性的,因此腐殖酸对溶液中Pb的去除率并不高。此外,由于二氧化锰本身对腐殖酸有一定的吸附作用,当腐殖酸与沸石共同存在时,腐殖酸会占据改性沸石表面的部分吸附位点,从而使得当腐殖酸与改性沸石同时存在条件下,对溶液中Pb的吸附量并没有显著提高。任刚等研究发现,对于天然沸石和铁锰氧化物改性沸石,当溶液中腐殖酸的浓度为2 mg/L时,对溶液中Cr(Ⅵ)的吸附影响率仅有2%~4%,表明当腐殖酸存在时,对溶液中重金属离子吸附效果的影响较小。该研究结果与本文结果基本一致。
2.8 改性沸石对溶液中Pb2+的吸附机理分析
为了探究改性沸石吸附前后表面官能团的变化,分析其对溶液中Pb的吸附机理,本试验对改性沸石吸附前后的粉末样品(沸石与二氧化锰投料比为1.5∶1)进行了红外光谱分析,其试验结果见图8。

图8 改性沸石吸附前后红外光谱分析图Fig.8 Infrared spectrogram of modified zeolite before and after adsorption
由图8可见,改性沸石吸附前,波数为3 417 cm附近的峰强较高,其余波数的峰强小;改性沸石吸附后,除了波数为3 417 cm附近的峰强明显变弱、峰顶有向右移动的趋势外,其余波数的峰形与吸附前基本一致;波数为3 400 cm附近的峰为二氧化锰表面羟基的伸缩峰,波数为3 417 cm附近的峰强明显变弱,说明—OH是影响改性沸石对溶液中Pb吸附效果的主要官能团。
改性沸石表面的氧化物处于不饱和的状态而具有表面能,使其具有自发吸附外来离子或分子以降低表面能的倾向;在溶液中锰氧化物表面上结合着配位水,构成水合金属氧化物,导致锰氧化物表面的羟基化;溶液中重金属离子与锰氧化物表面羟基发生络合反应,形成以配位键相连的羟基络合物。表面络合理论是目前较为普遍的一种吸附理论,若某种吸附材料是以羟基化的氧化物为主,那么该材料的表面羟基会参与氧化物-水界面的配位体的交换过程,以及与溶液中重金属离子发生络合反应,这是决定吸附材料吸附重金属能力的重要因素之一。
3 结 论
二氧化锰改性沸石是一种良好的吸附剂,同时对溶液中多种重金属有较好的吸附效果,相比其他吸附剂其具有颗粒大、易处理、价格低廉等优点,不需要吸附后的混凝、沉淀等处理,能较大地节约成本和提高效率,易实现工程应用,在处理矿山废水、地表水污染及突发性污染事故中具有巨大的市场应用潜力和较好的社会、环境和经济效益。
本文系统地研究了二氧化锰改性沸石对废水中Pb的吸附性能及其影响因素,如沸石与二氧化锰的投料比、反应时间、溶液pH值、反应温度、初始Pb浓度和腐殖酸等,主要得出以下结论:
(1) 二氧化锰改性沸石对溶液中Pb的吸附在12 h就可以达到平衡,且改性沸石对溶液中Pb的平衡吸附量随着沸石与二氧化锰投料比的增加而增大。
(2) 溶液pH值和反应温度均会对改性沸石对溶液中Pb的吸附性能产生影响。当溶液pH值小于6时,吸附起主要作用,当溶液pH值大于6时,沉淀起主要作用;改性沸石对溶液中Pb的吸附是自发的吸热反应,因此反应温度越高,其吸附能力愈强。
(3) 吸附等温线和红外光谱分析结果表明,改性沸石对溶液中Pb的吸附过程符合Langmuir等温吸附模型,说明其吸附是单官能团的均匀吸附,且主要为—OH官能团。
(4) 低浓度腐殖酸对改性沸石对溶液中Pb吸附性能的影响较小,不形成竞争吸附。

