串核桃雌花芽分化内源激素和多胺含量变化的研究
田小琴 娄 丽 冷天凤
(贵州省核桃研究所,贵州 贵阳 550005)
串核桃属于贵州乡土品种即泡核桃(Juglans.sigillataDode)的一个优良类型,又名葡萄核桃,每雌花序着生10~30朵雌花,穗状果序多着生坚果5~30个[1-2]。串核桃结实量大、产量高,但在生产中落花落果等问题严重,目前串核桃雌花花芽分化内源激素及多胺变化方面未见报道,因此,本文通过对已进入盛果期的串核桃雌花芽外观形态和内部结构进行观察,划分雌花芽分化时期,再结合花芽分化期内源激素和多胺等含量变化,从植物激素和多胺角度分析成花原因,以期为解决串核桃落花落果问题提供理论指导。
花芽分化是植物由营养生长转入生殖生长的标志,是有花植物发育最为关键的阶段,是一个比较复杂的形态建成过程,由植物体内外的多种因子共同作用、相互协调完成[1]。其中内源激素是重要的影响因子之一,研究植物花芽分化过程中内源激素的变化可为植物开花的化学调控提供理论依据。目前,国内外对于植物激素对花芽分化的作用众说纷纭,国内外很多研究表明,生长素(IAA)和赤霉素(GA3)抑制短日照植物花芽分化,而细胞分裂素(CTK)和脱落酸(ABA)促进花芽分化[3-4]。多胺是植物体内具有广泛生物活性的含氮碱,自1989年以来,多胺在植物方面的研究取得了很大的进展,尤其是精胺(Spm)、亚精胺(Spd)和腐胺(Put)广泛分布于植物体中,对许多高等植物的生长发育具有调节作用,与植物遗传物质的合成,器官的分化,膜的稳定性及内源激素的平衡等有着密切联系,对果树胚胎发生、萌芽、开花、坐果、花芽分化、性别表达、果实生长、根系形成、抗逆性等有多方面的效应[5-9]。
1 试验材料与方法
1.1 试验地概况和材料
试验地位于息烽县西山村,属亚热带季风湿润气候区,气候温和,雨量充沛,年平均气温12~16℃,年降雨量950~1200mm,海拔1105m~1304m,土层厚度150cm,土壤为砂页岩发育的黄壤,呈微酸性至中性。试验材料为15年生的串核桃植株。
1.2 试验方法
1.2.1 采样
2018年3月上旬~2019年4月上旬,树液开始萌动后开始取雌花芽。取样时间为3月上旬~5月下旬,每10d采1次,6月上旬~9月上旬,30d采一次,9月中旬~第二年2月下旬采1次。雌花芽主要采集植株不同方位的结果母枝顶芽和中部芽,对收集的样品分两部分进行处理分别保存,一部分用 FAA 固定液保存进行石蜡切片,明确雌花芽分化时期,在显微镜下观察其内部形态变化特征,另一部分称取花芽5g左右,用液氮处理后放于零下80℃ 冰箱,用于测定花芽内源激素和多胺含量。
1.2.2 雌花芽分化时期的确定
根据串核桃雌花芽外观形态和内部结构观察,雌花芽分化时间为4月下旬,完成于次年的3月中旬,历经11个月的时间,雌花芽分化分为6个时期,分别是穗状花序分化期(4月20号)、花柄和雌花原基分化期(5月23号)、苞片和花被分化期(7月16号)、雌蕊分化期(3月10号)、雌花形成期(3月28号)、雌花开放期(4月10号)。
1.2.3 内源激素含量及多胺测定
采用高效液相色谱法测定4种植物激素(IAA、ABA、GA3、ZR)和多胺(Spm、Spd、Put)含量[3]。
1.2.4 数据处理
采用Excel2007和SPSS软件对数据进行统计分析。
2 结果与分析
2.1 串核桃雌花芽分化期内源激素的变化
由图1可知,串核桃穗状花序分化期、花柄和雌花原基分化期、苞片和花被分化期IAA含量分别为19.22ng/g.FW、18.18ng/g.FW和23.84ng/g.FW,在12月9号出现峰值,含量为47.4ng/g.FW,此时是串核桃休眠期,休眠期过后IAA含量迅速下降,第二年雌蕊原基开始分化直至雌花开放时,IAA含量都处于较低水平;雌花芽分化中ABA含量的最大值与IAA含量类似都出现在12月,含量为206.88ng/g.FW,最低值出现在苞片和花被分化期,含量为43.78 ng/g.FW;雌花芽分化中GA3的变化趋势与IAA变化一致,12月份最高,含量为11.69 ng/g.FW,其它分化时期含量较低;ZR在雌花芽分化中最低值出现在12月份,含量为2.99 ng/g.FW,最高值出现在花柄和雌花原基分化期,含量为31.64 ng/g.FW。这说明较低水平的IAA、ABA和GA3含量和较高的ZR含量更有利于雌花芽的分化,过高的IAA、ABA和GA3含量可能使分化过程停止,并引起花芽休眠。

图1 不同花芽分化时期内源激素含量的变化
2.2 串核桃雌花芽分化期激素比值
内源激素的平衡状况是影响雌花芽分化的主要因素,由图2可知,从穗状花序分化期到雌花开放期IAA/ABA和IAA/GA3的比值较小,变化不明显,总体呈下降趋势;IAA/ZR和ABA/ZR的比值从穗状花序分化期至苞片和花被分化期很低,在休眠期比值迅速升高,暖春花芽开始分化时比值又持续下降,直至雌花完全开放;ABA/GA3的比值相对较大,呈现“下降-上升-下降-上升的趋势”,最大的时期是雌花开放期为32.25,比值最低的是苞片和花被分化期为10.04;ZR/GA3比值的变化趋势是“上升-下降-上升”,最大时期是花柄和雌花原基分化期为9.14,最小时期为休眠期为0.26。
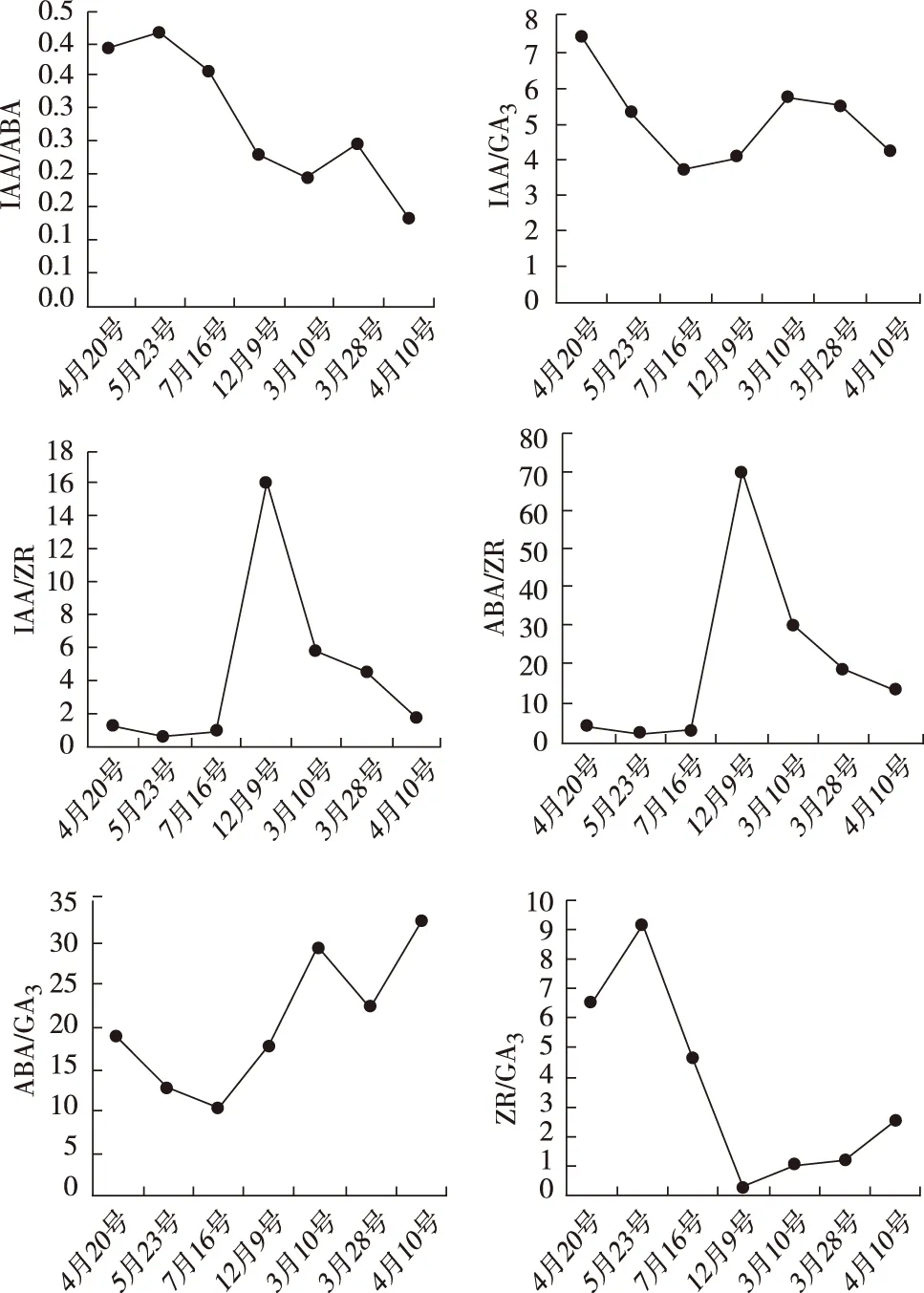
图2 不同花芽分化时期内源激素比值变化
2.3 串核桃雌花芽分化期多胺含量变化
由图3可知, 串核桃雌花芽不同分化期Spm和Spd的变化趋势类似,在花柄和雌花原基分化期出现峰值,分别为1.03umol/g.FW和1.04umol/g.FW;Spm的最低值在穗状花序分化期,为0.16 umol/g.FW;Spd的最低值出现在树体休眠期,为0.29 umol/g.FW。Put的峰值出现在苞片和花被分化期,为2.19 umol/g.FW,最低值和Spd类似出现在休眠期,为1.02 umol/g.FW。结果表明,在花柄和雌花原基分化期需要保持较高的Spm和Spd含量,在苞片和花被分化期需要较高的Put含量。
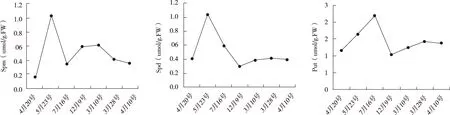
图3 不同花芽分化时期多胺含量变化
3 结论和讨论
激素及多胺与植物的花芽分化具有十分紧密的联系,但最有影响的是赤霉素(GA3)、细胞分裂素(CTK)、生长素(IAA)和脱落酸(ABA)等。目前普遍认为赤霉素对果树及木本植物花的发生起抑制作用,前人研究的枣树、荔枝、苹果、芒果等果树花芽期间赤霉素都有十分明显的抑制花芽分化的作用[10-11]。也有研究表明赤霉素量减少是分化所必须的,而在后期花器官发育,赤霉素是有促进作用的[12]。大部分学者认为较高水平的细胞分裂素含量会促进花芽的分化[12-15]。生长素对花芽分化的作用尚无统一定论,有学者对樱桃花芽分化的研究表明低浓度的生长素有助于花芽形态分化[13],而李天红发现生长素对花芽分化有促进作用[14]。脱落酸对花芽分化的作用众说纷纭,曹尚银和认为脱落酸含量高对成花有促进作用,黄羌维在对龙眼的研究中发现较高含量的脱落酸不利于花芽的形成。有些研究认为激素比值与花芽分化的关系比单项激素水平更密切[16]。大量的研究表明,多胺参与调节植物的花芽分化,但是关于多胺调控植物成花的机理仍不清楚[17-18]。
本研究表明,串核桃雌花芽分化中较低水平的IAA、ABA、GA3含量和较高水平的ZR含量可能更有利于雌花芽分化,在雌花芽分化中,ZR的累积能使树体生长和分化停止,并引起雌花芽的休眠;IAA/ABA、IAA/GA3、ABA/GA3、ZR/GA3高比值和IAA/ZR、ABA/ZR低比值有利于雌花芽分化;雌花芽分化期需要一定的Spm、Spd和Put含量。

