狼尾草属象草PpPAPs基因的克隆及响应低磷胁迫的表达模式分析
黄 睿, 罗佳佳, 吴远航, 刘攀道*, 刘国道*
(1.中国热带农业科学院热带作物品种资源研究所,农业部华南作物基因资源与种质创制重点实验室, 海南 海口 571101;2.海南大学热带作物学院, 海南 海口 570228)
磷(phosphorus,P)是植物生长发育所必需的大量营养元素,参与了植物细胞的膜与核苷酸合成、光合作用与能量转换等各种新陈代谢过程[1]。无机磷酸盐(inorganic phosphate,Pi)是能被植物根系直接吸收的主要磷形式,但其在土壤中易于被金属离子与有机物固定,形成难于被植物直接吸收的难溶性磷和有机磷[2]。因此,在大多数耕作土壤,磷有效性低是限制作物增产的主要因素之一[3]。在传统农业系统中,经常过量施用磷肥来维持作物生产,但这可能导致土壤加速退化和水体富营养化[4]。因此,选育磷高效作物品种并解析其适应低磷胁迫机理,对于减少磷肥施用量、发展生态农业具有重要意义。植物在长期进化过程中形成了一系列低磷胁迫适应机制,如根系形态构型的重塑、与丛枝菌根形成共生网络、增强高亲和力磷转运子的表达及活性、分泌有机酸和酸性磷酸酶(acid phosphatase,ACP)到根际等[5-6]。值得注意的是,土壤中30%~65%的磷以有机磷的形式存在,如植酸磷、膜磷脂、核苷酸及其衍生物等[7],但有机磷只有被ACP水解后释放出Pi才能被植物利用[8]。从不同植物的根系中,已鉴定了众多受低磷胁迫诱导增强表达的ACP,其中绝大多数由紫色酸性磷酸酶(purple acid phosphatase,PAP)家族基因编码[9]。植物PAP属于多基因家族(multigene family),如拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)和大豆(Glycinemax)的基因组中分别有29,26和38个PAP基因[10]。但是,已被证明在植物适应低磷胁迫过程中发挥生物学功能的PAP基因主要来源于双子叶植物,如拟南芥、大豆、菜豆(Phaseolusvulgaris)和白羽扇豆(Lupinusalbus)等[9],而单子叶植物中,仅水稻中的3个低磷响应PAP基因(OsPAP10a,OsPAP10c和OsPAP21b)被阐明了参与腺嘌呤核苷三磷酸(ATP)的利用[11]。对于其他单子叶植物,PAP基因对低磷胁迫的响应及其生物学功能仍有待深入研究。
象草(Pennisetumpurpureum)是禾本科狼尾草属多年生大型草本植物[12]。象草具有生长快、产量高、分蘖多、再生性强、适口性好等特点,是一种适合在我国南方热带亚热带地区种植的优质饲草[13]。但在我国南方的酸性土壤中普遍存在磷有效性低的问题,象草对低磷胁迫的适应机理仍不清楚。本研究将分析象草对外源ATP的利用能力,随后同源克隆了象草中可能参与ATP利用的3个PAP家族基因(PpPAPs),并分析了PpPAPs响应低磷胁迫的表达模式,以期为解析象草适应低磷胁迫机理提供一定理论基础。
1 材料与方法
1.1 植物材料和培养条件
本研究所用象草材料由中国热带农业科学院热带作物品种资源研究所的“农业农村部儋州热带牧草种质资源圃”收集保存并提供。营养液配方如下:1 500 μmol·L-1KNO3,1 200 μmol·L-1Ca(NO3)2,400 μmol·L-1NH4NO3,25 μmol·L-1MgCl2,500 μmol·L-1MgSO4,300 μmol·L-1K2SO4,0.3 μmol·L-1(NH4)2SO4,1.5 μmol·L-1MnSO4,0.5 μmol·L-1CuSO4,1.5 μmol·L-1ZnSO4,0.16 μmol·L-1(NH4)6Mo7O24,2.5 μmol·L-1NaB4O7,40 μmol·L-1Fe-Na-EDTA。象草的营养液水培试验方法如下:选取长度为10 cm左右的象草种芽,在含600 μmol·L-1KH2PO4的营养液中预培养使其生根。预培养10 d后,选择长势均一的幼苗,分别移至添加不同磷源的营养液中进行处理,即:添加600 μmol·L-1KH2PO4(+P处理)、添加200 μmol·L-1ATP(+ATP处理)和不添加KH2PO4(-P处理)。每隔5 d更换一次营养液,每个处理设4个生物学重复。分别在处理5 d,10 d和15 d后分地上部和根部收取样品。
1.2 方法
1.2.1干重与全磷含测定 将所收样品放入烘箱于70℃烘干至恒重后称干重。象草干样品粉碎后称取50 mg于消煮管中,先用双蒸水湿润后,再加浓硫酸2 mL,摇匀,在消煮炉中消解,期间加2~3次过氧化氢,每次加5~10滴,消解至无色后再消解1 h。消解完成后冷却,用双蒸水定容至100 mL,澄清后溶液待测。参照Murphy和Riley[14]的方法测定全磷含量,取适量体积的样品磷待测液,用双蒸水定容至1.8 mL后加入0.2 mL钼锑抗显色液,混匀并静置30 min后测定OD700的吸光度值。
1.2.2ACP活性测定 根系胞内ACP活性测定:称取根系鲜样品100 mg,加入2 mLTris-HCl缓冲液(0.1 M,pH 8.0),冰浴研磨成匀浆,12 000 rpm离心15 min,收集上清液即为胞内蛋白提取液。参照Bradford[15]的方法测定蛋白浓度。酶活性的测定参照Liang等[16]的方法,取一定体积蛋白提取液于2 mL离心管中,用双蒸水定容至0.2 mL,加入0.8 mL含2 mM ATP底物溶液(用pH 5.5的20 mM Tris-HCl缓冲液配制),摇匀,于35℃反应15 min后加入0.5 mL三氯乙酸溶液(10%)终止反应。空白对照以20 mM Tris-HCl缓冲液(pH 5.5)替代底物溶液,用于评估王草根系样品中的含磷量。ACP催化底物水解后释放出的磷,参照Irving和McLaughlin[17]的孔雀石绿定磷法测定。酶活性用单位蛋白(mg)的酶活力单位(U)表示。根系分泌ACP活性测定以ATP为底物,参照黄睿等[18]的方法进行。
1.2.3象草PpPAPs的同源克隆与进化树分析 为克隆象草中分别与OsPAP10a(Gene loci:Os01 g56880)、OsPAP10c(Gene loci:Os12 g44020)和PvPAP3(Gene loci:Phvul.002G181500)同源的基因序列,分别根据这3个PAPs的保守结构域序列设计EST扩增引物PpPAP3/10a/10c-EST-F/R,通过PCR扩增出它们的EST片段并测序。随后,根据这3个PpPAPs的EST序列设计5′末端特异扩增引物PpPAP3/10a/10c-5′RACE-R和3′末端特异扩增引物PpPAP3/10a/10c-3′RACE-F,并分别与通用引物RACE-UPM和RACE-NUP配对,采用cDNA末端快速扩增试剂盒SMARTer RACE 5′/3′Kit(Clontech,美国),分别扩增出它们的5′和3′末端序列并测序。每个PpPAP的EST,5′和3′端序列,通过MEGA 5软件拼接后获cDNA全长序列。设计引物PpPAP3/10a/10c-ORF-F/R进行PCR扩增全长序列并测序验证。本研究所用引物见表1。多序列比对与蛋白进化树构建分别采用Cluster X和MEGA 5软件。蛋白分子量与等电点预测采用Editseq软件。
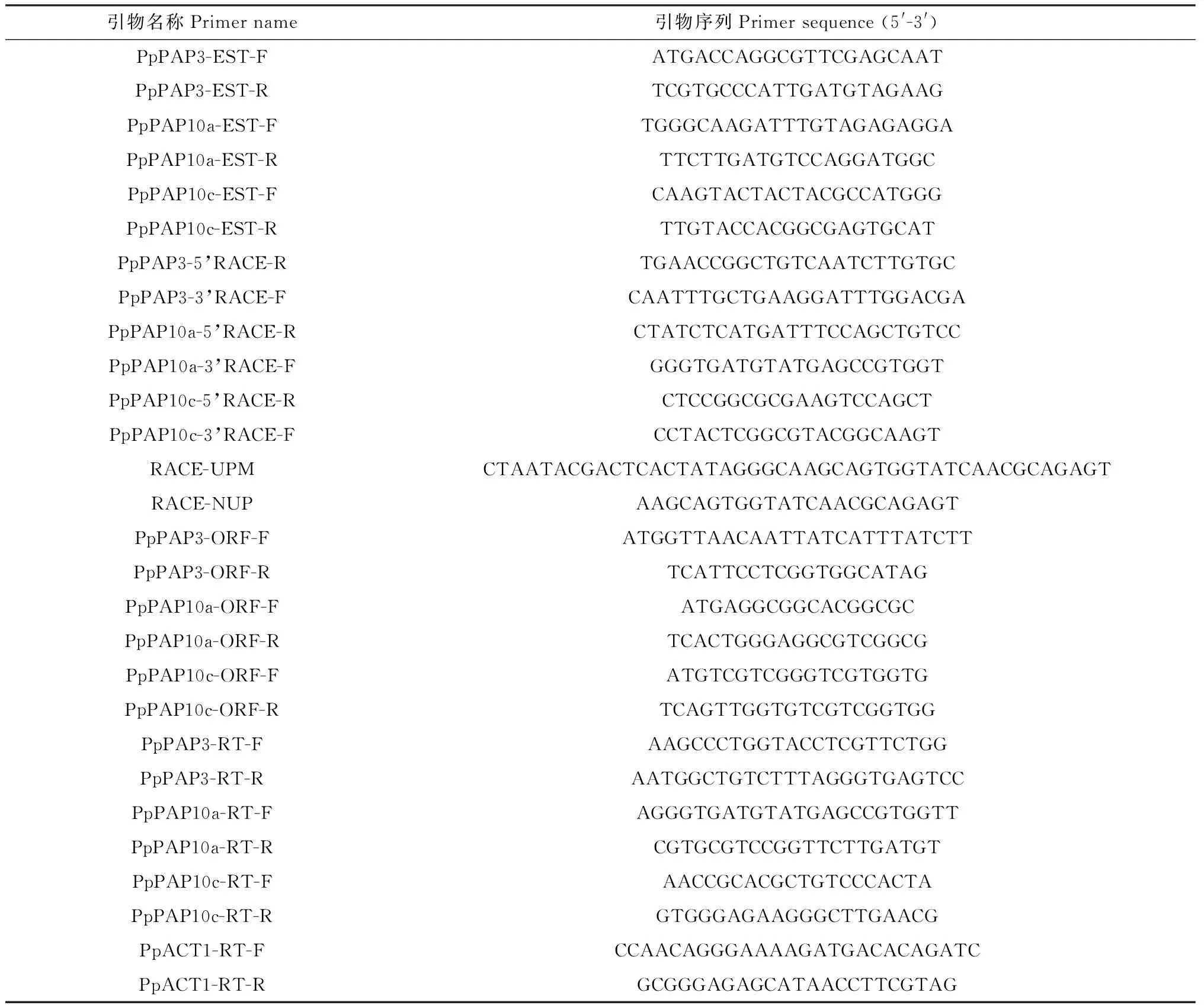
表1 本研究所用引物列表Table 1 A list of primers used in the study
1.2.4荧光定量PCR(qRT-PCR) 象草鲜样使用RNA-solve试剂盒(Omega Biotech,美国)提取总RNA。经DNase I处理后的RNA通过M-MLV逆转录酶(Promega,美国)合成cDNA第一链。qRT-PCR用SYBR Premix ExTaq II(Takara,日本)试剂盒在Rotor-Gene RG-3000实时荧光定量PCR仪(Corbett Research,澳大利亚)上进行。3个PpPAPs基因的qRT-PCR引物PpPAP3/10a/10c-RT-F/R见表1。以象草的肌动蛋白actin 1编码基因(PpACT1,NCBI accession number:MT784734)为内参看家基因。基因相对表达量参照Larionov等[19]的方法计算,即:基因相对表达量=目的基因表达量/内参看家基因表达量。
1.3 数据统计分析
本研究相关数据结果以平均值和标准误(SE)表示,数据单因素方差分析和相关性分析均通过SPSS 18.0软件(IBM-SPSS,美国)进行,分别采用多重比较LSD法和Pearson法。数据可视化作图采用Microsoft Excel 2013软件(Microsoft,美国)。
2 结果与分析
2.1 象草对有机磷的利用能力评价
水培条件下对象草进行-P,+ATP和+P处理,分别在5 d,10 d和15 d后收取样品测定植株干重和全磷含量。如图1A所示,不同磷源处理5 d 的植株干重无显著差异,但10 d和15 d后,+ATP处理下的植株干重比-P处理增加38.7%~73.4%,差异显著(P<0.05)。对于全磷含量,从5~15 d,+ATP处理与-P处理相比增加1.6~2.6倍,差异显著(P<0.05)(图1B)。但是,处理10 d和15 d后,+ATP处理下的植株干重与全磷含量均低于+P处理,差异显著(P<0.05)(图1)。以上结果表明,象草对外源有机磷源(+ATP)具有利用能力,但低于对无机可溶性磷源(+P)的利用能力。

图1 不同磷源对象草植株干重(A)与全磷含量(B)的影响Fig.1 Effects of different P sources on plant dry weight (A) and total P content (B) in elephant grass注:-P为不添加KH2PO4处理,+ATP为添加200 μmol·L-1 ATP处理,+P为添加600 μmol·L-1 KH2PO4处理。不同的小写字母表示在同一处理时间下,不同磷源处理之间差异显著(P<0.05),下同Note:-P indicated no KH2PO4added treatment,+ATP indicated 200 μmol·L-1 ATP added treatment,+P indicated 600 μmol·L-1 KH2PO4 added treatment. Different lowercase letters indicate significant differences among different P sources at the 0.05 level at the same treatment time,the same as below
2.2 不同磷源处理对象草根系ACP活性的影响
如图2A所示,处理5~15 d之后,与+P处理相比,-P和+ATP处理分别使根系胞内ACP活性分别提高1.1~2.7倍和0.9~2.0倍,差异显著(P<0.05)。而对于根系分泌ACP活性,不同磷源处理5 d时无显著差异(图2B);但处理10~15 d后,-P和+ATP处理的根系分泌ACP活性分别比+P处理分别提高2.2~5.1倍和1.9~2.7倍,差异显著(P<0.05)(图2B)。以上结果说明,象草在有效磷缺乏条件下(-P和+ATP处理),会增加根系ACP的合成与分泌。
2.3 象草PpPAPs基因的克隆及蛋白进化树分析
为克隆象草中与水稻OsPAP10a,OsPAP10c及菜豆PvPAP3的同源基因,分别根据这3个基因的保守结构域序列设计引物,通过PCR扩增获得了象草中3个同源基因的EST序列。随后通过RACE技术,获得了象草的这3个PpPAPs基因cDNA全长序列,开放阅读框(ORF)分别为1 083 bp,1 422 bp和1 389 bp(图3),并将它们分别命名为PpPAP3,PpPAP10a及PpPAP10c(NCBI accession number:MT784735,MT784736,MT784737)。PpPAP3,PpPAP10a和PpPAP10c预测的蛋白分子量分别为40.6 kDa,53.7 kDa和52.1 kDa;蛋白等电点分别为5.9,6.7和6.8。随后的蛋白进化树分析表明,植物的PAPs可被分为Ⅰ,Ⅱ和Ⅲ共3个亚家族,其中Ⅰ亚家族可进一步被分为Ⅰa-1,Ⅰa-2,Ⅰb-1和Ⅰb-2共4个子族;Ⅱ亚家族包含Ⅱa和Ⅱb两个子族;Ⅲ亚家族包含Ⅲa和Ⅲb两个子族(图4)。Ⅰ和Ⅱ亚家族为大分子量PAPs,而Ⅲ亚家族为小分子量PAPs。象草的PpPAP10a及PpPAP10c属于Ⅰa-2子族,分别与水稻的OsPAP10a和OsPAP10c同源;而PpPAP3属于Ⅲb子族,与拟南芥的AtPAP3同源(图4)。
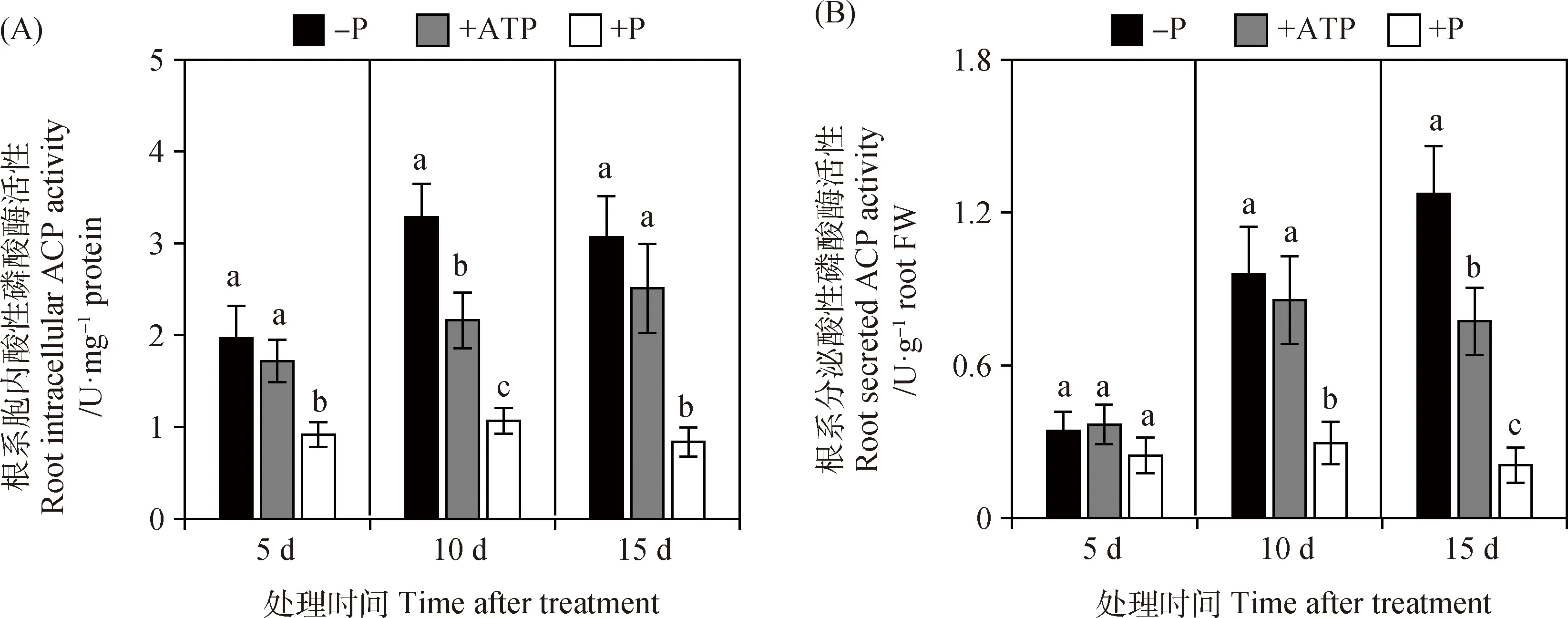
图2 象草在不同磷源处理下的根系胞内酸性磷酸酶(A)和根系分泌酸性磷酸酶(B)活性Fig.2 Root intracellular ACP activity (A) and root secreted ACP activity (B) of elephant grass at different P sources
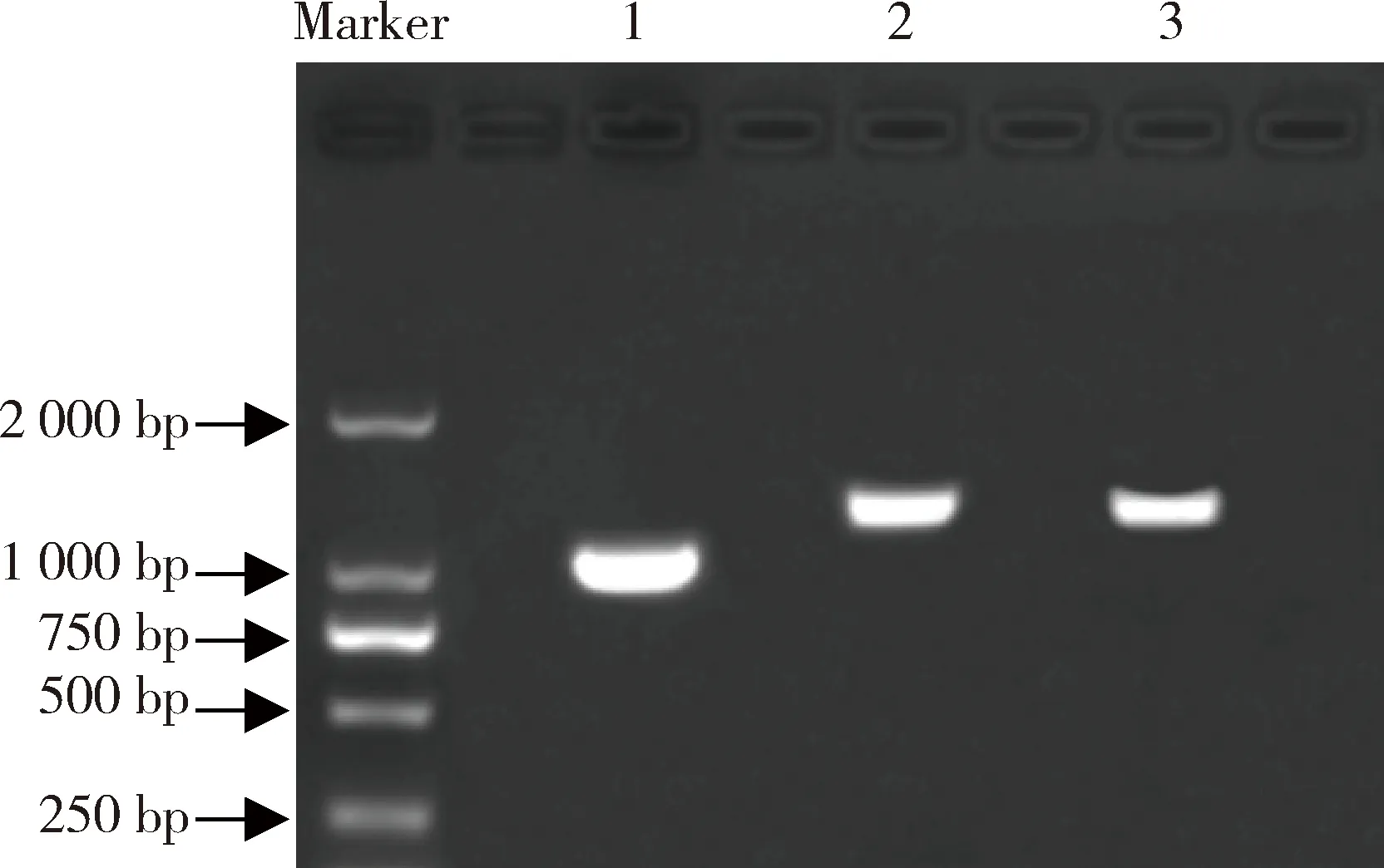
图3 象草PpPAPs全长cDNA的克隆Fig.3 Full length cloning of PpPAPs in elephant grass注:泳道1,PpPAP3的ORF扩增片段;泳道2,PpPAP10a的ORF扩增片段;泳道3,PpPAP10c的ORF扩增片段Note:lane 1,ORF amplified fragment of PpPAP3;lane 2,ORF amplified fragment of PpPAP10a;lane 3,ORF amplified fragment of PpPAP10c
2.4 象草PpPAPs基因在根系中的表达模式分析
利用qRT-PCR技术,分析不同磷源处理下象草根系中3个PpPAPs基因的表达模式。如图5A所示,与+P处理相比,-P和+ATP处理5~15 d,分别使PpPAP3在根系的相对表达量增加2.1~7.2倍和1.5~2.9倍,差异显著(P<0.05)。对于PpPAP10a,在-P和+ATP处理5~10 d的根系中,相对表达量比+P处理分别增加1.4~5.2倍和1.0~4.0倍,差异显著(P<0.05);但处理15 d时,PpPAP10a在不同磷源处理根系中的相对表达量无显著差异(图5B)。与PpPAP3和PpPAP10a不同,-P和+ATP处理5 d对PpPAP10c在根系中的相对表达量无影响;但处理10~15 d后,-P和+ATP处理分别使PpPAP10c在根系的相对表达量比+P处理提高1.9~9.0倍和1.7~21.3倍,差异显著(P<0.05)(图5C)。随后,对不同磷源处理下3个PpPAPs基因在象草根系中的表达量水平与根系ACP活性进行Pearson相关性分析,结果如图6所示,PpPAP3和PpPAP10a的相对表达量与根系胞内ACP和分泌ACP活性均显著正相关,但PpPAP10c的相对表达量与根系胞内ACP和分泌ACP活性均无显著相关性。以上结果表明,在有效磷缺乏条件下(-P或+ATP处理),象草根系会诱导PpPAPs基因增加表达,且PpPAP3和PpPAP10a基因的表达水平与根系ACP活性密切相关。
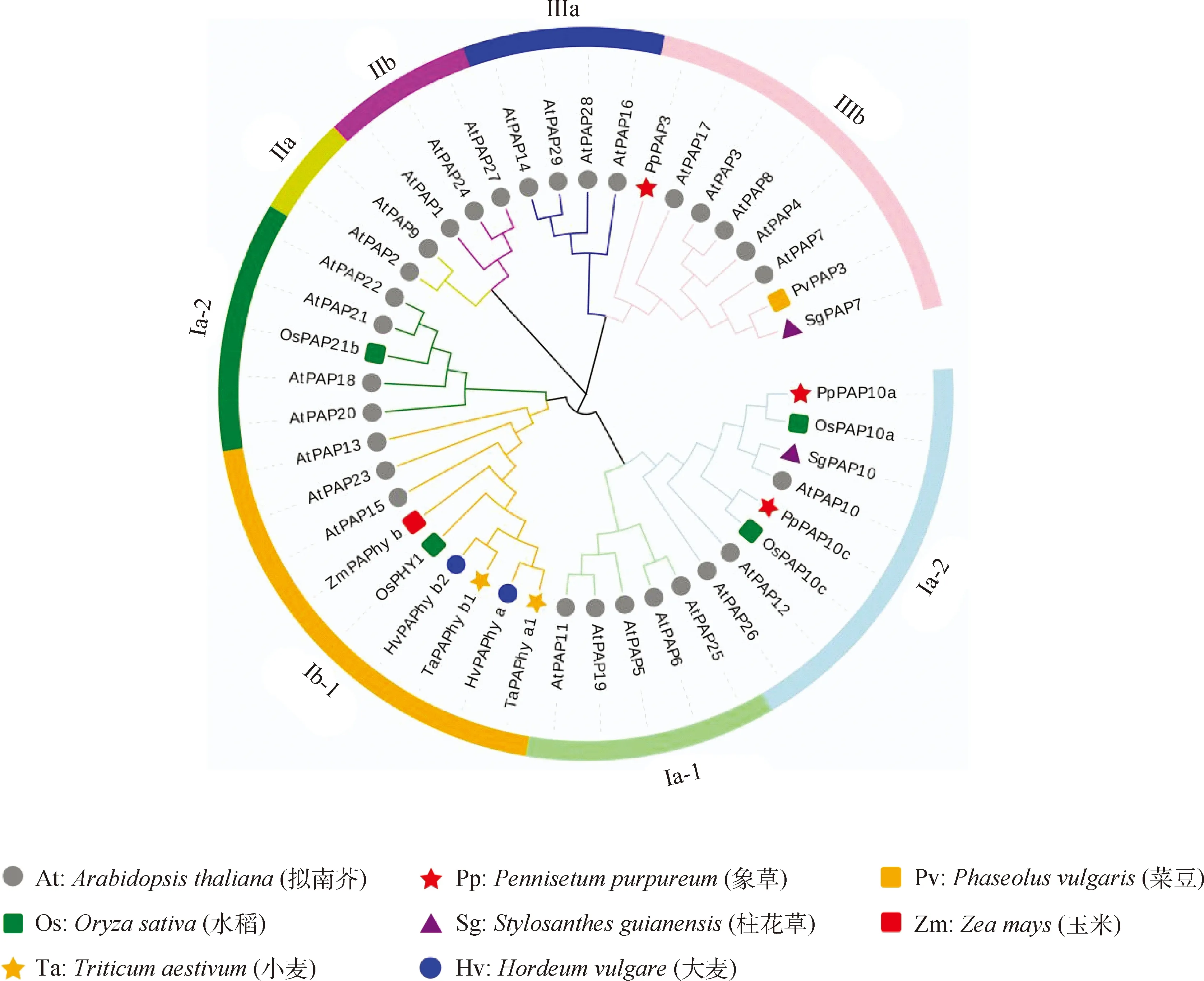
图4 象草紫色酸性磷酸酶的系统进化树分析Fig.4 Phylogenetic analysis of purple acid phosphatase in elephant grass注:PAP蛋白的前两个字母表示物种拉丁名简写Note:The first two letters of each PAP protein label represent the abbreviated species name
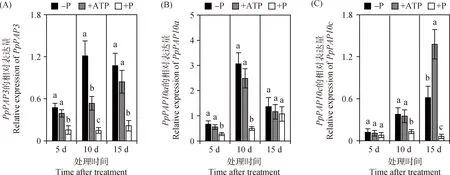
图5 不同磷源处理下象草根系PpPAP3(A),PpPAP10a(B)和PpPAP10c(C)的相对表达量Fig.5 Relative expression levels of PpPAP3 (A),PpPAP10a (B) and PpPAP10c (C) in roots of elephant grass under different P treatment
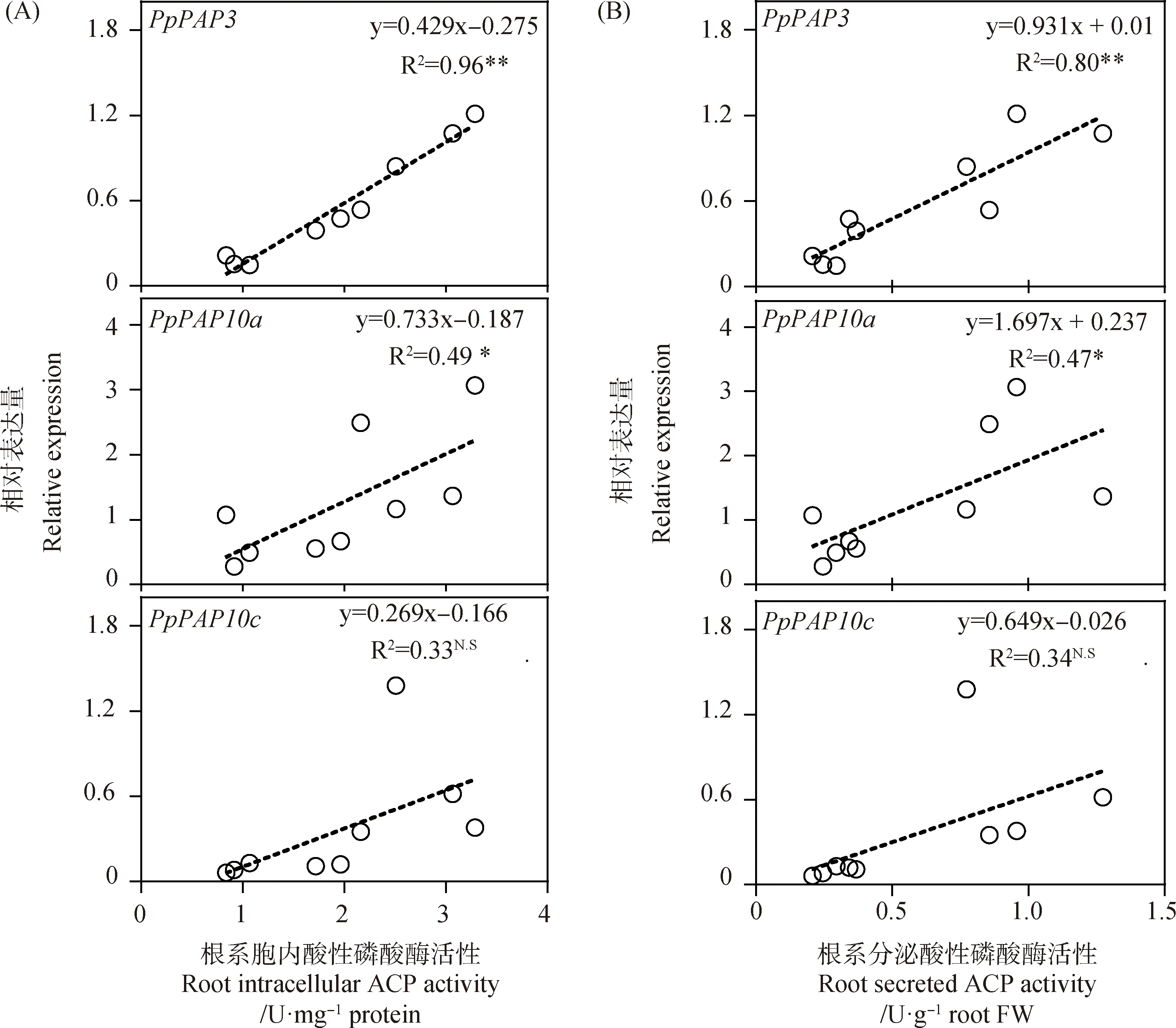
图6 象草根系PpPAPs相对表达量与胞内ACP(A)或分泌ACP(B)活性的相关性分析Fig.6 Correlation analysis between relative expressions of PpPAPs and intracellular ACP activity (A) or secreted ACP activity (B) in roots of elephant grass注:R表示相关系数。R2表示相关系数的平方值(决定系数)。*表示在P<0.05水平显著正相关,**表示在P < 0.01水平显著正相关,N.S.表示无显著相关性Note:R represents correlation coefficient. R2 is the square of the correlation coefficient (coefficient of determination). A single asterisk indicates significant positive correlation at the 0.05 level,two asterisks indicates significant positive correlation at the 0.01 level. N.S. indicates no significant correlation
3 讨论
有机磷是土壤磷库的重要组分,但其不能被根系直接吸收[20]。通过根系的ACP水解外源有机磷释放出Pi,是植物适应低磷胁迫的机制之一[21]。为评估象草对外源有机磷(ATP)是否具有利用能力,本研究首先通过水培试验分析不同磷源对象草生长的影响,结果发现,+ATP处理处理15 d后的象草生物量比-P处理高出70%以上(图1),说明象草能够活化利用外源ATP。
植物ACP可被分为胞内ACP和分泌型ACP两类[22]。胞内ACP指定位于细胞质及胞内细胞器中的ACP,主要参与植物细胞内贮存有机磷库的再活化利用。分泌型ACP主要是从植物根系分泌到根际或质外体的这类ACP,主要功能是参与植物对土壤有机磷的活化利用[23]。在单子叶作物(如水稻、玉米(Zeamays)、小麦(Triticumaestivum)等)和双子叶作物(如菜豆、大豆、白羽扇豆等)中均发现,低磷胁迫会诱导胞内ACP活性增加,并伴随着大量ACP从根系分泌到根际[24-25]。本研究中,ACP活性的定量测定发现,象草根系胞内和分泌的ACP活性在有效磷缺乏条件下(-P和+ATP处理)均显著提高(图2)。以上结果表明,增加ACP的合成与分泌是植物中普遍存在的适应低磷胁迫机制。
由于根系分泌ACP在土壤有机磷利用中的重要作用,在不同植物中,已有众多低磷胁迫诱导ACP被鉴定,其中绝大多数属于紫色酸性磷酸酶(PAP)家族[26]。但是,这些被证明参与植物适应低磷胁迫的PAP成员,主要来源于双子叶植物,如拟南芥AtPAP10,AtPAP12和AtPAP26参与对腺嘌呤核苷二磷酸(ADP)的活化利用[27];大豆GmPAP4和GmPAP14参与植酸磷的活化利用[28];菜豆PvPAP3参与ATP的活化利用[16];柱花草SgPAP7,SgPAP10和SgPAP26参与脱氧核糖核苷三磷酸(dNTP)的活化利用[29]。而对于单子叶植PAP基因在低磷胁迫适应中的功能研究,仅水稻3个OsPAPs(OsPAP10a/10c/21b)被证明参与ATP的活化利用[30]。为挖掘象草中潜在参与ATP利用的PAP成员,本研究从象草中分别克隆了与OsPAP10a,OsPAP10c和PvPAP3同源的3个PpPAPs基因(图3)。随后的表达模式分析表明,在有效磷缺乏条件下(-P或+ATP处理),这3个PpPAPs基因在象草根系不同程度的增强表达(图5)。其中,PpPAP3和PpPAP10a的相对表达量与根系ACP活性显著正相关关系(图6)。这些结果表明,PpPAPs可能参与了象草对ATP的利用,但有待进一步的基因功能分析试验来验证。
4 结论
本研究证明了象草对外源ATP具有利用能力,并从象草中首次克隆了3个受低磷胁迫上调表达的PpPAPs基因。研究结果将为解析象草磷素高效利用机理提供一定基础。

