基于纳米材料的临床检验与诊断技术研究进展
沈 俊,陈 莹,王 鑫,张林艳,顾 兵,裴 兵,杨 欢
1徐州医科大学医学技术学院,江苏 徐州 221004;2苏州工业园区疾病防治中心,江苏 苏州 215100;3罗氏诊断产品(上海)有限公司专业和分子诊断部,上海 200131;4宿迁市第一人民医院临床检验科,江苏 宿迁 223800
随着医疗卫生事业的发展,临床医学实践中各种疾病的早期诊断对体外诊断技术的灵敏度、检测限、检测速度等性能指标提出了越来越高的要求,这使得许多传统的、常规的体外诊断技术逐渐不能满足疾病诊断的需要。同时,随着“一带一路”建设的展开和对外开放的进一步加深,我国防控输入性疾病[1]和对外医疗援助[2]的难度与需求也空前增高,不同的应用环境也对实验诊断技术的分析速度、检测成本、操作难度等提出了各种各样的要求。近年来,随着纳米技术的发展,纳米材料在体外诊断领域的应用也引起了越来越多的关注和研究。这些基于纳米材料的检测技术常常具有高灵敏度、高特异度、检测速度快等特点,因而在早期诊断、快速诊断、及时检验(point-of-care testing,POCT)等方面具有极大的潜力。此前,李万万等[3]和张苏琳等[4]分别对基于纳米材料的体外诊断技术进行了介绍,其中前者侧重对纳米材料的介绍;后者侧重于医学研究。本文将对应用于临床检验与诊断领域的常见纳米材料,以及近年来基于纳米材料的蛋白、核酸检测技术等方面的最新研究进展作一综述。
1 常见纳米材料
纳米材料是指在三维空间中至少有一维处于纳米尺寸(0.1~100 nm),或由它们作为基本单元构成的材料,具有独特的磁性、光学、热力学性质等尺寸依赖性理化性质。随着纳米技术的发展,纳米材料在体外诊断领域的应用也引起了越来越多的关注。在表面修饰抗体、探针或其他生物识别元件后,可使纳米材料在自身特性的基础上获得对特定检测对象的靶向性。在众多纳米材料中,磁性纳米粒(magnetic nanoparticle,MNP)、量子点(guantum dot,QD)和纳米金粒子(gold nanoparticles,AuNP)在体外诊断领域的研究较为常见。
1.1 MNP
MNP是一种具有超顺磁性的纳米材料,即当外磁场存在时,MNP具有磁性,而当外磁场撤离时磁性消失。在MNP上连接单克隆抗体、核酸探针等,靶向捕获目标物质后,通过外加磁场,使目标物质被吸附而滞留于磁场中,而使其他物质被分离。通过这种磁分离技术,可达到在短时间内完成分离和富集的目的,从而提高检出率。张俊仙等[5]用抗酸染色、普通PCR和磁纳米捕获-PCR方法检测确诊肺结核病患者痰标本中的结核分枝杆菌,结果显示由于结核分枝杆菌得到浓缩、聚集和纯化,除去了不利于PCR扩增的抑制因子,磁纳米捕获-PCR技术的检测阳性率远高于抗酸染色检查(27.0%)和普通PCR检测(47.4%),达到了82.9%。此外,徐源[6]、黄伟等[7]团队也利用MNP的富集纯化能力,分别构建了对外周血循环肿瘤细胞(circulating tumor cells,CTC)和手足口病肠道病毒的检测方法,均具有较为可靠的诊断性能。
1.2 QD
荧光标记技术是指将能发射荧光的物质通过共价结合或物理吸附等方式标记于所研究分子的某个基团上,用它的荧光特性来反映研究对象的信息。面世以来,荧光标记技术以其独特的优势和特性在生物医学领域获得了极为广泛的应用。目前常用的传统荧光染料主要有荧光素染料、罗丹明类染料、菁染料等,在不同的检测方法中发挥着重要作用[8],但与此同时,这些染料也存在着光淬灭率高、对pH值敏感、发射光谱宽等问题。
QD 又称胶体半导体纳米晶,是一种具有独特光物理性质的半导体纳米晶,自20 世纪80 年代发现以来,迅速成为纳米科学和纳米技术的前沿[9]。QD 具有抗光漂白性强、激发光谱宽、发射光谱窄、不易化学降解、荧光寿命长、发射光的颜色随粒径变化等特点[10],可突破传统染料的局限性,实现在同一激发波长下对不同物质的检测。QD 可用于检测各种抗原物质、病原体和生物分子,也可用于对组织、细胞进行免疫标记等[11],在分子生物学、细胞生物学、基因组学、蛋白质组学、药物筛选、生物大分子相互作用等研究中有极大的应用前景[12]。
Suzuki 等[10]用QD 和抗体开发了一种量子点连接免疫吸附法(QLISA),并基于这种方法建立了一种微量IL-6的检测方法,可用于0.05 ng/mL 级别IL-6的检测。Zhou等[13]对一种基于QD的高灵敏度肌钙蛋白的检测方法进行了评估,该方法将1~2 h 的检测时长缩短至12 min,且使用全血标本,保证了对急性心肌梗死(acute myocardial infarction,AMI)较高的诊断效率,更适用于POCT的检测和快速诊断。
1.3 AuNP
AuNP 作为人类最早认识并应用的纳米材料之一,在整个纳米材料研究领域中占据着重要地位。AuNP具有易于表面修饰、较高的生物相容性、独特的光学特性等特点[14],应用于诸多体外诊断的检测体系中,如在生物条形码技术(bio-barcode assay,BCA)中,利用AuNP 比表面积大、易于表面修饰等特性,在AuNP上修饰了大量单链DNA,这是实现该技术“信号扩增”的关键[15-16];借助AuNP的纳米材料表面能量转移(nanometal surface energy transfer,NSET)特性,Yuan等[17]构建了一种能对尿液标本中精胺进行痕量检测的方法,证明了其能成为有机染料猝灭剂的替代品,可以为各种生物分析物构建可激活探针;此外,也有研究者发现,在PCR反应体系中加入适量的AuNP,可减少引物和单链DNA 模板之间的错配,提高PCR反应的特异性[18]。
2 纳米材料在蛋白质检测分析中的应用
2.1 邻位连接技术
邻位连接技术(proximity ligation assay,PLA)是一种将蛋白定量检测转化为核酸定量检测的技术,是用于检测目标蛋白或蛋白之间相互作用的特殊免疫分析方法。在PLA技术中,一对可识别目标蛋白不同抗原表位的抗体通过共价交联或者生物素-亲和素分别与一条寡核苷酸探针(单链DNA)相连。这对抗体结合在目标蛋白的相邻表位后,加入一段可分别与前述两个探针互补的寡聚脱氧核苷酸(connector oligonucleotides),在连接酶的作用下,3段单链DNA形成的杂交分子被连接形成一条新的DNA片段,随即通过荧光定量PCR技术对DNA进行定量,从而实现对目标蛋白的定量检测[19]。2007年,Schallmeiner 等[20]报道了一种3PLA 技术,提升了敏感性和检测范围;之后在2013 年,Nong 等[21]介绍了一种具有高特异性、样本量变化范围广(从几微升到几毫升)的固相PLA技术。基于纳米材料的邻位连接技术(nanoparticle-based proximity ligation assay,NP-PLA)是由Chen等[22]在PLA及其衍生技术基础上开发的超灵敏检测技术。Chen等[22]在PLA中引入纳米粒子,不再将核酸探针与抗体耦联,而是将纳米粒子耦联在抗体上后,将生物素化的核酸探针结合在纳米粒子表面空余的亲和素位点上,由此,NP-PLA 兼具了3PLA 和固相PLA 的优点。随后,Chen 等[22]使用这一技术完成了对人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)的检测和定量,其检测限低至2.6 fmol/L,几乎是ELISA 技术的1 000倍。
2.2 AuNP作标记物的蛋白检测技术
AuNP 是一种无毒、易于表面修饰、具有较高生物相容性和独特光学特性的纳米材料[14]。AuNP 由于其局部表面等离子共振(surface plasmon resonance,SPR)、表面增强拉曼散射(surface enhancement of Raman scattering,SERS)和荧光共振能量转移(Förster resonance energy transfer,FRET)等独特的物理和光学性质被应用于诸多领域[23]。在此讨论AuNP在蛋白质检测中的应用。
金纳米簇(gold nanoclusters,AuNC)是一种小于2 nm 的新型荧光材料,由2~100 个金原子组成。根据组成和大小的不同,AuNC 的发射光谱可在紫外区到近红外区改变,利用AuNC的这一特性,可选择背景干扰小的波长[23]。由于AuNC 易于聚集,因此适当的配体对于稳定其荧光和大小必不可少,常用的配体有牛血清白蛋白(bovine serum albumin,BSA)等[24-25]。将AuNC 作为荧光基团,选用某种特定的物质作为淬灭基团,通过FERT 淬灭其荧光;当两者形成的这一体系遇到目标物质时,AuNC 与淬灭基团分离,淬灭作用消失而使荧光恢复,以实现目标物质的检测(图1)[24-27]。根据AuNC 的这种性质,Xu 等[24]设计并制备了一种基于AuNC 和AuNP 的新型荧光探针,用于尿液L-半胱氨酸的检测。Menon 等[25]使用BSA-AuNC 标记胰岛素抗体,构建了一种检出限为1.1×10-10g/mL 的胰岛素检测方法。
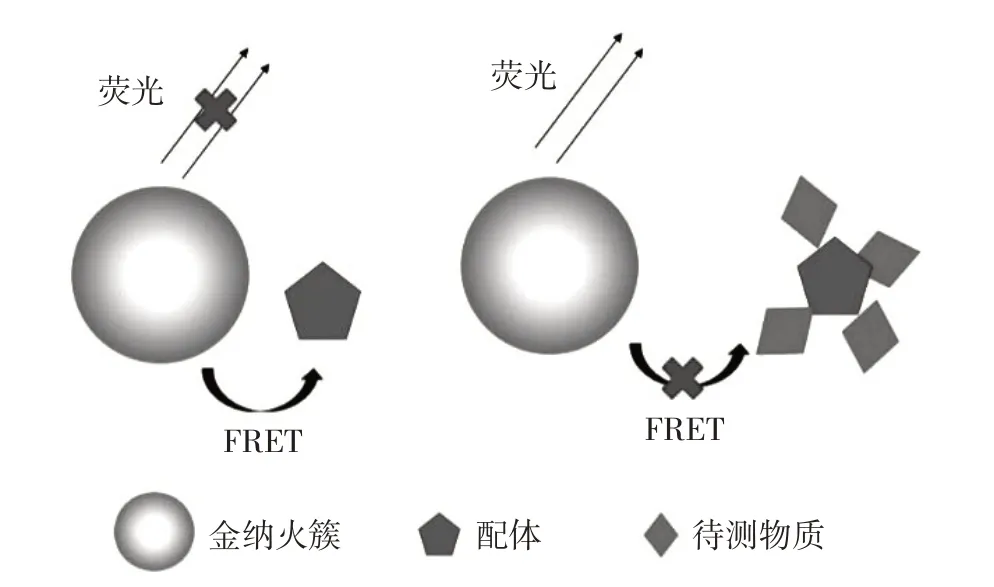
图1 基于AuNC的检测技术模式图Figure 1 Basic principles of protein detection using AuNC
NSET 是一种类似于FRET 的现象。AuNP 已被证明是一种高效的能量受体,当AuNP 和荧光基团接近到一定范围时,荧光基团的能量即转移至AuNP 表面,发生荧光淬灭。两者不同之处在于FRET 有着严格的距离(100Å,1Å=10-10m)和方向限制,而NSET的偶极-纳米表面传递距离可以在更长的距离上具有更高的淬灭效率,因此,AuNP有机会成为有机染料猝灭剂的替代品,为各种生物分析物构建可激活的探针[17,23]。Yuan等[17]利用金纳米棒、四羧基苯基卟啉和小牛胸腺DNA(ctDNA)的相互作用开发了一种基于NSET的恶性肿瘤生物标志物精胺的检测方法,实现了对尿液标本中精胺的痕量检测[17]。
在科学研究和许多疾病的早期诊断和治疗中,实现检测超低水平的蛋白质标志物至关重要。在这些方法中,NP-PLA 和BCA[15](在后文中详细介绍)将不可扩增的蛋白质检测转化为核酸检测,实现了蛋白质的高灵敏度检测。根据反应体系中所用的抗体不同,NP-PLA 和BCA 的检测对象非常广泛,但同时意味着其特异性受所用抗体特异性的影响;AuNP 作标记物的蛋白检测技术,利用AuNP 的FERT或NSET特性,构建了类似于实时荧光PCR中荧光探针的荧光信号系统,并以一定线性范围内荧光强度的增量[24-25]或减量[17]反映物质间的相互作用,从而实现了超低水平的蛋白质检测。
3 纳米材料在核酸检测分析中的应用
3.1 纳米层析技术
纳米层析试纸条是一类基于横向流动检测(lateral flow assay,LFA)可用于对PCR 扩增[28-29]、杂交链反应(hybridization chain reaction,HCR)[30]、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[31]等扩增获得的核酸产物进行快速验证的装置。相比传统的电泳、成像等方法,使用基于纳米层析试纸条的纳米层析技术对核酸产物进行验证不需要昂贵的仪器,操作简便,且具有耗时短、特异性强等优点,适合在设备条件有限的地区应用,同时也可以满足POCT的需求[31-32]。
Ying 等[30]使用纳米层析试纸条检测通过杂交链反应获得的扩增产物复合体,开发了一种针对沙门菌属16S rRNA 的可视化检测方法(图2),其检测限为3×103CFU/mL。
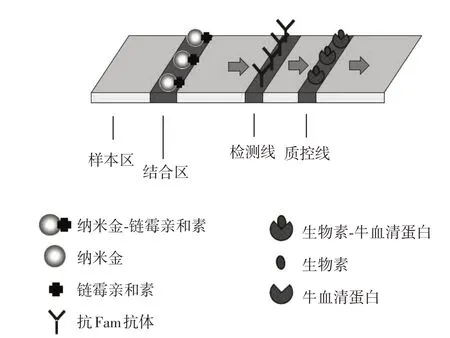
图2 纳米层析试纸条[30]Figure 2 lateral flow nucleic acid test strips[30]
3.2 纳米材料辅助PCR技术
自聚合酶链式反应(PCR 技术)出现以来,人类对DNA 和RNA 的检测和分析能力不断进步,现已成为诊断疾病的一项重要手段。PCR 技术是现代生物学和体外诊断领域中最基本且最受欢迎的技术之一,可将极微量的DNA 扩增数百万倍,使其达到可检测的水平,被广泛应用于诸多领域。自该技术诞生以来,大量研究人员从试剂、仪器和PCR 程序层面对其进行了改进和优化,大大提高了扩增效率,并逐渐发展出巢式PCR、多重PCR、RT-PCR、荧光定量PCR、数字PCR 等适用于不同目的、高灵敏度的方法[33]。但与敏感性的提高相比,PCR 技术的特异性仍未达到标准,并在对富含GC片段、DNA长片段扩增分析中存在一定问题[18],尽管人们发现在PCR体系中加入如二甲基亚砜[34]、BSA[34]、单链结合蛋白(single strand DNA-binding protein,SSB)[35]等作为增强剂(enhencer)可促进PCR 扩增,但总体效果仍不甚理想。
随着纳米技术在生命科学领域的逐步渗透,纳米材料辅助PCR(nanoPCR)技术受到了广泛关注。现有研究表明,纳米粒子在PCR反应体系中的作用主要体现在3个方面。①与DNA 分子结合:纳米粒子(如AuNP、碳纳米管等)可与单链DNA结合,从而减少引物和单链DNA模板之间的错配。此外,一些纳米粒子也可以促进PCR 反应过程中DNA 模板的双链解离,降低解链温度[18,36-37]。②与DNA 聚合酶相互作用:一些纳米粒子可增强DNA 聚合酶的活性,但过高浓度的纳米粒子会对DNA聚合酶产生抑制作用,这种抑制作用在一定程度上可以通过增加DNA聚合酶使用量来抵消[18,37]。③纳米粒子具有优良的热传导性,可使PCR反应体系更快地达到设定温度,提高扩增效率,并使引物和模板之间更高效地配对[18,36]。
有研究报道了一种对食脑阿米巴原虫的NanoPCR 检测方法,他们将石墨烯氧化物、氧化铜和氧化铝3种纳米材料加入普通PCR体系中,实现了对几种阿米巴的快速诊断,且核酸扩增产物的电泳条带灰度值为不加纳米粒子对照组的1.25~2倍,可见其扩增产率增加[36]。Yang 等[37]在PCR 体系中加入不同浓度的AuNP,分别使用Pfu聚合酶和Taq聚合酶成功扩增了富含鸟嘌呤(G)和胞嘧啶(C)的片段,为基因组中富GC片段的扩增提供了一种可行的方法。
3.3 纳米孔测序技术
上世纪70年代中期,以双脱氧链终止法(Sanger法)[39]为代表的第1 代测序技术的出现开启了人类对基因组探索的历程。1990—2003 年的人类基因组计划(human genome project,HGP)直接推动了测序技术的发展,此后,测序技术发展迅猛,第2代、第3代测序技术应运而生。
纳米孔是一种纳米大小的孔,由生物分子自组装或在固体基质上进行物理钻孔形成,可分为生物纳米孔、固态纳米孔以及由两者结合而成的复合纳米孔3类。纳米孔测序的基本原理是将电流应用于纳米级的分子孔,然后使遗传物质从中通过,由于构成遗传物质的碱基的分子结构和体积存在差异,不同碱基穿过纳米孔时引起不同的电流变化,由此即可得出所测DNA 或RNA 的序列信息(图3)[40-41]。作为一种高通量、高读长、实时数据输出[42]的单分子测序技术,纳米孔测序技术被认为是第3 代测序技术的一个重要发展方向。此外,纳米孔测序技术还因具有无需各种酶的参与、无需生物分子修饰标记或表面固定化技术、低成本等优势[40],而在美国国立卫生研究院(National Institutes of Health,NIH)的“1 000美元基因组计划”中脱颖而出。目前,由牛津纳米孔技术公司(Oxford Nanopore Technology,ONT)开发的几代产品已开始应用于体外诊断和公共卫生等领域。
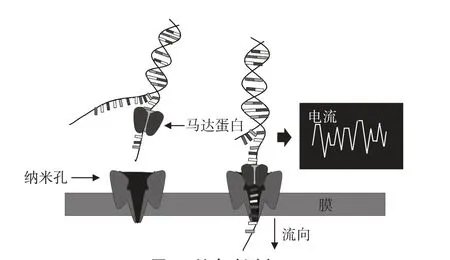
图3 纳米孔测序Figure 3 Nanopore sequencing
此前,纳米孔测序技术因为错误率相对较高、需要多次处理消除测序错误等问题而影响了其对于第2 代测序技术(next-generation sequencing technology,NGS)的竞争力[41,43-44],但随着该测序技术的成熟完善带来的测序准确率的提高,其高通量、高读长、实时数据输出以及可以进行直接RNA测序的优势逐渐得以体现。ORSINI 等[45]开发了一种基于纳米孔测序的快速检测BCR-ABL1 融合基因的方法,这对急性白血病等急需得出诊断结果的疾病诊断有极大意义。使用纳米孔测序技术以原生RNA形式对流感病毒基因组进行直接测序,颠覆了以往先用逆转录酶合成DNA 后测序的流程,避免了CG偏倚,同时保留了基因组中的碱基修饰信息,在相关领域研究中具有重大价值[41]。除此以外也有利用纳米孔测序技术在西非疫区实验室对埃博拉病毒进行测序[46]和在7~12.5 h内得到结核分枝杆菌鉴定全基因组测序的结果,并借此得出种属鉴定和耐药性推测的报道[47]。在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)大流行期间,纳米孔测序方法在病毒基因组测序[48]、进一步开发和完善检测技术以应对病毒变异[49-50]的过程中发挥着重要作用。
目前,实时荧光PCR技术是核酸检测技术中的主流方法,具有极高的普及率。因此,在评价核酸检测技术时,往往需要以该技术为参照。在上述核酸检测技术中,纳米层析技术作为一种单纯的核酸产物的检测手段,实验步骤必然会多于集扩增、产物检测于一体的实时荧光PCR方法,因此应选择诸如LAMP 等设备要求不高的核酸扩增方法,开发适用于现场的即时检验方法;PCR 方法普遍具有升降温过程长、耗时、具有一定假阴性率的缺点,在体系中加入纳米粒子后扩增效率和敏感性得到提升;纳米孔测序技术作为一种高通量、高读长的测序技术,已在多个研究和应用领域中发挥作用,是核酸检测技术的强力补充。
4 纳米材料在体外检测领域中的其他应用
4.1 纳米生物传感器
生物传感器是将生物活性材料与适当的转导元件组合在一起用来选择性并且可逆性地检测各种类型样品中的生物化学物质浓度或活性的装置[51],主要由识别元件和理化转换器构成。生物传感器常可分为光学传感器、电化学传感器和压电传感器,具有响应迅速、灵敏度高、可实现实时和多重检测、使用便捷、检测成本低、体积小等优点[52],对海关和传染病暴发现场的疾病防控以及相对落后国家或地区的疾病诊断具有重要意义。纳米生物传感器是将纳米材料(如金纳米簇[17]、金纳米线[53]、碳量子点[54]等)与生物传感器结合制成的复杂仪器,综合应用光、电、声、色等各种先进检测技术,以实现对核酸、蛋白质、酶活性、微生物等[53-56]乃至重金属离子等环境有毒物质[57]进行检测的复杂仪器,对临床检测、食品安全、环境监测、国家安全等多个领域产生影响。Aghili 等[53]研发了一种用于检测血清中帕金森病(Parkinson’s disease,PD)生物标志物miR-195 的DNA 杂交电化学纳米生物传感器(图4),使用纳米材料增加电极的有效表面积,大大提高了检测的灵敏度,可用于PD的早期诊断。Srivastava等[58]报道了一种基于表面增强拉曼光谱的纳米生物传感器,用于大肠埃希菌的检测,具有高度特异性,实验证实其具有较低的检测限(1.5×102CFU/mL,可达单个细菌的浓度水平)。
4.2 BCA技术
图4 基于DNA杂交的电化学纳米生物传感器[53]Figure 4 Electrochemical nanobiosensor based on DNA hybridization[53]
BCA 技术是本世纪初出现的一项以“信号放大”为基础的新型分子诊断技术。该技术的检测体系中包含AuNP和MNP两种纳米粒子,其中,表面带有单克隆抗体(或单链DNA)的MNP 主要用于被检测物质的分离,表面带有多克隆抗体(或单链DNA)及大量“条码DNA”的AuNP 用于捕获被检测物质。当目标物质存在时,两种纳米颗粒与被目标物质形成“AuNP-目标物-MNP”三明治结构(图5)。利用磁场分离这一“三明治”结构后,使用一定方法释放生物条形码DNA,并进行后续检测。2003年首次报道用该技术成功进行了前列腺特异性抗原(prostate specific antigen,PSA)的检测,由于AuNP 表面结合有大量的生物条形码DNA,可将检测灵敏度提高2~3个数量级;Thaxton 等[59]使用BCA技术成功对前列腺癌根治性前列腺切除术后的男性血清中常规方法无法检出的低浓度PSA 进行了检测,从而实现了对前列腺癌复发状况的预测;Yin 等[60]也使用BCA技术对蓝舌病毒外核蛋白VP7进行了特异性检测,其检测限为0.1 fg/mL。其巧妙之处在于将无法扩增的蛋白检测转化为有多种扩增和检测手段的核酸检测,从而为蛋白质检测提供了新思路。
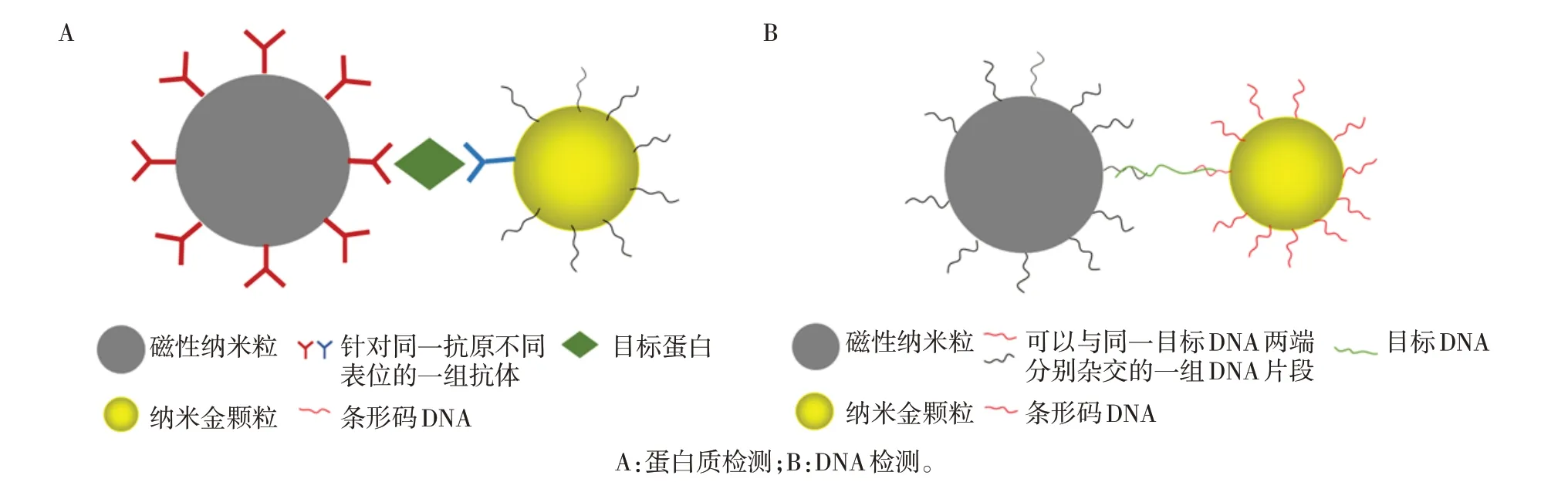
图5 BCA在蛋白质检测[15]和DNA检测[16]中所形成的三明治结构Figure 5 Sandwich structures formed in protein[15]and DNA[16]detection using BCA
除在蛋白质检测中的应用外,BCA 技术还在2007 年被报道用于枯草芽孢杆菌双链DNA 的检测[16];Aminia等[61]用针对铜绿假单胞菌外毒素A基因的两种核酸探针、AuNP 和MNP,构建了外毒素A基因片段的检测体系。用磁场分离出“AuNP-目标核酸分子-MNP”的三明治结构后,他们用二硫苏糖醇溶液释放结合在AuNP 上的DNA 条形码并用荧光分光光度法进行检测,其检测限低至1.2 ng/mL,且具有检测速度快、选择性好、线性范围宽等优点。此外,BCA 技术也衍生出一些变体。Lin 等[62]开发了一种基于纳米酶的生物条码荧光检测技术,他们利用铂-金纳米粒(Pt-AuNP)的过氧化物酶活性催化amplex red(AR)产生可检测的荧光信号,实现了对艾滋病病毒和乙肝病毒DNA 的同时检测。此类方法相比基于PCR 的核酸检测技术更适用于POCT。
5 小结和展望
纳米科学是20世纪80年代末发展起来的新兴学科,与信息科学、生命科学并列为21 世纪最有前途的三大新技术科学领域,其应用已涉及医疗卫生、感染防控、食品工程、废水处理等大量领域。目前,在临床体外诊断检测领域,特性各异的纳米材料已成为研究者们优化现有方法、开发新检测技术的重要元件。基于纳米材料的检测方法对相关标志物(PSA、HCG等)检测中表现出的高特异性、低检测限(表1),使其在某些疾病,特别是前列腺癌等恶性肿瘤的早期诊断和预后评估中具有较大的应用价值[22,59]。在病原体检测方面,将纳米材料加入PCR反应体系后,可提高PCR反应的灵敏性和特异性[38];在临床上遇到难以分离鉴定的病原体时,可将测序技术作为最后手段使用,但目前常用的二代测序技术的速度、成本等因素还不能完全满足临床感染快速诊断的需求,而纳米孔测序虽然仍在不断改进完善中,却因其低成本、使用简单、高读长、设备和环境要求低等特性,在病原体鉴定、白血病等基因突变引起的急性病快速诊断中显示出独特优势[45,47]。在荧光检测中,以QD为主的纳米材料具有抗光漂白性强、激发光谱宽、发射光谱窄等特点,且可通过调整粒径大小改变发射光波长避开易受到干扰的波段,从而使得整个检测体系更具抗干扰性。得益于QD 的这一特性,开发者和临床工作者们可以在实际应用中尝试使用全血标本代替血清,简化检测流程,使之更加适合POCT,且缩短了检验周期[13,63],更好地符合临床需要。由此可预见,纳米技术与临床检验诊断的结合终将给体外诊断技术和医学检验行业带来一场变革。
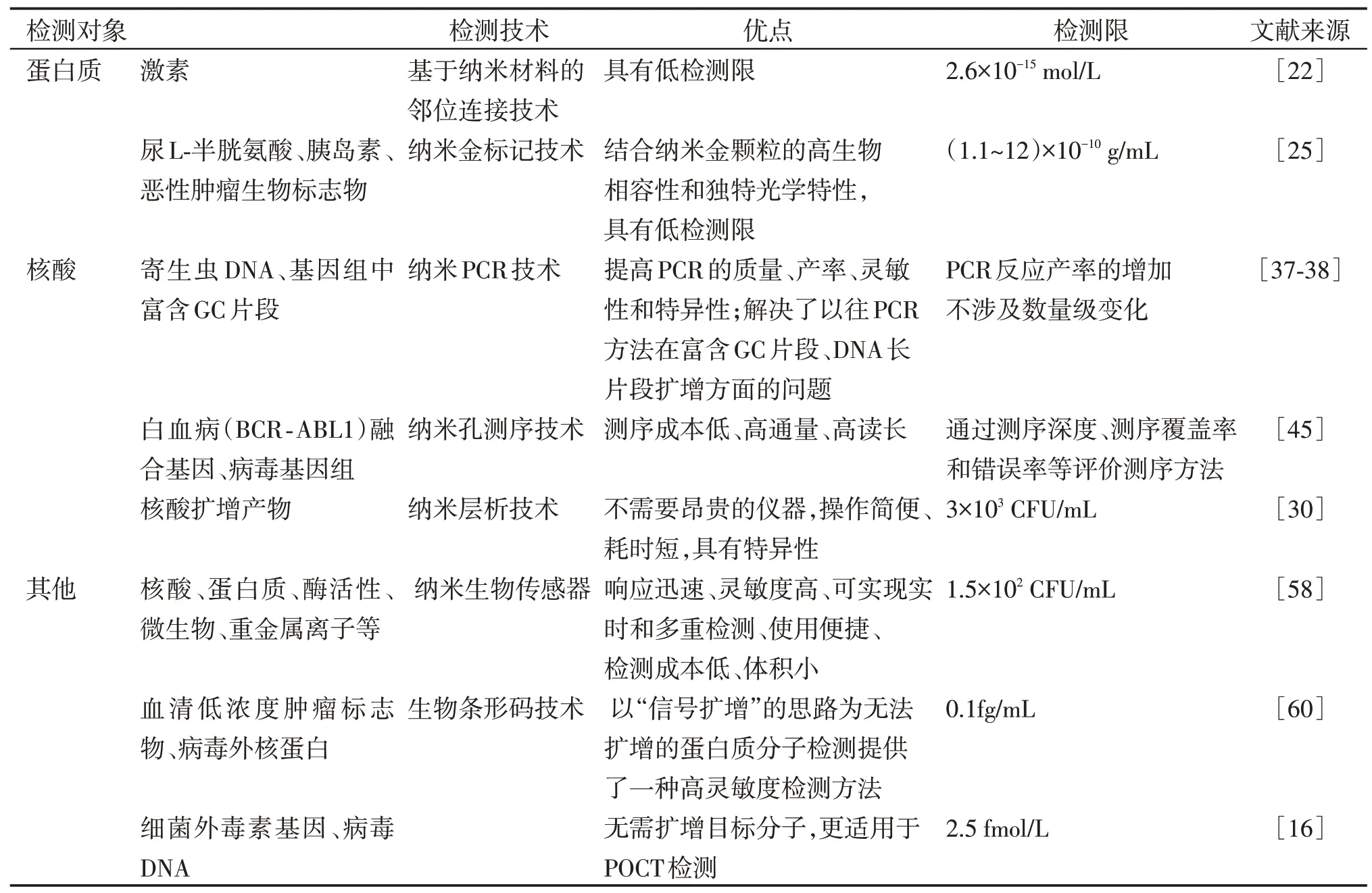
表1 各种基于纳米材料的体外诊断技术对比Table 1 Comparison of in-vitro diagnostics based nanomaterials
值得注意的是,基于纳米材料的检验方法常常需要对纳米材料进行表征,开发可重复程序,以保证检测的准确性和可重复性[64],这在临床实践中可行性较低。因此,大部分纳米检测技术进入临床应用仍需依赖体外诊断企业的投入和纳米技术产业的发展;同时,尽管该类技术有众多优势,但在进入临床应用之前,还需要一定人力物力的投入,培养相应的技术人员,这也使得基于纳米材料的检验技术距离临床大规模应用尚有距离。而在生产、使用、废弃过程中进入环境的纳米材料,可造成一定的生态效应和人群暴露。根据国内外纳米毒理学的研究,纳米材料可以通过引起人体氧化应激反应和炎症反应、诱导或抑制细胞自噬、在生理环境中吸附一系列蛋白质形成“蛋白冠”等方式,对细胞和机体产生毒性作用[65-66]。因此,在应用纳米材料的同时,也应加快制定完善的纳米技术标准,避免走上“先污染后治理”的老路。
总之,基于纳米材料的体外诊断技术由于灵敏度高、检测快速等特点,具有临床应用的巨大潜力。与此同时,由于传统检测技术仍能应对日常工作中的大部分需求,以及纳米检验技术本身存在的商品化程度不足、产业链不成熟、自身技术不完善、需要相应技术人员等原因,该类技术进入临床应用仍面临一定阻碍。可以预见的是,随着医学检验学和纳米科学的发展,以及体外诊断公司和区域检验中心的兴起,未来这类技术将不断进入临床应用,并扬长避短地满足不同临床需要,更好地服务临床医学乃至全人类。

