南京地区HIV/AIDS患者分枝杆菌感染分布及耐药性分析
王娟娟,施旭东,肖园园,张觅,隋俊,黄菁
(南京中医药大学附属南京医院/南京市第二医院检验科,南京 210000)
艾滋病,即获得性免疫缺陷综合征(AIDS),是由HIV感染引起的危害性极大的传染病[1]。HIV感染可导致CD4+T淋巴细胞进行性减少,CD4+/CD8+T淋巴细胞比值倒置,细胞免疫功能受损,易并发严重感染[2]。结核病及非结核分枝杆菌(non-tuberculous mycobacterium, NTM)感染是其常见的机会性感染之一。据统计,2018年我国结核病新发患者人数约86.6万人,其中有1.8万例新发HIV相关结核,HIV阳性人群中约有2 400人死于结核病[3]。机会性感染是AIDS相关发病率和病死率的主要驱动因素,对其早期诊断和治疗可显著降低HIV/AIDS患者的病死率并提升生存质量[4]。本研究通过回顾性分析南京地区HIV/AIDS患者分枝杆菌感染分布及耐药情况,为临床诊断和个体化治疗提供依据。
1 资料与方法
1.1一般资料 以2017年1月至2020年7月南京市第二医院感染科收治的1 012例HIV/AIDS患者为研究对象,其中,男795例,女217例,年龄(43.7±14.1)岁。所有HIV/AIDS患者均符合《艾滋病诊疗指南2018版》[1]。回顾性收集所有患者CD4+T淋巴细胞计数结果以及各类标本(包括痰液、灌洗液、全血、胸腹水、脑脊液和粪便等)的分枝杆菌分离培养结果。同一患者相同标本类型所培养获得的菌株体外药敏试验及菌种分型一致,则按1例计。
1.2试剂与仪器 改良罗氏培养基、分枝杆菌药敏培养基、对硝基苯甲酸(PNB)培养基、噻吩-2-羧酸肼(TCH)培养基(珠海贝索公司),质控菌株H37Rv标准菌株(中国药品生物制品检定所),分枝杆菌菌种鉴定(PCR-反向点杂交法)试剂盒、20×SSC缓冲液、10%SDS缓冲液、1 M柠檬酸钠缓冲液(深圳亚能生物公司),淋巴细胞亚群检测试剂(美国BD公司);BACTEC MGIT 960分枝杆菌培养检测仪、FACS Calibur流式细胞仪(美国BD公司),ABI 7500型荧光定量PCR仪(赛默飞世尔科技公司),恒温杂交仪(深圳亚能生物公司)。
1.3方法
1.3.1分离培养及鉴定 参照《结核病诊断实验室检验规程》进行分离培养,阳性菌株用PNB、TCH鉴别培养基进行分枝杆菌菌种初步鉴定。如果2种鉴别培养基上均无分枝杆菌生长,报告为牛结核分枝杆菌;如果2种鉴别培养基上均有分枝杆菌生长,报告为NTM菌群;如果PNB培养基上无分枝杆菌生长而TCH培养基上有分枝杆菌生长,报告为结核分枝杆菌(Mycobacteriumtuberculosis, MTB)。
1.3.2药敏试验 用绝对浓度法。取培养阳性菌株,在细菌超声分散仪上制备成1 mg/mL的菌悬液,稀释成10-2mg/mL,取100 μL分别接种至2支对照培养基(中性改良罗氏培养基)和高低浓度含药培养基上,37 ℃条件下培养4周。对照培养基上菌落生长良好的前提下,含药培养基上无菌落生长,则报告敏感(S);生长菌落数多于20个,则报告耐药(R);少于20个,记录实际菌落数,重复实验。药敏试验药物种类包含链霉素、异烟肼、利福平、乙胺丁醇、左氧氟沙星、阿米卡星、卷曲霉素、卡那霉素、对氨基水杨酸。
1.3.3分枝杆菌菌种鉴定 按照试剂盒说明书,对标本进行前处理、待测标本DNA提取、配制反应体系后置于荧光定量PCR仪中扩增。同时在体系中加入阳性质控品和阴性质控品DNA。PCR反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 45 s,68 ℃ 60 s,循环30次;95 ℃ 30 s,54 ℃ 30 s,68 ℃ 60 s,循环30次;68 ℃ 10 min。将菌种鉴定膜条、PCR产物及杂交缓冲液置于同一管中,沸水浴10 min,放入恒温杂交仪59 ℃杂交1.5 h后洗膜,显色,根据膜条特定位置显色与否来判读结果。阳性质控品的膜条在结核分枝杆菌复合群位点和质控位点显色且其他位点不显色,同时阴性质控品的膜条只在质控位点显色视为实验有效,否则实验无效。
1.3.4CD4+T淋巴细胞亚群检测 按照试剂盒说明书对标本进行处理,处理后的标本用FACS Calibur流式细胞仪进行检测并用MultiSet软件对检测结果进行分析。
1.4统计学分析 用SPSS 22.0统计软件进行。偏态分布数据以中位数(四分位数)表示。计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1分枝杆菌分离情况 1 012例HIV/AIDS患者共送检2 415份标本,分枝杆菌培养阳性357例,阳性率为14.78%。
2.2MTB和NTM的分离情况 分枝杆菌培养阳性的357例标本中,除去122例未进行菌种分型及体外药敏试验的标本,因同一患者相同标本类型培养所获得的菌株体外药敏试验及菌种分型一致按1例计入,共除外84例,共获得151株分离株,其中MTB 54例(35.76%),NTM 97例(64.24%),均以痰液标本为主,分别占62.96%和41.24%,见表1。

表1 不同类型标本MTB与NTM的分离情况
2.3NTM菌种的分布情况 97例NTM经菌种鉴定,共获得8种不同菌株,包括鸟分枝杆菌65株(分离率67.01%),胞内分枝杆菌13株(分离率13.40%),堪萨斯分枝杆菌7株(分离率7.22%),戈登分枝杆菌5株(分离率5.15%),瘰疬分枝杆菌3株(分离率3.09%),苏尔加分枝杆菌2株(分离率2.06%),蟾蜍分枝杆菌、龟分枝杆菌脓肿亚种各1株(分离率1.03%)。
2.4MTB和NTM的药敏试验结果 54例MTB中耐药菌株共13例,总耐药率24.07%;耐多药2株,耐药率3.70%,均分离自痰液;97例NTM中耐药菌株共94例,总耐药率96.91%。MTB和NTM总耐药率差异有统计学意义(χ2=89.118,P<0.01),且其对不同药物的耐药率差异均有统计学意义(P<0.01)。见表2。
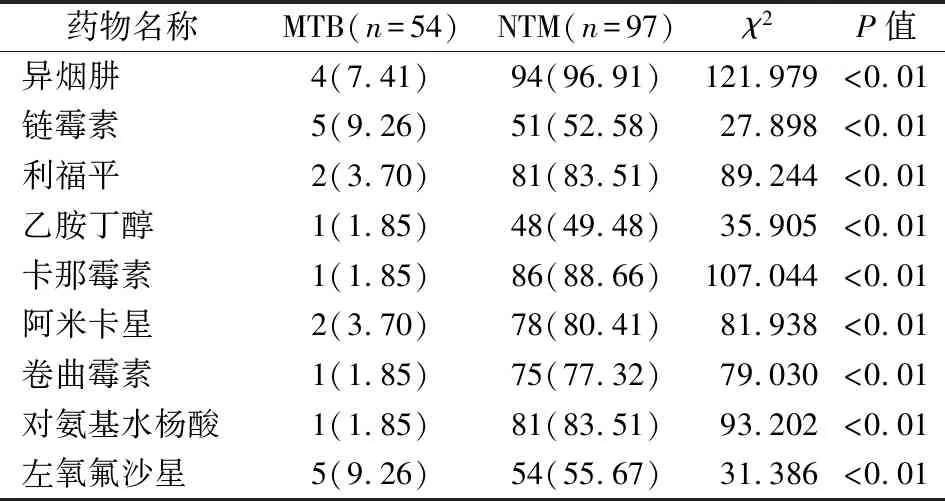
表2 MTB和NTM对不同药物的耐药情况[n(%)]
2.5MTB和NTM感染者CD4+T淋巴细胞计数的分布情况 54例MTB感染者CD4+T淋巴细胞计数中位数为91(44,156)个/μL,其中<50个/μL有20例(37.04%),50~200个/μL有25例(46.30%),200~350个/μL有7例(12.96%),350~500个/μL有2例(3.70%);97例NTM感染者CD4+T淋巴细胞计数中位数为32(6,104)个/μL,其中<50个/μL有51例(52.58%),50~200个/μL有27例(27.84%),200~350个/μL有15例(15.46%),350~500个/μL有3例(3.09%),>500个/μL有1例(1.03%)。
3 讨论
HIV感染引起的免疫功能缺陷导致机体对诸多疾病易感性的增加是HIV/AIDS患者机会性感染的主要原因,也是HIV/AIDS患者死亡的主要原因[5]。中国是分枝杆菌感染的高负担国家,艾滋病合并结核会加速艾滋病的进程,而抗结核治疗成功率低,病死率居高不下,这是双重感染防治工作正在面临的困难。
NTM是HIV/AIDS患者肺内及肺外感染的重要病原体之一,引起肺部感染时临床表现常与肺结核相似且对常用抗结核药物有较高的耐药性,容易被误诊为结核病或耐药结核病,引起治疗不当,延误病情。本研究中,分枝杆菌培养阳性率为14.78%,稍低于上海市(19.19%)[6]。相关文献报道,艾滋病患者的分枝杆菌培养阳性菌株中约50%为NTM[7],本研究中,151例分枝杆菌分离株中,NTM占64.24%。黄莉莉等[8]发现南京地区2017年5月至2018年8月NTM分离率为15.5%,流行菌株为胞内分枝杆菌(70.1%),而本研究提示南京地区HIV/AIDS患者合并NTM感染时,主要是鸟分枝杆菌感染(67.01%),但占比明显高于四川地区(8/21)[9],可能是标本来源人群及地域差异所致。
郝贤斌等[10]报道HIV和MTB共同感染后造成死亡率升高的原因可能是MTB激活机体适应性免疫和固有免疫,产生细胞因子和细胞内转导,从而诱导HIV的复制,病毒载量升高,CD4+T淋巴细胞大量被破坏。本研究中HIV/AIDS合并MTB感染的总耐药率为24.07%,与王印等[11]研究结果(26.02%)相近。HIV/AIDS合并NTM感染时的总耐药率为96.91%,以异烟肼耐药率最高(96.91%),其次是卡那霉素(88.66%)和利福平(83.51%),对乙胺丁醇(49.48%)耐药率相对较低,提示临床用药可优先考虑此类药物。
HIV/AIDS患者CD4+T淋巴细胞计数是检测疾病进程的一项重要指标。本研究结果显示HIV/AIDS合并MTB感染者CD4+T淋巴细胞数量多集中在50~200个/μL,合并NTM时多低于50个/μL,提示患者病毒复制程度高,免疫系统被破坏严重,更易发生机会性感染,临床用药时应注意药物之间的相互作用,更加慎重用药。

