扇贝来源碳量子点性质及其与镉的联合毒性
王庆红,谭明乾,齐子和,王海涛,
(1.大连工业大学食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034)
纳米材料具有小尺寸效应、表面效应、高反应活性和量子效应[1-3],对人类身体健康有着潜在的风险。随着纳米技术在食品领域的广泛应用,人们越来越重视其可能导致的负面健康效应。目前研究主要集中在外源添加的纳米粒子上[4-5];除外源添加的纳米粒子外,食品在加工过程中也可产生具有纳米结构的颗粒[6-8],然而这一类食源性纳米粒子的性质还缺乏研究。
碳量子点(carbon quantum dots,CQDs)是一类新型纳米结构,以碳、氧、氢为主要组分,直径一般小于10 nm,最先在纯化碳纳米管过程中发现[9]。Sk等[10]在焦糖中分离得到碳纳米粒子,首次将CQDs与食品联系起来。近期研究发现,CQDs在食品中分布广泛;如Jiang Chengkun等[11]在雀巢咖啡中发现了CQDs;Song Xunyu等[12]报道了烤鸡胸肉中的CQDs。食品中CQDs的形成与加工方式密切相关。热加工是食品工业中常用的加工方式,高温下食品组分发生复杂的相互作用,这些反应能够导致纳米颗粒的形成。纳米材料相对比表面积较大,且表面自由能较高,能够和其他分子通过氢键等发生相互作用。如烤鱼中分离得到的CQDs能够通过氢键与胃蛋白酶发生相互作用[13]。除蛋白质外,食源性CQDs还能与金属离子发生相互作用,如烤制牛肉中获取的CQDs可以通过与铁离子相互作用实现对铁元素的载运[14];牛肉汤中获取的CQDs能够和锌离子相互作用[15]。
镉是一种重金属元素,具有明显毒性,长期接触镉对人体健康有害[16]。镉可以通过食物链传递,在器官中积累[17]。研究表明,镉离子(Cd2+)对哺乳动物的器官,包括肺、肾、睾丸以及心血管、造血系统和神经系统都会造成损害[18]。鱼类和软体动物等水生生物对镉具有极强的富集能力,可沿食物链转移蓄积,具有隐藏性和不可逆性等特点[19],是影响水产品食用安全的重要因素之一。贝类具有很强的富集重金属的能力[20],在贝类加工过程中,特别是在热加工过程中可能会产生CQDs,这种纳米结构与贝类中的Cd2+发生相互作用,可能会影响镉本身的毒性。本实验采用虾夷扇贝(Patinopecten yessoensis)作为研究对象,通过透射电子显微镜(transmission electron microscopy,TEM)观察、X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析等系统表征来源于虾夷扇贝的CQDs,并采用等温滴定量热(isothermal titration calorimetry,ITC)法考察CQDs与Cd2+的相互作用,同时通过细胞毒性实验评价CQDs对Cd2+毒性的影响,以期为深入认识食源性纳米颗粒的性质及其潜在的健康影响提供参考。
1 材料与方法
1.1 材料与试剂
虾夷扇贝购于大连市甘井子区仟和农贸市场;大鼠肾上腺嗜铬细胞瘤(pheochromocytoma,PC12)细胞获取自中国科学院上海科学院细胞资源中心实验室细胞库。
乙酸乙酯天津市大茂化学试剂厂;溴化钾北京百灵威科技有限公司;DMEM高糖培养基美国Gibco公司;胎牛血清北京四季青生物科技有限公司;青链霉素混合液(双抗)美国Hycone公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS)、二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)北京宝希迪科技有限公司;体积分数30%过氧化氢大连博诺科技有限公司;活性氧(reactive oxygen species,ROS)测定试剂盒、线粒体膜电位检测试剂盒南京建成生物工程研究所有限公司;细胞周期与细胞凋亡检测试剂盒上海碧云天生物科技有限公司;实验用水为超纯水,电阻率18.2 MΩ·cm。
1.2 仪器与设备
Lambda 35紫外-可见光谱仪、FTIR仪美国PerkinElmer有限公司;F-2700荧光分光光度计日立(中国)有限公司;JEM-2100(UHR)TEM日本电子株式会社;Escalab 250Xi XPS仪美国赛默飞世尔科技公司;NU-437-400s超净工作台、NU-5810E二氧化碳培养箱美国Nuaire公司;FACSVerse流式细胞仪美国BD公司;Infinite M200多功能酶标仪、普通荧光酶标仪瑞士Tecan公司;XRD-7000S X射线衍射(X-ray diffraction,XRD)仪日本岛津公司;FLS-980稳态/瞬态荧光光谱仪英国爱丁堡仪器公司;Affinity ITC仪美国TA仪器公司。
1.3 方法
1.3.1 CQDs的制备
取2 g虾夷扇贝贝柱于反应釜中,加入7 mL去离子水,180 ℃加热4 h。4 000 r/min离心5 min,收集上清液。上清液采用乙酸乙酯进行萃取后置于3 500 Da的透析袋内于常温下透析。收集透析袋外溶液,旋转蒸发浓缩后,使用500 Da的透析袋在常温下透析,收集透析袋内溶液,冷冻干燥,得到CQDs,于-20 ℃冰箱冻存。
1.3.2 CQDs的表征
以2,5-二羟基苯甲酸为基质,通过基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)测定CQDs的分子质量。将1 mg/mL CQDs水溶液经0.22 μm滤膜过滤,滴至超薄碳膜网上,在室温下干燥后使用TEM观察CQDs形貌,加速电压为200 kV。随机选取TEM照片中100 个CQDs并测量其直径,获得CQDs的粒径分布结果。采用XRD仪分析CQDs晶体结构,分析条件:采用Cu靶,管压30 kV、管流20 mA、扫描速率5(°)/min、衍射角度2θ范围5°~80°。采用XPS仪分析CQDs的元素组成和表面基团,分析条件:单色X射线源Al Kα作为激发源,激发电压1 486.6 eV,结合能用污染碳C1s(结合能284.8 eV)进行校准。采用紫外-可见吸收光谱仪对CQDs进行扫描,分析条件:扫描范围700~200 nm、扫描速率1 200 nm/min,去离子水作为空白对照。采用荧光分光光度计测定CQDs荧光光谱,分析条件:狭缝宽度10 nm。通过稳态/瞬态荧光光谱仪测定CQDs荧光寿命。采用压片法测定CQDs FTIR光谱,溴化钾为背景,扫描范围500~4 000 cm-1。
1.3.3 CQDs与Cd2+相互作用分析
使用PBS分别配制成浓度4 mmol/L CQDs溶液和10 mmol/L Cd2+溶液,经0.22 μm微孔膜过滤后置于真空脱气机中进行脱气处理。将350 μL CQDs溶液注入ITC仪样品池中,130 μL Cd2+溶液加入注射器中。温度25 ℃、滴定速率180 s/滴、滴定间隔300 s、滴定40 滴、搅拌速率80 r/min。通过NanoAnalyze软件Independent Binding模式分析拟合数据,确定CQDs和Cd2+间相互作用的热力学参数(结合常数(Ka)、结合位点数(n)、焓变(ΔH)、熵变(ΔS)和吉布斯自由能变(ΔG))。
1.3.4 细胞毒性评价
1.3.4.1 MTT法检测细胞毒性
将PC12细胞以104个/孔的密度接种于96 孔板中。使用完全培养基在细胞培养箱中培养24 h后,弃去原培养基,用含有不同质量浓度(0.12~1.00 mg/mL)CQDs、10 μmol/L Cd2+或CQDs-Cd2+(CQDs质量浓度为0.06 mg/mL或0.12 mg/mL,Cd2+浓度为10 μmol/L)的新鲜完全培养基处理细胞24 h。然后去除孔板中培养基,加入20 μL 5 mg/mL MTT孵育4 h。除去孔板中MTT溶液后,每孔加入150 μL DMSO,振荡15 min,用多功能酶标仪于570 nm波长处测定吸光度,吸光度与活细胞数成正比[21]。以不含CQDs、Cd2+或CQDs-Cd2+的新鲜完全培养基培养的细胞作为空白对照。
1.3.4.2 ROS水平检测
将PC12细胞接种于12 孔板中,每孔加入约5×105个细胞,细胞培养箱孵育24 h,当细胞铺满孔板约85%后去除孔板中原有培养基,加入10 μmol/L Cd2+溶液以及终浓度10 μmol/L Cd2+与终质量浓度0.06 mg/mL CQDs的混合溶液,继续孵育24 h;使用过氧化氢处理的细胞作为阳性对照组。处理20 min后收集细胞,离心去上清液,使用500 μL PBS重悬后避光加入10 μmol/L 2’,7’-二氯荧光黄双乙酸盐,在37 ℃下避光染色30 min,离心收集细胞,采用PBS重悬后转移至黑色96 孔板中,使用荧光酶标仪检测荧光强度[22]。ROS水平以处理组与对照组荧光强度的比值表示。
1.3.4.3 线粒体膜电位测定
将PC12细胞接种于12 孔板中,每孔加入约5×105个细胞,细胞培养箱孵育24 h,待细胞铺满孔板约85%后分别加入含有10 μmol/L Cd2+以及终浓度10 μmol/L Cd2+与终质量浓度0.06 mg/mL CQDs混合溶液的培养基,使用细胞凋亡诱导剂羰基氰化物间氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone,CCCP)作为阳性对照组。处理20 min后收集细胞,离心去上清液,加入500 μL JC-1染剂,避光孵育20 min,离心后采用JC-1染色缓冲液重悬,继续用JC-1染色缓冲液洗涤2 次,样品转移至96 孔板,使用荧光酶标仪检测JC-1单体(激发波长490 nm、发射波长530 nm)和JC-1聚合物(激发波长570 nm、发射波长590 nm)荧光强度。以JC-1聚合物与其单体的荧光强度比值表示线粒体膜电位[22]。
1.3.4.4 细胞周期的检测
将PC12细胞以每孔106个细胞接种于6 孔板中,培养24 h弃去原培养基,分别加入含有10 μmol/L Cd2+以及终浓度10 μmol/L Cd2+与终质量浓度0.06 mg/mL CQDs混合溶液的培养基。继续孵育24 h,胰酶消化收集细胞,离心去上清液,用PBS再次清洗细胞后离心去上清液,加入1 mL冰浴预冷的体积分数70%乙醇溶液,轻轻吹打均匀,4 ℃固定24 h。离心后弃去固定液,加入1 mL冰浴预冷的PBS清洗细胞,弃去PBS,加入0.5 mL染色缓冲液,10 μL 100 μg/mL RNase和25 μL 50 μg/mL碘化丙啶(propidium iodide,PI),37 ℃下避光孵育30 min,最后用流式细胞仪分析细胞周期。
1.4 数据统计与分析
每个实验重复3 次,实验数据使用SPSS 19软件进行处理,结果以平均值±标准差表示,采用单因素方差分析进行差异显著性分析(以P<0.05表示差异显著),使用Origin Pro 8.5软件绘制图表。
2 结果与分析
2.1 扇贝来源CQDs的表征结果
食源性CQDs普遍存在于日常生活所食食物中,这些CQDs是食品中某些组分,如蛋白质、多糖和脂质在高温条件下相互作用形成的。已有报道表明,在烤制食品和饮料中发现了CQDs,因此推测虾夷扇贝在热加工过程中也会产生CQDs。本实验通过离心沉淀及透析,提取并纯化了虾夷扇贝热加工过程中可能产生的CQDs。由图1A可知,扇贝来源CQDs溶液在可见光照射下呈浅黄色,考察CQDs在200~600 nm波长范围内的紫外-可见光吸收情况发现,在260 nm附近有1 个明显的吸收峰,这可能由共轭分子的π→π*电子跃迁引起[23]。由图1B可知,在紫外光照射下,扇贝来源CQDs溶液能够发出明亮的蓝色荧光,最大激发波长为330 nm,最大发射波长为430 nm;荧光光谱分析结果表明,在300~390 nm波长范围内,扇贝来源CQDs最大荧光发射波长随其激发波长的增大而增大,同时荧光强度相应减小,这种荧光红移现象是CQDs的典型特征[24]。通过TEM观察CQDs形态,如图1C所示,虾夷扇贝中CQDs形貌接近球形,分散性良好,没有明显聚集;同时在高分辨TEM图像中观察到CQDs晶格结构,晶格间距为0.18 nm。TEM结果进一步证明了CQDs的存在。粒径分析结果如图1D所示,虾夷扇贝中CQDs粒径分布相对较窄,主要集中在2~6 nm,平均粒径为3.7 nm。

图 1 扇贝来源CQDs的紫外-可见吸收光谱与荧光光谱以及形态分析Fig. 1 UV-vis absorption spectra, fluorescence emission spectra and size distribution of CQDs from scallop

图 2 扇贝来源CQDs的结晶度、荧光寿命、表面官能团及分子质量分析Fig. 2 Crystallinity, fluorescence lifetime, surface functional groups and molecular mass analysis of CQDs from scallop
通过XRD考察扇贝来源CQDs的结晶状态,如图2A所示,在2θ为23.36°处观察到一个较宽的衍射峰,这表明虾夷扇贝中CQDs为无序的碳结构,这与大多数CQDs的结晶度结果一致[25]。在室温下通过时间相关单光子计数技术测定CQDs的荧光衰减曲线,如图2B所示。采用双指数函数进行拟合计算得到虾夷扇贝中CQDs的平均荧光寿命为5.98 ns。通过FTIR考察CQDs的表面基团,由图2C可知,CQDs在3 300 cm-1附近有明显的吸收带,这与氨基和羟基的伸缩振动有关;位于2 900 cm-1处的吸收峰与C-H键振动有关,这说明CQDs表面存在甲基;1 641、1 522 cm-1和1 449 cm-1处的吸收峰分别对应酰胺I、II和III带。酰胺I带主要由C=O键的伸缩振动引起,酰胺II带与N-H弯曲振动密切相关,酰胺III带反映C-N拉伸振动。FTIR结果表明,虾夷扇贝中CQDs表面具有羟基、氨基、羧基和甲基等官能团[26]。采用MALDI-TOF-MS测定虾夷扇贝中CQDs的分子质量,由图2D可知,CQDs在m/z800~1 800范围内出现多个离子峰,这表明CQDs存在不同分子质量。此外,TEM图像及粒径分析结果均表明,虾夷扇贝中CQDs粒径不同,粒径不同必然导致分子质量的差异,这进一步印证了MALDI-TOF-MS的结果。CQDs在m/z1 030处的离子峰强度最大,因此,以m/z1 030代表虾夷扇贝中CQDs的分子质量,这一结果与之前报道的烤鸡肉和鸭肉中CQDs的分子质量测定结果[8,27]相似。

图 3 扇贝来源CQDs的元素组成分析Fig. 3 Elemental analysis of CQDs from scallop
采用XPS进一步表征扇贝来源CQDs的元素组成和表面基团。由图3A可知,虾夷扇贝中CQDs XPS全扫描谱中存在3 个主要峰,结合能分别为285、399 eV和532 eV,分别对应C、N和O 3 种元素。根据峰面积计算得到CQDs中C、N和O 3 种元素的相对含量分别为23.75%、7.01%和68.77%。相对较高的N元素含量表明虾夷扇贝中的含氮成分(如蛋白质)参与了CQDs的形成。图3B~D分别是C1s、N1s和O1s的XPS高分辨谱图。XPS高分辨谱图可以展现CQDs表面基团信息。在C1s XPS高分辨谱图中284.7、286.0、286.7 eV和288.0 eV 4 个峰分别表示C-C/C=C、C-N、C-O和O-C=O键。N1s XPS高分辨谱图存在398.1 eV和398.6 eV两个峰,分别对应吡啶氮和N-H基团。O1s XPS高分辨谱图在531.3 eV和532.3 eV分别存在O-C=O和C-O两个特征峰[25-26,28]。这与FTIR结果类似,XPS分析结果进一步证明了虾夷扇贝CQDs存在羟基、氨基和羧基等官能团。
2.2 扇贝来源CQDs与Cd2+的相互作用

图 4 扇贝来源CQDs与Cd2+的ITC分析Fig. 4 ITC analysis of CQDs and Cd2+ from scallop
ITC 是研究物质之间相互作用的有效手段,可以通过测定物质相互作用产生的热力学变化,揭示2 种物质之间的结合力以及结合化学计量学。热力学参数包括ΔG、ΔH和ΔS,它们在物质相互作用时不同的变化规律可以阐释物质相互作用的机制。一般来讲,分子间相互作用力主要分为4 种类型:氢键、范德华力、静电相互作用和疏水相互作用。当氢键或范德华力为分子间主要相互作用力时,ΔS<0且ΔH<0;当分子间作用力主要为静电相互作用时,ΔH<0而ΔS>0;当疏水相互作用为主要作用力时,ΔS>0且ΔH>0[13,29]。图4A为Cd2+滴定虾夷扇贝中CQDs的ITC曲线,图4B为每次滴定结合后产生的热图。Cd2+滴定CQDs后吸热不断下降,校正因Cd2+滴定稀释而导致的溶解热后,采用非线性最小二乘法模型拟合,以独立位点结合模型确定Cd2+与CQDs相互作用过程中的热力学参数。Cd2+与CQDs相互作用过程中的ΔG为-27.24 kJ/mol,ΔG<0说明两者之间的反应为自发反应。同时,该过程中ΔH为-4.869 kJ/mol,ΔS为75.04 J/(mol·K),说明Cd2+与CQDs结合力主要为静电相互作用。Cd2+与CQDs相互作用的Ka为5.925×104mol/L,n为0.408,说明Cd2+与CQDs具有良好的结合力。综上所述,Cd2+可以通过静电相互作用自发地与CQDs形成CQDs-Cd2+复合物。
2.3 扇贝来源CQDs及CQDs-Cd2+的细胞毒性评价
食源性CQDs广泛存在于食品中,虽然碳本身不被认为是有毒元素,但CQDs因具有较小尺寸,可能对人类健康构成潜在风险,其安全性受到广泛关注[30]。多数研究结果表明,食源性CQDs的毒性较小。如以2 g/kgmb剂量灌胃可乐中的CQDs,对小鼠血液生化指标没有显著影响[31]。Liao Han等[32]研究饮料中CQDs对人舌鳞状细胞癌Tca8113细胞的细胞毒性,细胞活性评价结果表明,当CQDs质量浓度低于20 mg/mL时,不会引起细胞活性的显著下降。本实验采用MTT法评价扇贝来源CQDs对PC12细胞的细胞毒性,由图5A可知,随着CQDs质量浓度增加,细胞存活率逐渐降低,当CQDs质量浓度为1 mg/mL时,细胞存活率接近60%,当CQDs质量浓度小于0.12 mg/mL时,细胞存活率受到CQDs的影响较小。


图 5 CQDs及CQDs-Cd2+对PC12细胞的细胞毒性Fig. 5 Cytotoxicity analysis of CQDs and CQDs-Cd2+ complex
一般而言,纳米颗粒因相对比表面积较大,且表面自由能较高,能够与其他分子通过疏水相互作用、氢键和静电吸附等发生相互作用。ITC结果表明,扇贝来源CQDs能够通过静电相互作用与Cd2+形成复合物,这种复合物的细胞毒性尚不清楚。为进一步研究食源性CQDs对镉毒性的影响,测定当CQDs存在时对Cd2+诱导细胞毒性的影响。由图5B可知,CQDs的存在增强了Cd2+的毒性,细胞存活率随CQDs质量浓度增加而下降。当Cd2+(10 μmol/L)单独存在时,细胞存活率为52.2%,在此条件下,加入0.06 mg/mL CQDs后,细胞存活率下降到45.1%,当加入CQDs质量浓度增加到0.12 mg/mL后,细胞存活率下降到39.6%。为排除CQDs自身毒性对细胞活性的影响,同时测定CQDs单独存在时对细胞活性的影响。CQDs质量浓度0.06 mg/mL和0.12 mg/mL时,细胞存活率分别为96.4%和90.5%。细胞存活率下降幅度低于与Cd2+共同存在时,这表明CQDs强化了Cd2+的毒性。越来越多的研究表明,Cd2+会破坏细胞线粒体膜的完整性,可通过线粒体途径诱导细胞凋亡[33-34]。进一步测定CQDs存在情况下Cd2+对细胞ROS水平(图5C)和线粒体膜电位(图5D)的影响。结果表明,CQDs存在情况下,与仅存在Cd2+相比,细胞ROS水平大幅升高;同时,线粒体膜电位结果表明CQDs与Cd2+共同存在产生的联合毒性对线粒体膜完整性影响更大;表明CQDs可能通过增加ROS水平和损害线粒体功能增强Cd2+毒性。

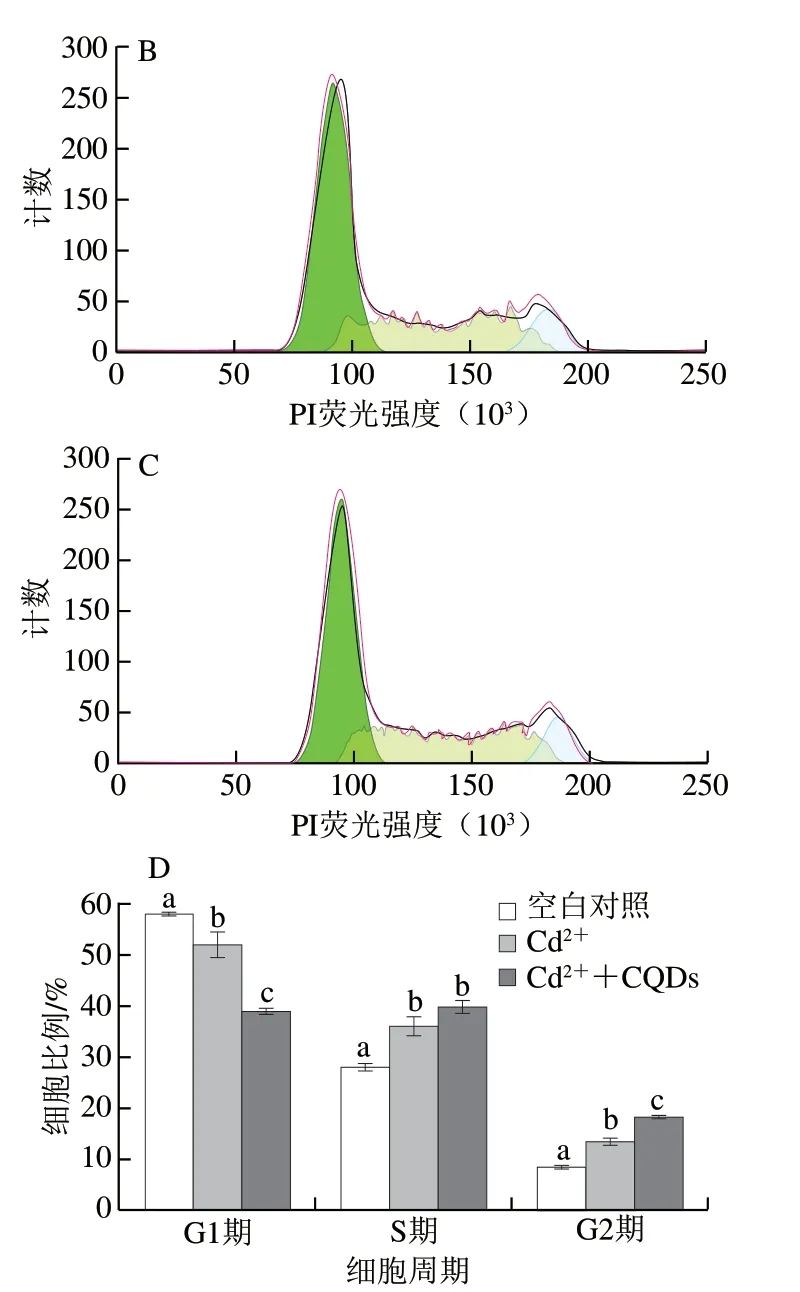
图 6 CQDs及CQDs-Cd2+复合物对细胞周期的影响Fig. 6 Effect of CQDs and CQDs-Cd2+ complex on cell cycle
细胞周期分为2 个阶段,分别为细胞间期与细胞分裂期,包括细胞一次分裂完成开始到下一次分裂结束整个过程,其中,细胞间期又分为3 个阶段,即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。细胞周期停滞是抑制细胞生长的关键因素[35],细胞周期受到严密调控,基因组DNA完成复制并均等分配到子细胞中。当处于不利条件时,细胞分裂停止,甚至诱发细胞凋亡。处于细胞周期不同阶段DNA含量不同,G1期细胞具有二倍体细胞的DNA含量(2N),G2期因DNA复制,细胞中DNA含量翻倍(4N),S期细胞的DNA含量介于G1期和G2期之间。通过DNA含量不同,可以区分处于不同细胞周期阶段的细胞,进而对细胞周期进行分析。PI可以与DNA结合,其荧光强度可以直接反映细胞内DNA含量。本实验通过流式细胞仪PI染色法对细胞内DNA含量进行检测。由图6可知,与对照组相比,Cd2+孵育导致G1期细胞比例减少,从对照组的57.7%下降到51.8%;S期和G2期细胞比例增加,分别从对照组的27.7%和8.5%上升到36.2%和13.2%。这说明细胞周期被阻滞在G2期。当加入CQDs后,CQDs与Cd2+共同孵育会导致更严重的细胞周期阻滞。G2期细胞周期阻滞能够导致细胞凋亡,这与上述细胞活性结果相符。
3 结 论
本实验系统考察了扇贝来源的C Q D s,结果表明,CQDs呈球形,在水溶液中分散良好,平均粒径为3.7 nm。CQDs表面具有羟基、氨基和羧基等丰富的官能团。ITC结果表明,CQDs与Cd2+通过静电相互作用形成复合物。进一步评价CQDs对Cd2+细胞毒性的影响,结果表明,CQDs增强了Cd2+的细胞毒性,干扰正常细胞周期。本研究系统表征了扇贝来源CQDs的性质及其与重金属离子的相互作用,为认识食源性纳米颗粒的性质提供了参考。

