榆干离褶伞溶栓酶对脂多糖诱导的血管内皮细胞损伤的保护作用
耿 超,卫 莹,沈明花
(延边大学医学院,吉林 延吉 133002)
榆干离褶伞属担子菌亚门、层菌纲、伞菌目、口蘑科、离褶伞属,又名大榆蘑。研究报道,榆干离褶伞发酵液具有抗氧化[1]、溶栓、降血脂[2]、保护血管内皮细胞[3]等作用。本实验室前期研究表明,榆干离褶伞菌丝体中分离纯化的溶栓酶[4](Lyophyllum ulmariumfibrinolytic enzyme,LUFE)具有抑制血小板的活化[5]、保护氧化应激损伤的血管内皮细胞[6-7]等生物活性。但到目前为止,LUFE对炎症的影响及作用机制的研究报道甚少。
血管内皮细胞作为血管内膜的结构成分,直接与循环血液接触,是血管壁与血液之间的天然屏障。血管内皮细胞具有多种功能,能够保持机体局部内环境的稳态,具有抗炎、抗血小板聚集、抗栓、抗凝促纤溶等多种功能[8-9]。血管内皮细胞是一类分泌细胞,通过释放多种血管生物活性物质,影响血管结构和功能,调节血管的张力[10]。在物理、化学、生物因素等诱因的作用下,当血管内皮细胞的完整性遭到破坏时继发诸多疾病,如血管内皮细胞的炎性损伤是血栓栓塞性疾病、动脉粥样硬化等心血管疾病的病理基础[11-12]。因此,保护血管内皮细胞免受炎性损伤在预防或治疗心血管疾病过程中具有重要的意义。本实验以脂多糖(lipopolysaccharide,LPS)作为诱导剂,建立血管内皮细胞炎性损伤模型,旨在探讨LUFE对血管内皮细胞炎性损伤的保护作用,并探讨其作用机制。
1 材料与方法
1.1 材料与试剂
LUFE由延边大学医学院生物化学与分子生物学教研室纯化获得[4];人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)、人急性单核细胞白血病细胞系(human acute monocytic leukemia cell line-1,THP-1)购自上海佛雷堡生物科技发展有限公司。
LPS、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)、β-actin抗体、羊抗鼠免疫球蛋白(immunoglobulin G,IgG)-辣根过氧化物酶(horseradish peroxidase,HRP)、羊抗兔IgG-HRP美国Sigma公司;髓样分化因子88(myeloid differentiation factor 88,MyD88)抗体、核因子κB(nuclear factor kappa B,NF-κB)p65抗体、phospho-NF-κB抗体、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/κ2丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)抗体、phospho-ERK1/2 MAPK抗体、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)抗体、p38 MAPK抗体、p-p38 MAPK抗体美国Cell Signaling公司;JNK抗体美国Abcam公司;核纤层蛋白B抗体 博士德生物生物工程有限公司;Toll样受体4(Toll-like receptor 4,TLR4)多克隆抗体美国Thermo Fisher公司;别藻蓝蛋白(allophycocyanin,APC)标记的鼠抗人CD54(细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM-1)抗体、APC标记的同型对照IgG美国BD公司;Hoechst 33342染料北京索莱宝生物科技有限公司;白介素(interleukin,IL)-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、乳酸脱氢酶(lactate dehydrogenase,LDH)、E-选择素、单核细胞趋化因子1(monocyte chemoattractant protein 1,MCP-1)试剂盒上海研谨科技有限公司。
1.2 仪器与设备
酶标仪、细胞成像微孔板检测系统美国Bio-Tek公司;凝胶成像分析仪美国UVP公司;流式细胞分析仪美国Beckman公司。
1.3 方法
1.3.1 细胞培养
HUVEC和THP-1分别培养于含体积分数10%胎牛血清的DMEM和含10%胎牛血清的1640培养液中,置于37 ℃、5% CO2培养箱中培养。
1.3.2 MTT法检测LPS对HUVEC存活率的影响
将HUVEC接种到96 孔板,分为空白对照组和LPS组。空白对照组加无血清DMEM培养液,LPS组分为7 个组,向DMEM培养液中加入LPS,使其终质量浓度分别为0.01、0.1、1、10、100、200、400 μg/mL,每组设8 个复孔,作用24 h。每孔加入20 μL的MTT,4 h后弃上清液,每孔加入150 μL的DMSO,振荡300 s,静置30 s,测定492 nm波长处的OD值,按式(1)计算细胞存活率。

1.3.3 细胞上清液LDH活力测定
细胞分组及处理同1.3.2节。LPS作用24 h后,收集各组细胞上清液,按酶联免疫吸附测试(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书检测LDH活力。经不同质量浓度LPS作用后,检测其细胞上清液LDH活力,以确定后续实验中LPS的作用质量浓度。
1.3.4 MTT法检测LUFE对HUVEC存活率的影响
将HUVEC接种到96 孔板,分为空白对照组和LUFE组。空白对照组加无血清DMEM培养液,LUFE组分为7 个组,向DMEM培养液中加入LPS,使其终质量浓度分别为0.5、1、2、4、8、16、32 μg/mL,每组设8 个复孔,作用24 h。每孔加入20 μL的MTT,4 h后弃上清液,每孔加入150 μL的DMSO,振荡300 s,静置30 s,测定492 nm波长处的OD值,按式(2)计算细胞存活率。

1.3.5 MTT法检测LUFE预处理对LPS作用后HUVEC存活率的影响
取对数生长期的细胞,以1×104个/mL的密度接种于96 孔板中,分为空白对照组、模型组和LUFE低(1 μg/mL)、中(4 μg/mL)、高(16 μg/mL)剂量组。经不同剂量的LUFE干预24 h后,除空白对照组外,其余各组均加入LPS,使其终质量浓度为1 μg/mL,作用24 h。同1.3.2节方法检测492 nm波长处的OD值,按式(3)计算细胞存活率。

1.3.6 细胞上清液LDH、IL-6、TNF-α、E-选择素和MCP-1水平测定
细胞分组同1.3.4节。收集各组细胞上清液,按ELISA试剂盒说明书检测相应指标水平。
1.3.7 Hoechst染色观察THP-1与HUVEC的黏附作用
将HUVEC以6×104个/mL的密度接种于6 孔板,细胞分组同1.3.4节。将常规培养的THP-1用Hoechst 33342染料进行活细胞核染色15 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗去多余染料,用无血清培养基重悬。将重悬的THP-1以5×105个/mL密度加入各组HUVEC中,共培养6 h,PBS洗去未黏附的THP-1。用细胞成像微孔板检测系统观察与HUVEC发生黏附的THP-1,用ImageJ图像处理软件计算各组相对黏附数量。
1.3.8 流式细胞仪检测HUVEC的ICAM-1表达水平
HUVEC分组同1.3.4节。常规消化、离心,各组用PBS重悬细胞,调整细胞浓度为1×107个/mL。每组各取100 μL细胞悬液放入EP管中,加入APC标记的CD54(ICAM-1)抗体2 μL,同型对照组加入APC标记的IgG抗体2 μL,避光孵育20 min,加入PBS 1 mL,以300×g离心5 min,弃除上清液。每组再加入500 μL PBS,重悬细胞,用流式细胞仪测定ICAM-1的表达水平。
1.3.9 蛋白免疫印迹法检测HUVEC的TLR4、MyD88、TAK1、MAPK(p38和JNK)及细胞核NF-κB蛋白表达水平
细胞分组同1.3.4节。分别收集各组细胞,加入裂解液,在冰浴上裂解30 min,4 ℃、12 000 r/min离心20 min。取上清液(细胞全蛋白)作为检测TLR4、MyD88、转化生长因子β激活激酶1(transforming growth factor β activated kinase 1,TAK1)、MAPK(p38和JNK)的蛋白样品。用核蛋白抽提试剂提取核蛋白,用于检测NF-κB表达水平。
将上述两种蛋白样品分别进行定量。取30 μg蛋白样品分别进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电转移至聚偏氟乙烯膜上。将转膜后的聚偏氟乙烯膜放在质量分数为5%脱脂奶粉封闭液中封闭1 h后分别加入相应的一抗,在4 ℃孵育过夜。经洗涤、二抗室温孵育2 h,用凝胶成像仪进行分析。
1.4 数据统计分析
2 结果与分析
2.1 LPS对HUVEC存活率及LDH活力的影响
如图1A所示,与空白对照组比较,LPS在0~400 μg/mL质量浓度范围内对H U V E C 的存活率无显著影响(P>0.05)。但其质量浓度在1~400 μg/mL时,极显著提高细胞上清液LDH水平(P<0.01)(图1B),表明当LPS质量浓度大于1 μg/mL时对细胞起损伤作用。因此,在后续实验中选择1 μg/mL作为建立HUVEC损伤模型的LPS质量浓度。

图 1 LPS对HUVEC存活率及细胞上清液LDH活力的影响Fig. 1 Effect of LPS on the survival rate and LDH activity of HUVEC
2.2 LUFE对HUVEC存活率的影响
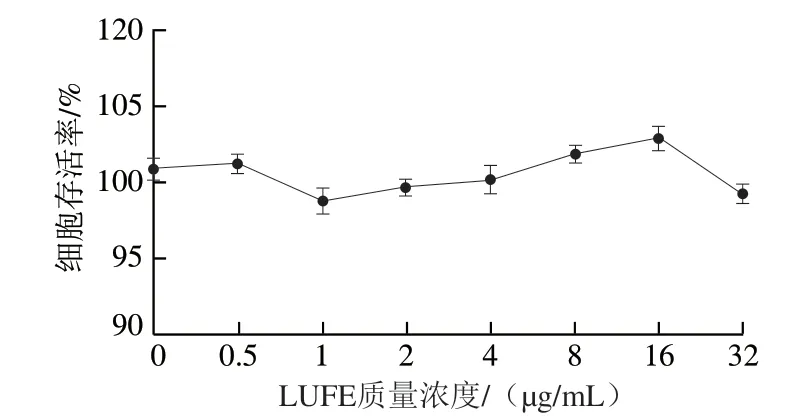
图 2 LUFE对HUVEC存活率的影响Fig. 2 Effect of LUFE on survival rate in HUVEC
如图2所示,与空白对照组比较,LUFE组对HUVEC存活率无显著变化,说明LUFE在0~32 μg/mL质量浓度范围内对细胞无毒性作用。
2.3 LUFE对LPS刺激后HUVEC存活率及LDH活力的影响

图 3 LUFE对LPS刺激后HUVEC存活率及LDH活力的影响Fig. 3 Effect of LUFE on survival rate and LDH levels in HUVEC induced by LPS
如图3所示,与空白对照组相比,模型组的细胞存活率无显著变化,但LDH活力明显升高,表明1 μg/mL LPS虽不影响细胞存活率,但对细胞具有损伤作用。经不同剂量的LUFE预处理后,极显著降低细胞上清液LDH活力,这就说明LUFE对损伤细胞有保护作用。
2.4 LUFE对炎症因子质量浓度的影响
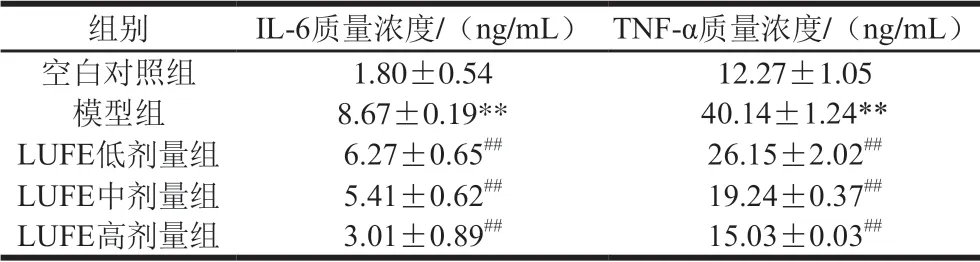
表 1 LUFE对LPS刺激后细胞上清液TNF-α和IL-6质量浓度的影响Table 1 Effect of LUFE on the levels of TNF-αand IL-6 in HUVEC induced by LPS
如表1所示,与空白对照组比较,模型组细胞上清液TNF-α、IL-6水平极显著升高(P<0.01),说明LPS作用后引起细胞的炎性损伤。与模型组比较,LUFE各剂量组TNF-α、IL-6水平极显著降低(P<0.01),提示LUFE具有一定的抗炎作用。
2.5 LUFE对MCP-1和E-选择素质量浓度的影响

表 2 LUFE对LPS刺激后细胞上清液MCP-1和E-选择素质量浓度的影响Table 2 Effect of LUFE on the levels of MCP-1 and E-selectin in HUVEC induced by LPS
如表2所示,与空白对照组比较,模型组MCP-1和E-选择素水平极显著升高(P<0.01),而与模型组比较,中、高剂量LUFE组MCP-1和E-选择素水平极显著降低(P<0.01),提示LUFE抑制LPS所致的趋化因子及黏附分子水平的升高。
2.6 LUFE对THP-1与HUVEC黏附作用的影响


图 4 LUFE对THP-1与HUVEC黏附的影响(200×)Fig. 4 Effect of LUFE on the adhesion of THP-1 to HUVEC (200 ×)
如图4所示,与空白对照组比较,模型组THP-1与HUVEC的相对黏附数量极显著增多(P<0.01);与模型组相比,经LUFE干预后THP-1与HUVEC的相对黏附数量极显著降低(P<0.01),说明LUFE能够抑制这两种细胞之间的黏附作用。
2.7 LUFE对细胞ICAM-1表达水平的影响
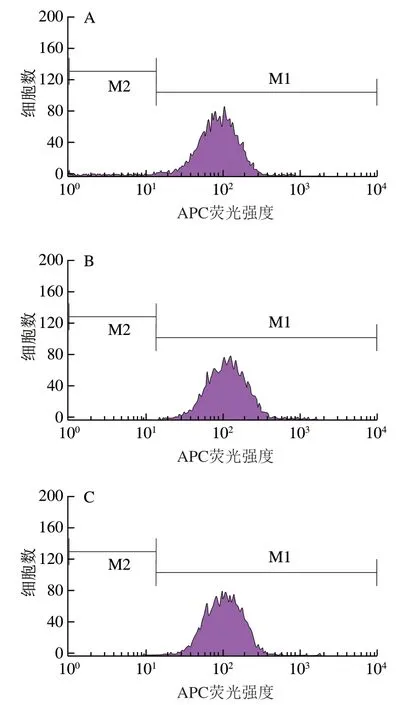

图 5 LUFE对HUVEC的ICAM-1表达水平的影响Fig. 5 Effect of LUFE on the expression level of ICAM-1 in HUVEC induced by LPS
如图5所示,空白对照组ICAM-1表达量平均值为83.6,模型组平均值为137.8,与空白对照组相比,模型组ICAM-1表达水平升高64.8%。LUFE低、中、高剂量组的ICAM-1表达量平均值分别为124.2、110.6和98.4。与模型组比较,LUFE低、中、高剂量组的ICAM-1表达水平分别降低9.9%、19.7%和28.6%,说明LUFE能降低HUVEC的ICAM-1表达水平。
2.8 LUFE对HUVEC的TLR4信号通路相关蛋白表达的影响


图 6 LUFE对HUVEC的TLR4、MyD88、TAK1蛋白表达水平的影响Fig. 6 Effect of LUFE on the expression of TLR4, MyD88 and TAK1in HUVEC
如图6A、C所示,与空白对照组比较,模型组TLR4和p-TAK1/TAK1水平极显著升高(P<0.01);与模型组相比,LUFE干预后其水平极显著降低(P<0.01)。如图6B所示,与空白对照组比较,模型组MyD88水平显著升高(P<0.05);与模型组比较,经LUFE干预后显著逆转这些蛋白的表达水平,提示LUFE能够下调LPS诱导的TLR4信号通路相关蛋白的表达水平。
2.9 LUFE对HUVEC的MAPK通路相关蛋白表达的影响


图 7 LUFE对HUVEC的JNK和p38蛋白表达的影响Fig. 7 Effect of LUFE on the expression of JNK and p38 in HUVEC
如图7所示,与空白对照组比较,模型组JNK、p38蛋白的磷酸化水平极显著升高(P<0.01)。与模型组相比,LUFE各剂量组JNK、p38蛋白磷酸化水平极显著降低(P<0.01)。
2.10 LUFE对HUVEC细胞核NF-кB蛋白表达的影响
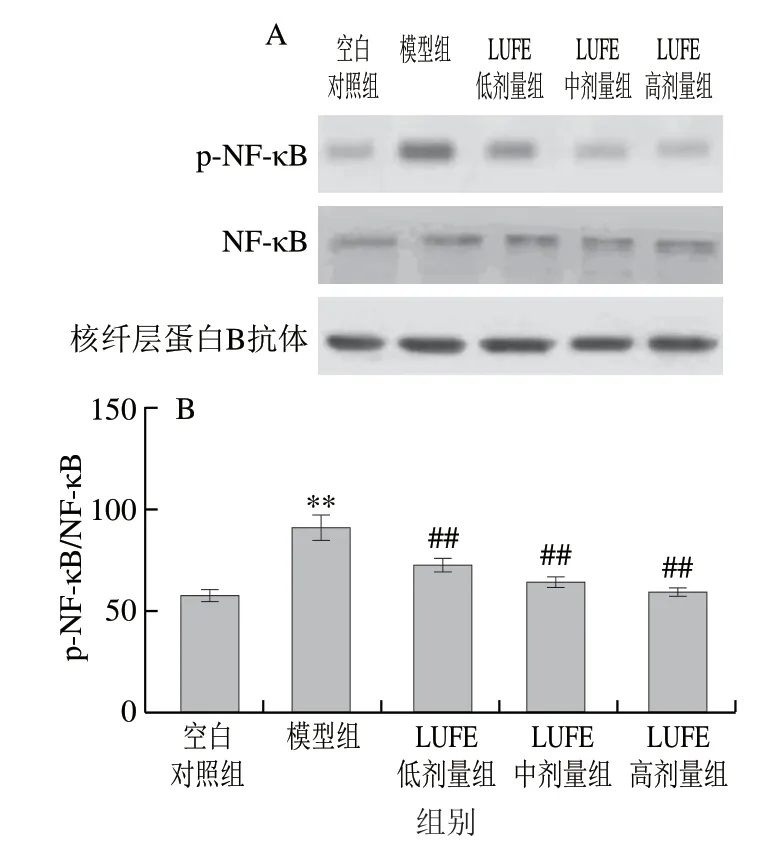
图 8 LUFE对HUVEC细胞核NF-κB蛋白表达的影响Fig. 8 Effect of LUFE on the expression of NF-κB in HUVEC
如图8所示,与空白对照组比较,模型组细胞核NF-κB(p65)磷酸化水平极显著升高(P<0.01);与模型组相比,LUFE各剂量组p-p65水平极显著降低(P<0.01),说明LUFE可能抑制p65的激活或p-p65的核移位过程。
3 讨 论
LPS作为革兰氏阴性细菌细胞壁的组成成分,常被应用于细胞炎症模型的研究[13-15]。LPS通过细胞相关的信号传导通路,表达并产生大量促炎因子[16-18]、黏附分子[19-20]及趋化因子[21],引起细胞的炎性损伤。本实验以LPS作为诱导剂,建立HUVEC炎性损伤模型,观察了LUFE对血管内皮细胞炎症反应的影响。
内皮细胞作为脉管系统的重要组成部分,在炎症及单核细胞的黏附和滚动过程中起重要的调节作用[22]。炎症部位的血管内皮细胞不仅是炎症反应的参与者,也是炎症反应的调节者。本实验结果表明,经LPS刺激后,血管内皮细胞受损,导致模型组TNF-α和IL-6等促炎因子水平升高,同时E-选择素和MCP-1等细胞黏附分子及趋化因子水平也升高,提示LPS在本实验剂量范围内虽不影响细胞存活率,但引起细胞的炎性损伤,产生大量黏附分子及趋化因子,而这些因子又进一步激活血管内皮细胞,促进炎症反应。流式检测结果表明,模型组的ICAM-1表达水平高于空白对照组,这与LPS和LPS所致高水平的TNF-α等炎症因子作用下发生的内皮细胞的激活有关。ICAM-1属于免疫球蛋白超家族中的成员,介导白细胞与血管内皮细胞的黏附,并在多种心血管疾病过程中起重要作用[23]。血管内皮细胞中高表达的ICAM-1促进白细胞激活,引起血管内皮细胞和单核细胞的黏附。荧光微孔板检测结果表明,模型组中HUVEC和THP-1的黏附数量明显高于空白对照组(P<0.01),这与血管内皮细胞高表达的ICAM-1和E-选择素以及MCP-1水平有关。LUFE预处理能够显著抑制由LPS诱发的TNF-α、IL-6、E-选择素、MCP-1和ICAM-1水平的升高,并降低THP-1和HUVEC的黏附作用,提示LUFE具有一定的抗炎作用。前期研究结果表明,LUFE在LPS诱导的大鼠炎性肝损伤模型中通过降低血清TNF-α、IL-6、IL-1β水平,减轻肝脏的炎性损伤[24],从而保护肝组织,进一步证实了LUFE的抗炎作用。
TLR4是识别LPS的关键受体,参与LPS介导的炎症信号转导,调节炎症因子的表达[25-26]。LPS在CD14的协助下激活并结合细胞表面的TLR4,启动TLR4信号传导通路[27],影响其下游的MyD88、TAK1等信号分子[28],激活MAPK、NF-κB等信号通路促进炎症因子的表达[29-30]。为了阐明LUFE的抗炎机制,观察LUFE对TLR4/MyD88/TAK1/MAPK信号通路相关蛋白和NF-κB的表达和活化水平。结果表明,模型组的TLR4、其下游分子MyD88和TAK1的磷酸化水平明显高于空白对照组。TAK1的磷酸化进一步激活MAPK家族(ERK、p38和JNK)和NF-κB信号通路,通过其下游的激活蛋白-1家族转录因子和核转录因子(p-NF-κB),促进炎症相关基因的表达[31-32]。因此,在本实验中经LPS刺激后p-p38、p-JNK和细胞核p-NF-κB(p65)水平显著升高,促进炎症相关因子的表达,导致血管内皮细胞TNF-α、IL-6、E-选择素、MCP-1和ICAM-1水平的升高。与模型组相比,经LUFE干预后TLR4和MyD88表达量减少,其下游分子TAK1、p38、JNK蛋白的磷酸化水平下降,细胞核p-NF-κB(p65)水平降低,提示LUFF可能通过TLR4分子,抑制其下游信号分子(MyD88、TAK1、p38、JNK和NF-κB)的激活,减少炎症相关因子的表达,即通过抗炎作用保护血管内皮细胞。
综上所述,LUFE可能通过下调TLR4/MyD88/TAK1/NF-κB信号通路及MAPK通路,减轻LPS诱导的血管内皮细胞的炎性损伤,从而保护血管内皮细胞。

