酞菁锌衍生物掺杂人血白蛋白的分子模拟研究
江苏卫生健康职业学院 江苏 南京 211800
酞菁锌衍生物(Znic phthalocyanine derivatives,ZnPc)具有高荧光量子产率、高单线态氧生成率、高效细胞吞噬以及体外高效抗癌活性[1-3]。因此,ZnPc被作为光敏剂广泛应用于光动力学治疗(光疗,PDT),并在光疗方面具有很大潜力。光疗时,ZnPc通过静脉注射进入体内,通过血浆蛋白运输后被体内的正常细胞和肿瘤细胞吸收。因此,ZnPc进入体内后与血浆中生物大分子的相互作用对其在体内的吸收、分布和代谢有着极其重要的影响。人血浆中约有100种不同的蛋白质,但与其他蛋白质组分相比,仅13种蛋白质含量>1g/L,其中,仅人血白蛋白(HSA,35-40 mg/mL),α-1酸性糖蛋白(α-1 acid glycoprotein),低密度脂蛋白(VLDL,0.2-0.4 mg/mL),和高密度脂蛋白(HDL,0.35-0.85 mg/mL)五种蛋白质具有药物结合能力[4],药物在体内能够与其中一种多种蛋白质结合而被运输到身体各部位,但是ZnPc与血浆蛋白质的相互作用研究甚少。因此,ZnPc与血浆蛋白质的相互作用研究对药物在体内的结合、运输、分布、药物稳定性及药物安全剂量等方面具有重要的指导意义。
本章以血浆中含量最丰富的人血白蛋白(HSA)为模型,研究酞菁锌衍生物(ZnPc)与HSA的相互作用。HSA是人体循环系统中含量最为丰富的一种蛋白质(约占血浆浓度的52~60%),主要承担许多氨基酸分子、药物分子、脂肪酸和代谢物等的结合运输。从结构上看,HSA是由585个氨基酸残基组成的单多肽链,且仅在其IIA结构域中存在一个特征色氨酸残基(Trp214)。HSA分子中包含了3个结构相似的结构域:α-螺旋结构域I,II和III(I:1~195;II:196~383;III:384~585)α-螺旋,每个结构域又分别包含了2个由4~6个螺旋结构组成的亚结构域(IA,IB;IIA,IIB;IIIA,IIIB)[4-6]。HSA能够结合多种光敏剂(PS),如华法令、地高辛、布洛芬、紫红素18、吩噻嗪和二氢卟吩 p6等,并且PS在HSA分子中的两个高效结合位点分别是I和II结构域[7-8],但是大多数研究仅侧重于PS与HSA的结合位置,没有深入研究其相互作用机理。
1 实验方法
人血白蛋白(HSA)晶体结构从PDB蛋白质结构数据库获得(PDB ID:1N5U)。HSA晶体结构(图1)由一条具有585个氨基酸残基的肽链组成,主要为α螺旋结构,其空间结构由三个结构域组成:domain I、domain II、domain III,每个结构域又含有A、B两个亚结构域,以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨酸残基都包埋在圆筒内部,构成疏水腔。大多数药物在HSA上的结合部位为亚结构域IIA 和 IIIA,即site I和 site II。使用Discovery Studio 2.5软件除去晶体结构中的配体分子、结晶水分子和其他无关的共因子(cofactor),并对受体蛋白进行加氢、加GASTEIGER电荷处理。
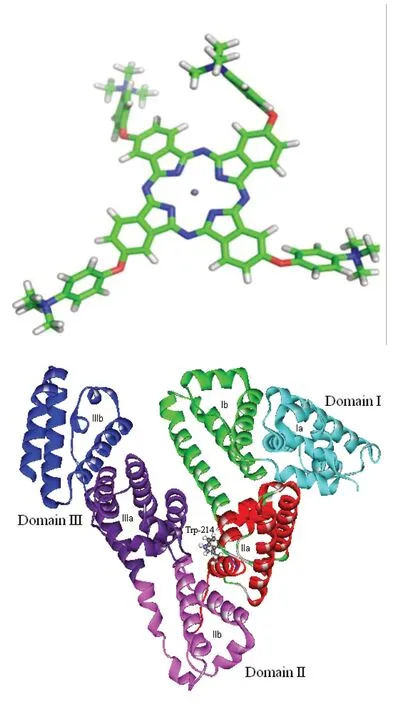
图1 人血白蛋白(HSA)晶体结构和酞菁锌衍生物(ZnPC)结构
酞菁锌分子的结构模型采用量子化学半经验方法PM6优化酞菁锌分子ZnPc的结构(图1)。然后基于优化结构,在m062x/6-31g*水平下计算这些酞菁锌分子的ESP电荷,用于分子对接和静电势分析。所有计算使用Gaussian 09软件完成。
本章使用Autodock Vina软件对酞菁锌小分子和受体HSA作用过程进行研究。由于酞菁锌分子与HSA的结合位点可能位于HSA的IIA 和 IIIA区域,即site I 和 site II,故本文将酞菁锌分子与HSA的IIA 和 IIIA区域进行对接。受体对接区域分别包含IIA和IIIA两个空腔,中心坐标分别为23.589,5.710,7.870和3.419,5.808,17.517,大小均为40×40×40,保留对接的优势构像10个,其他参数采用默认值。对接得到的酞菁锌小分子和受体HSA所形成的复合物体系,采用杂化的量子力学/分子力学(QM/MM)方法进行结构优化(Gaussian 09计算关键字为ONIOM)。复合物体系中,酞菁锌小分子被设置为高层并以半经验的PM6方法进行处理,剩余部分则分别由低水平AMBER力场处理。此外,在优化含HSA蛋白体系前,均加入适当数量的Na+离子,使HSA蛋白维持电中性。酞菁锌分子与HSA的结合能ΔE 的计算如式(4.3)所示:

式中,EHSA 为HSA能量,EZnPc为酞菁锌分子能量,Ecomplex 为复合物能量。
2 结果与讨论
图2是ZnPc与HSA的IIA域对接结果。由图可看出ZnPc衍生物进入了HSA的IIA域疏水口袋,并形成了稳定的复合物。酞菁分子都呈风车型,有一个中心平面酞菁环和四条柔性侧链,其中三个分子的中心酞菁环部分相同,而侧链基团不同。分析三个酞菁锌分子与HSA的结合模型,三个小分子的中心平面酞菁环均插入HSA的同一位置,而四条柔性的侧链则在相应结合区域与氨基酸残基产生相互作用而发生一定的弯曲扭转。三个酞菁锌分子结合到HSA的IIA位点后:小分子的酞菁环结合到HSA的IIA与IIIA两个区域之间;小分子上的四条侧链中的两个侧链插入HSA的空腔,其中一个侧链插入site I位点,另一个结合插入到HSA的IIA与IIIA两个区域之间;小分子的另外两个侧链则向HSA外伸展并结合在HSA的其他疏水表面。三个酞菁锌分子插入HSA内部的两个侧链基团所处的位置一致,由于插入空腔较小,而侧链基团较大,两者的空间位阻作用使柔性的侧链无法向其他位置伸展,发生一定弯曲扭转结合在HSA内部。
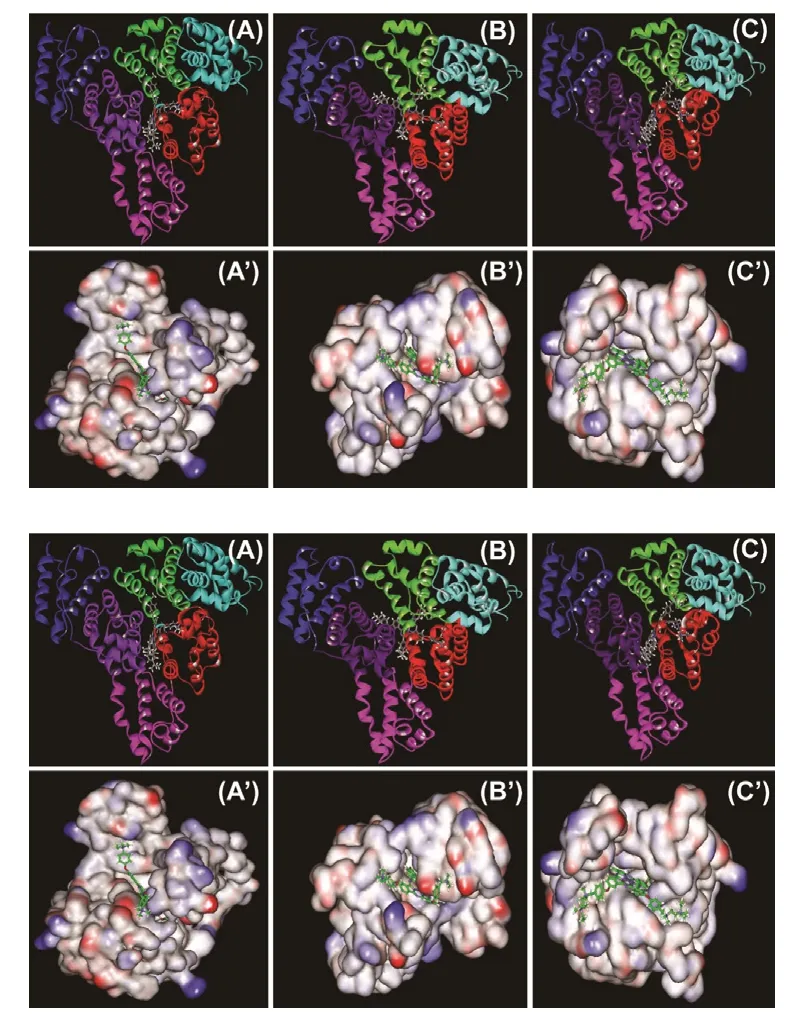
图2(A)ZnPc与HSA分子对接结果示意图,(A’) ZnPc在HSA活性口袋的界面图(HSA用界面图表示,红色表示负电荷,蓝色表示正电荷),表面电荷范围为–0.1~ 0.1 e.
为进一步研究酞菁锌分子与HSA的结合机制,我们对酞菁锌分子与HSA结合后与其周围氨基酸残基的相互作用进行分析(图3):酞菁锌分子结合到HSA的site I位点后,酞菁环的中心位于氨基酸残基GLU292,VAL293,GLU294前方;插入site I位点的侧链,结合到含Trp 214的螺旋附近,插入到IIA与IIIA之间的侧链结合到Tyr 150所在的螺旋附近。表1列出了与酞菁锌分子作用距离为3 Å的内部氨基酸残基和空腔外部氨基酸残基,可以看出随着侧链基团体积的增加,与酞菁锌分子作用的氨基酸残基数目也增加。此外,随着酞菁分子与HSA的相互作用的基团增多,两者间的空间位阻也会不断增大,反而可能会削弱了酞菁锌分子与HSA的结合,导致结合能降低。而向外伸展的两个侧链基团则空间位阻相对较小,侧链基团可以柔性伸展,结合位置有所不同。
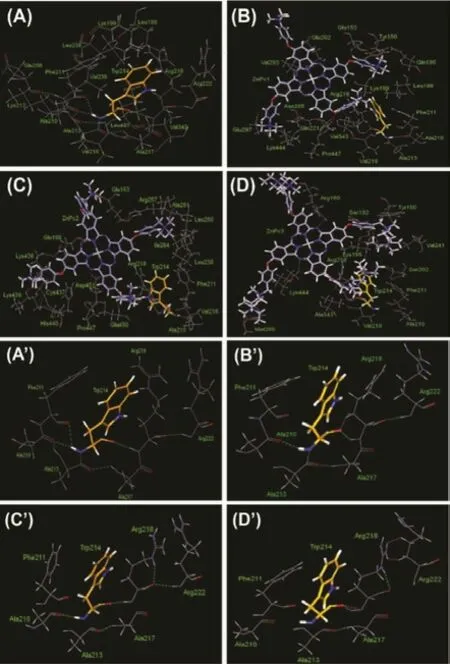
图3(A)HSA分子IIA域内Trp214残基周围氢键;(B)ZnPc掺杂后HSA分子IIA域内Trp214残基周围氢键变化情况

表1 ZnPc3Å范围内的氨基酸残基
Trp 214位于HSA中IIA空腔中的一个α螺旋中部,是HSA中唯一的色氨酸残基,实验中可通过测定Trp 214光谱变化来测定小分子与HSA的site I位点的相互作用。因此通过分子模拟研究ZnPc衍生物与Trp 214的相互作用可以很好地解释光谱实验结果。
从图3上可以看出,在ZnPc-HSA复合物中,酞菁锌中插入site I的侧链与HSA上的疏水氨基酸Trp 214相邻,表明酞菁锌小分子的疏水侧链与HSA的Trp 214残基之间可能存在疏水作用。另外,由于Trp 214残基侧链N原子带负电荷,而与之相邻的酞菁锌侧链上的季铵阳离子带正电荷,表明酞菁锌小分子与HSA的Trp 214残基之间可能存在静电作用。此外,在ZnPc-HSA复合物体系结构中,小分子和HSA之间没有形成氢键。综上所述,根据ZnPc-HSA复合物结构可知,小分子与HSA的Trp 214之间可能主要存在疏水作用和静电作用。
酞菁锌的四条侧链均带有正电荷的季铵阳离子(图4)。故ZnPc与Trp 214残基之间的产生了静电作用,可能对Trp 214残基的荧光光谱产生影响。Trp 214残基与酞菁锌分子相邻部分的分子表面带较大负电荷。与HSA结合后,Trp 214静电势的分布并没有明显变化,但其最小负电势在不断增加,HSA、HSA-体系中Trp 214残基的最小负电势分别为-47.104和-46.587。表明HSA与酞菁锌分子结合后,酞菁锌与Trp 214残基相互之间存在静电作用。

图4 ZnPc分子的静电势图
综上所述,酞菁锌衍生物分子掺杂人血白蛋白时主要通过一条侧链插入人血白蛋白HSA的IIA位点,使得Trp 214残基附近的结构和环境发生改变。两者间有较强的相互作用,主要包括疏水作用和静电作用。此外,结合能计算结果表明酞菁锌分子可结在HAS的IIA和IIIA区域,且掺杂后形成了稳定的复合物。

