水氮耦合氧灌对温室辣椒土壤肥力及细菌群落的影响
雷宏军,肖哲元,张振华,金翠翠,潘红卫,孙克平,席海鹏
水氮耦合氧灌对温室辣椒土壤肥力及细菌群落的影响
雷宏军1,肖哲元1,张振华2,金翠翠1,潘红卫1,孙克平1,席海鹏1
(1. 华北水利水电大学水利学院,郑州 450046;2. 鲁东大学资源与环境工程学院,烟台 264039)
为揭示水氮耦合氧灌对温室辣椒土壤肥力、细菌多样性及群落的影响,该研究设置施氮量(225和300 kg/hm2)、通气量(通气比率为15%和0)和灌水量(0.6和0.9倍作物-蒸发皿系数)3因素2水平试验,采用高通量测序等方法研究土壤细菌群落与土壤通气性指标、土壤肥力因子之间的关系。结果表明,低水量常氮氧灌和高水量常氮氧灌条件下,果实膨大期灌水后3 d的土壤溶解氧、土壤呼吸和氧化还原电位分别较不加氧对照组增加16.73%、38.78%、26.04%和18.58%、46.58%、29.09%(<0.05)。低水量低氮氧灌和高水量低氮氧灌条件下,土壤可溶性有机碳、硝态氮含量较不加氧对照组分别增加26.40%、28.22%和19.67%、18.46%(<0.05);低水量常氮氧灌和高水量常氮氧灌条件下,土壤可溶性有机碳、硝态氮含量较不加氧对照组分别增加20.38%、19.25%和17.49%、17.93%(<0.05)。Shannon、Pielou-e指数表明,加氧处理可显著提高细菌群落多样性和均匀性,而高水量和常氮处理只提高细菌群落均匀性(<0.05)。常氮高水量下,加氧处理的硝化螺旋菌属(硝化作用)和芽孢杆菌属(固氮作用)相对丰度较对照增加24.24%和20.11%,而土微菌属(反硝化作用)相对丰度较对照降低22.66%;加氧低水量下,常氮处理的硝化螺旋菌属和芽孢杆菌属相对丰度较对照增加22.95%和34.12%(<0.05)。高水量低氮和常氮条件下,加氧处理的放线菌门相对丰度较对照增加16.84%和13.37%;高水量常氮条件下,加氧处理的-变形杆菌较对照降低15.75%(<0.05)。土壤呼吸、Eh与Shannon指数、硝态氮含量、硝化螺旋菌属和芽孢杆菌属呈显著正相关,与-变形杆菌呈显著负相关。综上,水氮耦合氧灌能有效改善土壤通气性改变细菌群落结构,提升土壤肥力,为设施蔬菜水肥高效利用提供理论依据。
灌溉;水;土壤;水氮耦合氧灌;土壤肥力;温室辣椒
0 引 言
土壤通气状况是除土壤水分、养分外影响作物生长最主要土壤环境因子之一[1],良好的通气状况对作物生长发育至关重要。地下滴灌过程灌溉水渗入将土壤空气驱离植物根系常会遭受低氧胁迫,影响根系生长发育[2],进而降低水分和养分的吸收,造成ATP(Adenosine Triphosphate)的减少和脱落酸堆积,使溶质在细胞膜内的运输受阻造成气孔关闭、影响植物正常的生理功能[3-4]。Li等[5]研究发现,通过向土壤通气有可能改善低氧条件,对甜瓜和番茄的生长均有积极影响,且甜瓜和番茄的干物质量随通气频率的增加而增加。土壤呼吸消耗氧气,由此造成的不同气体含量梯度为驱动力的土壤中气态氧的扩散,伴随着土壤呼吸向大气中释放CO2是土壤通气的主要机制[6]。通过微纳米气泡的形式将富含空气或氧气的水运到作物的根区,可有效改善通气条件和土壤含氧量[7]。人工通气也可以改善植物根区环境,增加微生物丰度,促进养分吸收,从而促进植物生长和果实产量[8]。根际加气能有效提高根区土壤酶活性,改善根际土壤环境,提高根系有氧呼吸,促进作物生长发育,实现提质增产[9-10]。
土壤微生物在土壤物质转化和能量流动中起重要作用。植物生长发育和土壤养分吸收利用与微生物的活动紧密关联[11]。地下滴灌显著改变了土壤细菌群落结构,提高氮磷代谢细菌的相对丰度,促进了植株干物质的积累[12]。Zeng等[13]研究表明,氮肥的施入对土壤细菌丰富度有直接影响,并通过土壤酸化和植物群落变化间接影响细菌群落组成,对土壤细菌多样性和群落组成有明显的控制作用。土壤中氧气含量是影响微生物群落的因素之一,需氧型和兼性厌氧型微生物大量分布在作物根系周围,随着土壤中溶解氧浓度的增加,需氧菌和兼性厌氧菌的数量和活性得到有效的繁殖,而专性厌氧菌的数量和活性则受到抑制[14-15],从而使土壤细菌多样性和群落结构组成发生改变。土壤通气可以有效改善番茄生长所处的低氧环境,同时改变土壤细菌群落的多样性、组成和结构,有利于根系生长[16]。Zhou等[17]研究发现,微纳米气泡水灌溉能提高土壤肥力和甘蔗产量,并且与土壤细菌群落多样性的变化有关。综上,当前研究主要集中在加气灌溉通过改变根际土壤微生物群落多样性及结构组成进而影响土壤肥力和作物生长等方面,而对水氮耦合氧灌条件下根际土壤微生物群落结构对土壤通气性和土壤肥力间的响应及相关性研究较少。本试验以温室辣椒为供试对象,结合高通量测序技术,研究不同通气量、灌水量和施氮量协同作用下土壤通气性与细菌群落结构和土壤养分的变化效应,进一步分析根际土壤细菌群落、土壤养分与土壤通气性之间的关系,旨在为水氮耦合氧灌模式下进一步优化设施土壤微环境,实现蔬菜优质高产提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2019年9月11日—2019年12月26日在河南省郑州市华北水利水电大学农业高效用水实验场现代化温室中进行(34°47′5.91″N,113°47′20.15″E)。温室建筑总面积为537.6 m2,开间为4 m,跨度为9.6 m;玻璃温室南面、北面分别装有风机和湿帘,以调节室内温度和空气湿度。辣椒生育期内气温及湿度变化见图1。
1.2 试验材料
试验供试土壤为黏壤土,0~40 cm土壤按每10 cm土层取样,平均土壤容重为1.38 g/cm3。剖面土壤质地均匀,砂粒(>0.02 mm)、粉粒(0.002~0.02 mm)和黏粒(<0.002 mm)质量分数分别为32.99%、34.03%和32.98%。表层土壤pH值为6.51,田间持水率(质量含水率)为28.0%。辣椒种植前,0~20 cm土层有机质质量分数为22.41 g/kg,全氮、全磷和全钾质量分数分别为1.02、0.86和29.54 g/kg。供试辣椒品种为“豫艺鲜辣8号”。供试肥料为全水溶型肥料施乐多(硝态氮为7.1%,铵态氮为1.1%,脲态氮为6.9%,P2O5为15%,K2O为30%,螯合态微量元素Fe为0.1%,Mn为0.05%,Zn为0.15%,Cu为0.05%,Mo为0.05%,B为0.1%,中国康拓肥料有限公司)。
1.3 试验设计
试验采用完全随机区组设计,设置施氮量(低氮和常氮)、通气量(不加氧和加氧)和灌水量(低水量和高水量)3因素2水平,共8个处理,每个处理4次重复。试验设计见表1。
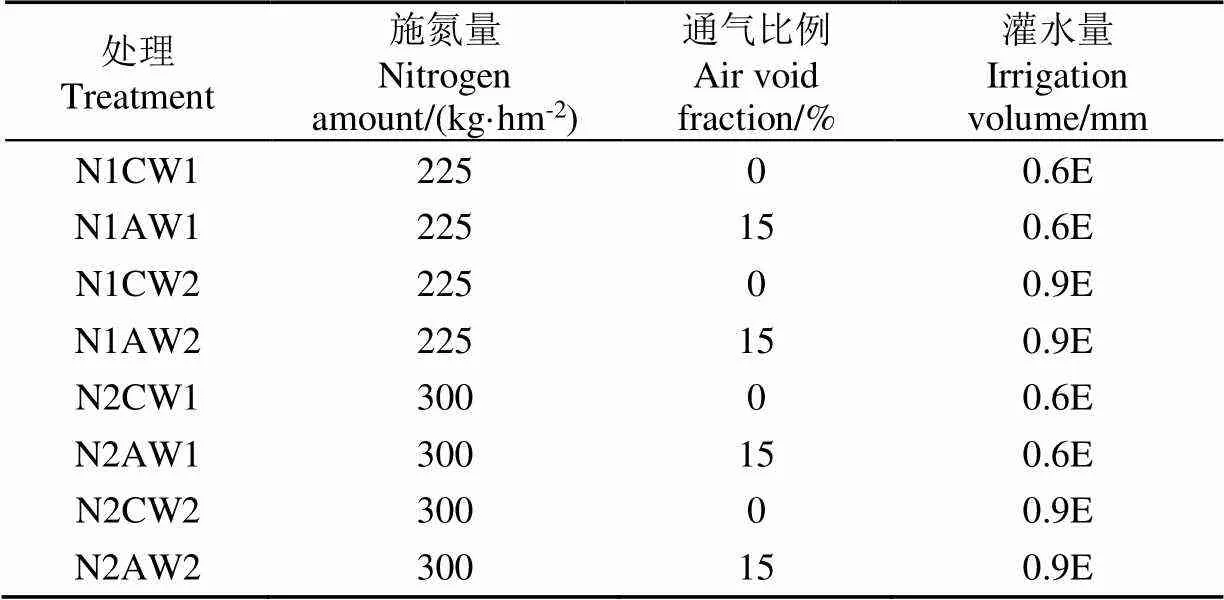
表1 试验设计
注:N1、N2分别为低氮和常氮处理,C、A分别为不加氧和加氧处理,W1、W2分别为0.6倍和0.9倍作物蒸发皿系数,对应于低水量和高水量处理,E为601蒸发皿水面蒸发量,下同。
Note: N1, N2 are the low and normal nitrogen fertilization application rate; C, A are the non-aerated and aerated drip irrigation treatment; W1, W2 are 0.6 and 0.9 times of crop-pan coefficient, respectively, corresponding to low and high soil humidity treatments; E is water surface evaporation of pan601. The same below.
1.4 试验管理
试验区域共设32个小区,小区长2 m,宽1 m,小区面积2 m2。小区内起垄种植辣椒,垄高15 cm,垄宽60 cm,每垄定植6株,株距33 cm。小区内采用地下滴灌供水方式,滴灌带型号为JOHN DEERE,直径为16 mm,壁厚为0.6 mm,埋深为15 cm,滴头额定流量为1.2 L/h,滴头间距为33 cm,额定工作压力为0.10 MPa。植株距离滴头10 cm,平行于滴灌带种植。定植时间为2019年9月11日,选取长势相同的辣椒苗进行移栽,定植时浇透底水,定植后12 d覆膜,为防止水分侧渗,垄与垄之间用塑料膜隔开。辣椒全生育期共计107 d,生育期划分为:苗期(2019-09-11—2019-09-28)、开花坐果期(2019-09-29—2019-10-30)、果实膨大期(2019-10-31—2019-11-30)、成熟期(2019-12-01—2019-12-26)。
试验用文丘里施肥器将水溶型肥料施乐多掺入水流,在制水罐中混匀,通过地下滴灌系统供水,分别于移植后23、32、44、53、63、72、85 d进行施氮,7次施氮的比例为2:3:2:2:3:2:1,N1处理施氮225 kg/hm2,N2处理施氮300 kg/hm2。不加氧处理利用首部供水装置进行供水。加氧处理利用文丘里空气射流器(Mazzei air injector 684,美国Mazzei Corp公司)进行加氧,试验中利用储水管路、循环泵、文丘里空气射流器等设备制得通气比率15%的加气水(循环曝气20 min)[18]。各小区通过地下滴灌系统分别供水,供水压力为0.10 MPa,采用滴水计量器计量灌水量。试验中灌水下限根据距离植株径向10 cm、纵向20 cm埋深处的张力计(12型分体式张力计,中国农业科学院农田灌溉研究所)确定。土壤基质势下限控制在(−30±5)kPa,结合埋深20 cm土壤湿度监测结果确定[19]。灌水量根据式(1)计算[20]:
=·E·K(1)
式中为灌溉水量,mm;为小区控制面积,2 m2;E为1个灌水周期内601蒸发皿的蒸发量,mm;K为蒸发皿系数,W1处理取0.6,W2处理取0.9。灌溉时间及灌水量见表2。

表2 作物生育期内灌水量
1.5 试验取样及测定方法
1.5.1 土壤通气性测定
于辣椒果实膨大期选择1个完整的灌水周期进行监测,测定时间为每天的9:00和15:00。预试验结果表明,选择距离植株茎秆横向5 cm,深度20 cm处埋设参比电极和铜电极,利用氧化还原电位测量仪(上海仪电科学仪器股份有限公司,中国)测定土壤氧化还原电位(oxidation-reduction potential,Eh)。采用光纤微氧传感器测定土壤溶液溶解氧浓度(OXY4-mini,德国Presens公司),测定前将探针埋设于土壤中,探针埋设距植株茎秆横向为5 cm,深度为10 cm,测量时待数据稳定后(约5 min)自动保存数据,然后手动切换到下一连接探头,直至测量结束。采用土壤呼吸测量系统(ADC LCi-SD,英国Delta-T公司)测量土壤呼吸,提前1 d选择每垄靠近中间的2株长势均匀的临近植株间埋设土壤呼吸室底座,测量稳定后(约1~3 min)读数。
1.5.2 根际土取样
果实收获后剪去辣椒地上部分,以50 cm × 40 cm矩形区域挖掘整体取出根样,采集一部分土样用于测定土壤化学性质,另将根系间大块土壤去除,用力抖落收集附着在根系上的土壤,再用毛刷轻刷并去除土中可见的根系残茬,充分混匀后装入无菌离心管中用于16S rRNA高通量基因测序。
1.5.3 土壤化学性质测定
利用2 mol/L KCL溶液浸提土样,硝态氮(NO3--N)利用紫外分光光度法测定,铵态氮(NH4+-N)利用靛酚蓝比色法测定;采用重铬酸钾—容重法测定土壤可溶性碳(DOC)含量。测定方法参照鲁如坤[21]。
1.5.4 土壤DNA提取和测序
使用OMEGA M5635-02试剂盒提取样品基因组DNA,并通过1.2%琼脂糖凝胶电泳检测DNA提取质量,在离心管中使用无菌水稀释样品至1 ng/L。以稀释后的基因组DNA为模板,使用带有条形码(Barcode)的特异引物对细菌16S rRNA基因的V3-V4区进行PCR扩增。选择通用引物(338F:ACTCCTACGGGAGGCAGCA,806R:GGACTACHVGGGTWTCTAAT)为细菌基因V3-V4区引物。PCR扩增采用全式金公司的Pfu高保真DNA聚合酶,确保同批样本扩增条件一致。PCR扩增体系(25L):5×reaction buffer 5L,5×GC buffer 5L,dNTP(2.5 mM)2L,Forwardprimer(10M)1L,Reverseprimer(10M)1L,DNA Template 2L,ddH2O 8.75L,Q5 DNA Polymerase 0.25L。PCR扩增条件为:98 ℃初始变性2 min,25~30个循环包括(98 ℃,15 s;55 ℃,30 s;72 ℃,30 s;72 ℃,5 min),之后进行PCR产物的混样和纯化,纯化后进行文库的构建和上机测序。
1.5.5 测序数据分析
使用Illumina MiSeq测序平台对群落DNA片段进行双端测序,通过质量初筛的原始序列按照index和Barcode信息,进行文库和样本划分,并去除barcode序列。通过QIIME2软件生成有效序列[22],利用dada2算法[23]对序列进行质量过滤,去噪,合并和去除嵌合体等,质控后产生的每个去重的序列为特征序列。使用QIIME2软件计算细菌群落结构及多样性。选用Greengenes数据库[24]对OTUs代表序列进行物种注释分析,统计样本群落组成。
1.6 统计分析
采用Excel 2016进行数据处理和绘图,数据采用平均值±标准差的形式表示,通过SPSS 22.0统计软件进行皮尔森相关分析,用邓肯新复极差法进行显著性检验和交互作用方差分析,用origin 2018绘制各分类学水平下的群落结构柱状图。
2 结果与分析
2.1 水氮耦合氧灌对土壤通气性的影响
图2为辣椒果实膨大期不同处理土壤溶解氧浓度(Dissolved Oxygen,DO)、氧化还原电位(Eh)和土壤呼吸(Soil Respiration,Rs)的动态变化,预试验结果表明,不同施氮水平对土壤通气性无显著影响,故选择常氮施肥水平进行分析。不同处理土壤DO均呈现灌水后下降,之后逐步回升的趋势(图2a)。其中,处理N2AW2最高,N2CW1最低。灌水后第1天下午,处理N2AW1和N2AW2的土壤DO较N2CW1和N2CW2分别增加16.73%和18.58%(<0.05)。加氧处理对土壤呼吸有显著增强效果,在灌水后第2天下午最为明显,处理N2AW1和N2AW2较N2CW1和N2CW2显著增加38.78%和46.58%(<0.05)(图2b)。灌水后不同处理土壤Eh均降至最低,之后逐步回升,各处理回升速度相差不大,灌水后第3天下午处理N2AW1和N2AW2较N2CW1和N2CW2显著增加26.04%和29.09%(<0.05)(图2c)。本试验中,不同灌水量对土壤DO、Eh和土壤呼吸均无显著影响。
2.2 水氮耦合氧灌对根际土壤化学性质的影响
由表3可知,施氮量的提高能显著增加土壤DOC、硝态氮、铵态氮含量,通气量的提高能显著增加了土壤DOC和硝态氮含量。N1水平下,处理AW1和AW2的DOC含量较CW1和CW2分别增加26.40%和28.22%,土壤硝态氮含量增加19.67%和18.46%;N2水平下,处理AW1和AW2的DOC含量较CW1和CW2分别增加20.38%和19.25%,土壤硝态氮含量增加17.49%和17.93%(<0.05)。
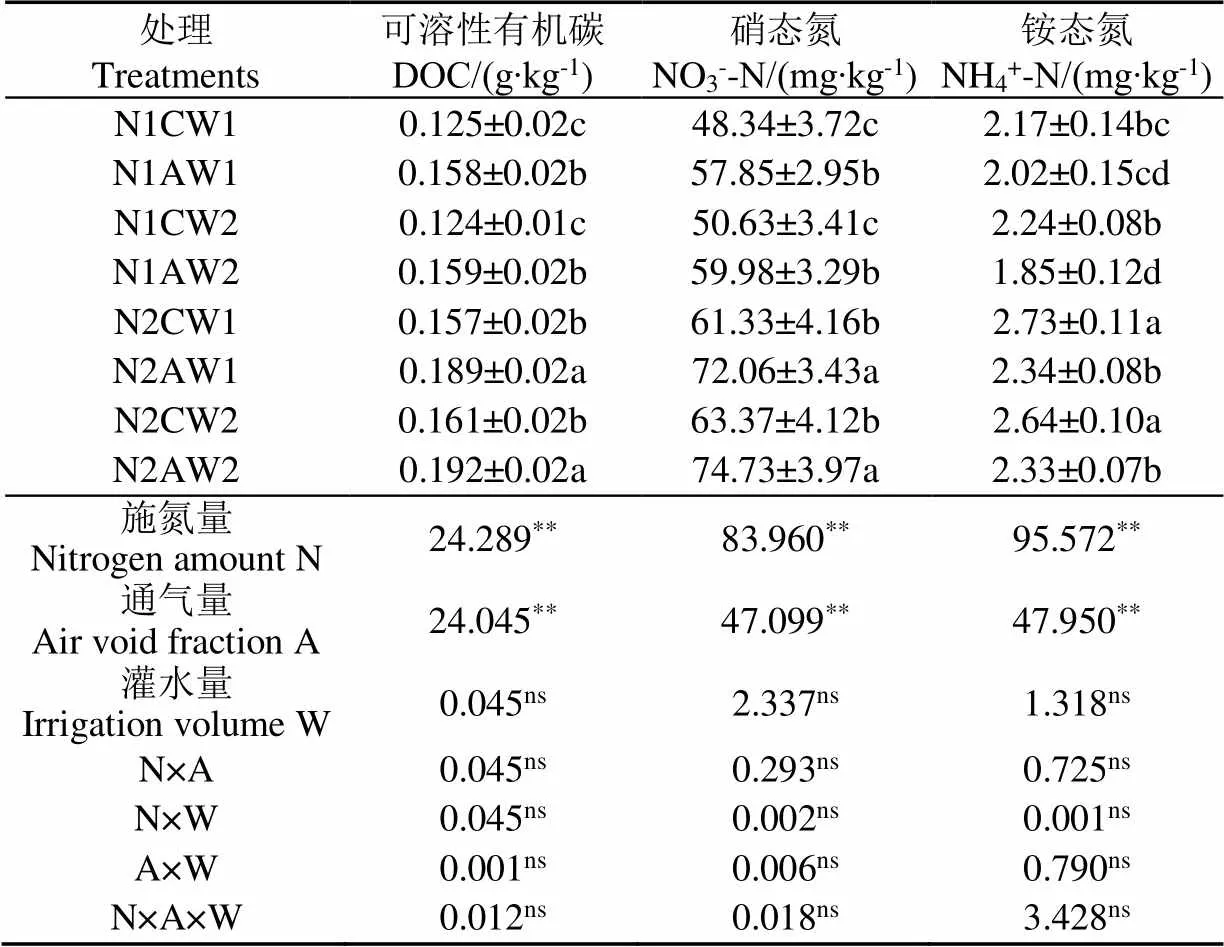
表3 不同水氮耦合氧灌处理对根际土壤化学性质的影响
注:同列数据后不同小写字母表示<0.05水平存在显著性差异,*和**分别表示<0.05和<0.01水平存在显著性差异,ns表示<0.05水平不存在显著性差异,下同。
Note: The different letters indicates significant differences at the level of<0.05, * and ** respectively indicate that there is a significant difference at<0.05 and<0.01 levels, ns indicates that there is no significant difference at<0.05 level, same as below.
N2水平下,处理CW1、AW1、CW2和AW2的土壤DOC含量较N1相应处理分别增加25.60%、19.62%、29.84%和20.75%(<0.05),土壤硝态氮含量较N1相应处理分别增加26.87%、24.56%、25.16%和24.59%(<0.05)。N1水平下,处理AW2较CW2的铵态氮含量降低17.41%;N2水平下,处理AW1和AW2的铵态氮含量较CW1和CW2降低14.28%和11.74%(<0.05)。N2水平下,处理CW1、AW1、CW2和AW2的铵态氮含量较N1相应处理分别增加25.80%、15.84%、17.85%和25.95%(<0.05)。交互作用分析可知,单因素下施氮量和通气量对各土壤化学指标均有极显著影响;多因素交互作用对各化学指标均无显著影响。
2.3 水氮耦合氧灌对根际土壤细菌多样性的影响
土壤细菌群落-多样性指标包括Chao1、Pielou-e、Shannon和Simpson等指数,本文拟采用Shannon和Pielou-e指数表征土壤细菌群落多样性和均匀性(图3)。
由图3可知,不同灌水量和施氮量对Shannon指数无显著影响(>0.05)。加氧处理的Shannon、Pielou-e指数均显著高于不加氧处理(<0.05);处理N1AW2和N1CW2的Pielou-e指数显著高于N1AW1和N1CW1(<0.05);处理N2CW1和N2AW1的Pielou-e指数显著高于N1CW1和N1AW1(<0.05)。说明通气量的提高是显著影响辣椒根际土壤细菌多样性和均匀性的重要因素,不同灌水量和施氮量对细菌多样性无显著影响,但不同通气水平下,低氮高水量和常氮低水量处理能显著影响细菌均匀性。
2.4 水氮耦合氧灌对细菌群落的影响
图4给出了不同处理辣椒根际土壤细菌群落门和纲水平物种的相对丰度(图4)。门水平上相对丰度前5的优势群落为变形菌门()(36.01%)、放线菌门()(19.67%)、芽单胞菌门()(13.36%)、绿弯菌门()(9.15%)和酸杆菌门()(9.02%),累计占比87.21%。图4a表明,处理N2AW1、N2AW2较N2CW1、N2CW2变形菌门的相对丰度增加5.70%和4.92%(<0.05);处理N1AW2、N2AW2较N1CW2、N2CW2的放线菌门相对丰度增加16.84%和13.37%(<0.05);与N1CW2和N2CW2相比,处理N1AW2和N2AW2的酸杆菌门相对丰度增加21.65%和29.47%(<0.05);N1AW2、N2AW1处理的酸杆菌门相对丰度较N1AW1、N2AW1增加24.21%和28.13%(<0.05);与N1CW1相比,处理N1CW2的放线菌门相对丰度降低13.68%(<0.05);处理N2AW2的变形菌门相对丰度较N1AW2增加15.32%(<0.05)。
纲水平上(图4b)相对丰度前5的细菌由高到低为-变形杆菌()(16.10%)、-变形杆菌()(13.29%)、放线菌()(9.98%)、芽单胞菌()(7.47%)和-变形杆菌()(6.58%)。处理N2AW2的-变形杆菌相对丰度较N2CW2降低15.75%(<0.05);与N2CW1、N2CW2相比,N2AW1和N2AW2处理的-变形杆菌和-变形杆菌相对丰度分别增加24.17%和23.73%(<0.05);与N1AW1相比,N2AW1处理的-变形杆菌相对丰度增加17.32%(<0.05)。
2.5 水氮耦合氧灌对氮代谢相关菌属的影响
由表4可知,硝化螺旋菌属、土微菌属和芽孢杆菌属是与氮代谢相关的菌属。与处理N2CW2相比,N2AW2的硝化螺旋菌属()相对丰度增加24.24%(<0.05);处理N1AW1、N2AW2较N1CW1、N2CW2的土微菌属()相对丰度分别降低27.05%和22.66%(<0.05);处理N1AW2、N2AW2较N1CW2、N2CW2的芽孢杆菌属()相对丰度分别增加24.85%和20.11%(<0.05);与处理N1AW1相比,N2AW1的硝化螺旋菌属()相对丰度增加22.95%(<0.05);处理N2AW1较N1AW1的芽孢杆菌属()相对丰度增加34.12%(<0.05)。交互作用分析表明,单因素下,施氮量对硝化螺旋菌属、芽孢杆菌属有极显著影响,通气量对硝化螺旋菌属、土微菌属、芽孢杆菌属有极显著影响,灌水量对硝化螺旋菌属有显著影响;两因素互作下,施氮量和灌水量对土微菌属有显著影响;三因素互作对氮代谢菌属均无显著影响。
2.6 土壤呼吸、Eh、肥力因子和细菌群落的相关分析
因本试验土壤微生物样品取自辣椒收获阶段,故与收获前一个灌水周期所测土壤通气性指标进行相关分析。由表5可知,土壤Eh与土壤呼吸、Shannon指数、土壤NO3--N、硝化螺旋菌属和芽孢杆菌属呈正相关(<0.01),与放线菌门呈正相关(<0.05),与土壤NH4+-N、-变形杆菌呈负相关(<0.05),与土微菌属呈负相关(<0.01);土壤呼吸与Shannon指数、土壤NO3--N、硝化螺旋菌属呈正相关(<0.01),与芽孢杆菌属呈正相关(<0.05),与土壤NH4+-N、土微菌属呈负相关(<0.05);Shannon指数与土壤NO3--N、放线菌门、硝化螺旋菌属和芽孢杆菌属呈正相关(<0.01),与-变形杆菌、土微菌属呈负相关(<0.05);土壤NO3--N与硝化螺旋菌属、芽孢杆菌属呈正相关(<0.01),与土微菌属呈负相关(<0.05);土壤NH4+-N与放线菌门呈负相关(<0.05)。综上,土壤通气性显著影响土壤细菌群落结构和土壤肥力,特别是土壤氮代谢菌属。
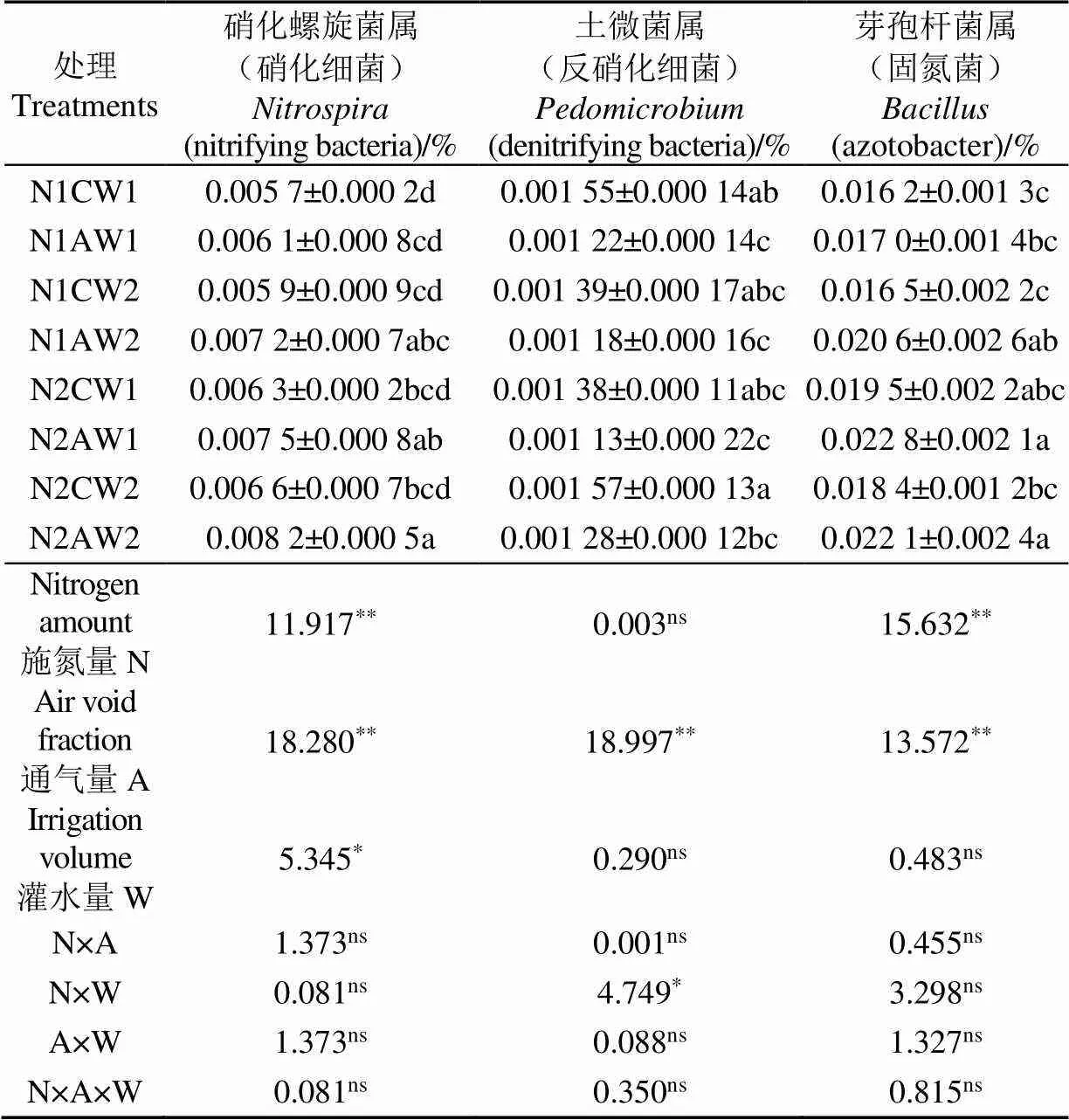
表4 不同水氮耦合氧灌处理对氮代谢菌属相对丰度的影响
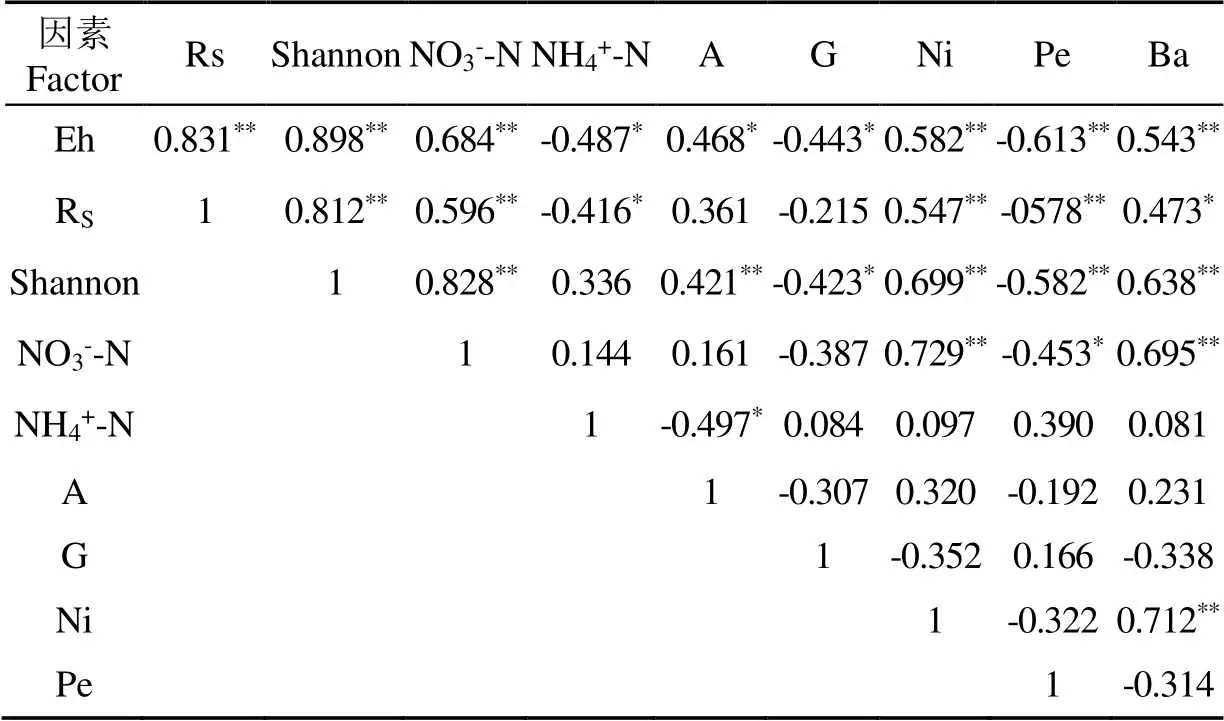
表5 土壤呼吸、Eh、肥力因子和细菌群落的相关分析
注:A,放线菌门;G,-变形杆菌;Ni,硝化螺旋菌属;Pe,土微菌属;Ba,芽孢杆菌属。样品数量为24。
Note: A,; G,; Ni,; Pe,; Ba,. Number of sample is 24.
3 讨 论
3.1 水氮耦合氧灌对土壤通气性的影响
根际土壤水分、养分、通气状况、微生物、酶活性等是影响作物生长发育的主要微环境因素。土壤氧气主要由气相氧和液相氧组成[25],植物在进行有氧呼吸过程中氧气是线粒体电子传递链的受体,是产生ATP的必备条件之一[26]。传统灌溉模式灌溉水分的渗入在提高土壤含水率的同时驱替土壤空气,导致土壤氧气含量下降。本研究中,加氧处理的土壤溶液溶解氧浓度较不加氧处理显著提高(图2)。通过将微气泡水运送到作物根区,有效缓解土壤低氧胁迫,加快气体交换频率增加土壤氧气含量。氧化还原电位能是反应土壤氧化还原状况的指标[27],对调节土壤通气状况起着重要作用。本试验灌水后氧化还原电位均降至最低,之后逐步回升且持续至少24 h以上,加氧较不加氧处理有显著提高,这与臧明等[28]关于高灌水量下增氧处理的氧化还原电位有显著增强结论一致。土壤呼吸是植物、微生物等消耗O2,释放CO2的过程,主要来自作物根系的自养呼吸和土壤微生物的异养呼吸[29]。Bhattarai等[30]研究发现,当土壤孔隙饱和时,气体交换功能会完全停止且会随着土壤孔隙中含水量的增大呈指数形式下降。本试验中,加氧处理对土壤呼吸速率有显著增强效果且在灌水后约24 h最为显著,这与朱艳等[31]关于加气灌溉能有效促进土壤呼吸和植物根系呼吸研究结果相似。而不同灌水量对土壤呼吸无显著影响,可能与高灌水量造成滴头附近土壤易形成饱和湿润区,土壤通气不足造成根系呼吸速率减慢有关。
3.2 水氮耦合氧灌对土壤化学性质的影响
土壤温度和湿度适宜且通气充足时,土壤中好氧微生物更加活跃,可以释放出更多的养分供植物吸收[8]。土壤肥力的提升受土壤养分、微生物、酶活性等多方面因素的影响。Zhou等[17]研究发现,高浓度的微纳米气泡水灌溉能影响细菌群落功能的表达与有效养分含量,进而提高糖料甘蔗的产量。土壤微生物是驱动土壤硝化和反硝化反应的主要因素。硝化反应中铵态氮通过亚硝酸盐转化为硝态氮,由铵态氮氧化成亚硝酸盐是硝化反应的限速步骤[32]。硝化螺旋菌属、土微菌属是属于与氮代谢相关的硝化细菌和反硝化细菌,芽孢杆菌属则具有固氮作用[33]。反硝化菌相对丰度的增加可加快土壤氮的流失[34],但同时固氮菌丰度的升高有利于提高土壤氮素养分[35]。本试验中,常氮高水量下,加氧处理较不加氧处理能显著增加硝化螺旋菌属和芽孢杆菌属,减少土微菌属(图4),土壤铵态氮含量在加氧处理下显著低于不加氧处理。相关分析表明(表5),土壤呼吸、Eh与硝化螺旋菌属和芽孢杆菌属呈正相关,与土壤铵态氮、土微菌属呈负相关。加氧处理在增加与土壤硝化作用相关细菌的过程中加速了土壤铵态氮向硝态氮的转化。常氮处理较低氮处理增加了芽孢杆菌属的丰度,同时提高了土壤铵态氮和硝态氮含量,表明固氮菌的增加有利于提高土壤的固氮能力。本研究中,不同灌水量对土壤化学指标及氮代谢菌属均无显著影响。今后将开展试验对磷、钾等代谢相关菌属做进一步研究。
3.3 水氮耦合氧灌对土壤细菌群落的影响
土壤微生物群落多样性包括结构多样性和功能多样性。其中,群落结构多样性是研究微生物群落的切入点。土壤细菌多样性和群落组成对于土壤生理生化过程起着至关重要的作用[36]。植物根区土壤细菌群落多样性受土壤水分、通气性、温度等环境因子变化的影响,而植物生长发育与细菌对土壤有机质的分解及养分循环利用有紧密关联。赵丰云等[37]研究表明,注气处理和不同土壤深度对土壤细菌群落多样性无显著影响。本研究发现,加氧处理显著改变土壤细菌多样性及均匀性,且土壤Eh与Shannon指数呈正相关(表5)。不同通气水平下,低氮高水量和常氮低水量处理能显著影响土壤细菌的均匀性,而灌水量和施氮量对细菌多样性无显著影响。我们推测,加氧处理引起的富氧环境加速了土壤养分循环利用,营养物质在良好的土壤-氧气环境中更容易分解,促进了好氧细菌的繁殖和活性。而灌水量对细菌均匀性的影响,可能是由于K为0.9时进行加氧灌溉能保证根际土壤充足的水气供应,与K为0.6时的加氧灌溉处理相比,K为0.9水平下加氧灌溉土壤氧气、水分和养分更有利于各种细菌的繁殖。土壤细菌群落结构复杂,常规施氮影响细菌均匀性的原因还需进一步研究。
细菌是土壤微生物中最丰富的类群,绝大多数土壤优势细菌种类基本相同,主要包括10个左右的细菌类群[37]。本试验中,变形菌门相对丰度随施氮量的增加而增加(图4)。已有研究发现,变形菌门可以利用各种有机物在营养丰富的环境中更易受到青睐[38]。放线菌门细菌种群中好氧型细菌占大多数[37],加氧处理改善了土壤透气状况,促进了放线菌门类细菌的增殖。Li等[16]认为,土壤通气可增加土壤中酸性细菌的丰度,这与本试验研究结果一致。-变形杆菌中包含多种植物病原体[16],加氧处理降低了-变形杆菌的相对丰度(图4),相关分析显示土壤Eh与-变形杆菌呈负相关关系,表明加氧处理能够抑制土壤疾病,优化土壤微环境。高水量处理显著降低变形菌门和-变形杆菌的相对丰度,可能与高水量处理下根区土壤周围过于湿润土壤氧气相对不足,土壤中的水分和养分出现匮缺有关。由于土壤细菌群落结构复杂,加氧处理造成的变形菌门、-变形杆菌和-变形杆菌相对丰度增加的原因还需进一步研究。
4 结 论
1)水氮耦合氧灌能有效改善土壤通气性和土壤肥力。灌水后3 d内加氧处理的土壤溶解氧浓度、土壤呼吸和氧化还原电位较不加氧处理显著增强。施氮量的提高能显著增加土壤可溶性碳含量、硝态氮和铵态氮含量,提高通气量能显著增加土壤可溶性碳含量、硝态氮含量,而灌水量对土壤化学性质无显著影响。
2)水氮耦合氧灌能改变根际土壤细菌的多样性和群落结构。Shannon、Pielou-e指数分析表明,加氧处理显著提高土壤细菌多样性和均匀性;不同通气水平下,低氮高水量和常氮低水量处理均能显著提高土壤细菌均匀性,而不同灌水量和施氮量对细菌多样性无显著影响。在门、纲水平,不同灌水量条件下,常氮加氧处理较低氮加氧处理的变形菌门、-变形杆菌的相对丰度分别显著增加15.32%和17.32%。常氮高水量下,加氧处理较不加氧处理能显著增加放线菌门(好氧菌)的相对丰度、抑制-变形杆菌(病原菌)的繁殖。
3)对氮代谢相关菌属分析发现,加氧和常氮处理可促进与固氮相关的芽孢杆菌属,与硝化作用相关的硝化螺旋菌属,且加氧处理能抑制与反硝化作用相关的土微菌属。
[1]Ben-Noah I, Friedman S P. Review and evaluation of root respiration and of natural and agricultural processes of soil aeration[J]. Vadose Zone Journal, 2018, 17(1): 170109.
[2]Armstrong W, Beckett P M, Colmer T D, et al. Tolerance of roots to low oxygen: ‘anoxic’ cores, the phytoglobin-nitric oxide cycle, and energy or oxygen sensing[J]. Journal of Plant Physiology, 2019, 239: 92-108.
[3]Bhattarai S P, Su N, Midmore D J. Oxygation unlocks yield potentials of crops in oxygen-limited soil environments[J]. Advances in Agronomy, 2005, 88: 313-377.
[4]Niu Wenquan, Jia Zongxia, Xuan Zhang et al. Effects of soil rhizosphere aeration on the root growth and water absorption of tomato[J]. Clean-Soil, Air, Water, 2012, 40(12): 1364-1371.
[5]Li Yuan, Niu Wenquan, Cao Xiaoshu, et al. Growth response of greenhouse-produced muskmelon and tomato to sub-surface drip irrigation and soil aeration management factors[J]. BMC Plant Biology, 2020, 20: 141.
[6]Friedman S P, Naftaliev B. A survey of the aeration status of drip-irrigated orchards[J]. Agricultural Water Management, 2012, 115(8): 132-147.
[7]Liu Yaxin, Zhou Yunpeng, Wang Tianze, et al. Micro-nano bubble water oxygation: synergistically improving irrigation water use efficiency, crop yield and quality[J]. Journal of Cleaner Production, 2019, 222: 835-843.
[8]Li Yuan, Niu Wenquan, Wang Jingwei, et al. Effects of artificial soil aeration volume and frequency on soil enzyme activity and microbial abundance when cultivating greenhouse tomato[J]. Soil Science Society of America Journal, 2016, 80(5): 1208-1221.
[9]Li Yuan, Jia Zongxia, Niu Wenquan, et al. Impact of post-infiltration soil aeration at different growth stages of sub-surface trickle-irrigated tomato plants[J]. International Agrophysics, 2016, 30(3): 331-337.
[10]朱艳,蔡焕杰,宋利兵,等. 加气灌溉对番茄植株生长、产量和果实品质的影响[J]. 农业机械学报,2017,48(8):199-211.
Zhu Yan, Cai Huanjie, Song Libing, et al. Impacts of oxygation on plant growth, yield and fruit quality of tomato[J]. Transactions of the Chinese Society for Agricultura Machinery, 2017, 48(8): 199-211. (in Chinese with English Abstract)
[11]Bastida F, Torres I F, Abadía J, et al. Comparing the impacts of drip irrigation by freshwater and reclaimed waste water on the soil microbial community of two citrus species[J]. Agricultural Water Management, 2018, 203: 53-62.
[12]Wang Jingwei, Niu Wenquan, Li Yuan, et al. Subsurface drip irrigation enhances soil nitrogen and phosphorus metabolism in tomato root zones and promotes tomato growth[J]. Applied Soil Ecology, 2018, 124: 240-251.
[13]Zeng J, Liu X, Ling S, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology & Biochemistry, 2016, 92: 41-49.
[14]Pan Junxiao, Zhang Ling, He Xiaoming, et al. Long-term optimization of crop yield while concurrently improving soil quality[J]. Land Degradation & Development, 2019, 30(8): 897-909.
[15]Imlay J A. How oxygen damages microbes: oxygen tolerance and obligate anaerobiosis[J]. Advances in Microbial Physiology, 2002, 46: 111-153.
[16]Li Yuan, Niu Wenquan, Zhang Mingzhi, et al. Artificial soil aeration increases soil bacterial diversity and tomato root performance under greenhouse conditions[J]. Land Degradation & Development, 2020, 31(12): 1443-1461.
[17]Zhou Yunpeng, Bastida F, Zhou Bo, et al. Soil fertility and crop production are fostered by micro-nano bubble irrigation with associated changes in soil bacterial community[J]. Soil Biology and Biochemistry, 2019, 141: 107663.
[18]雷宏军,臧明,张振华,等. 循环曝气压力与活性剂浓度对滴灌带水气传输的影响[J]. 农业工程学报,2014,30(22):63-69.
Lei Hongjun, Zang Ming, Zhang Zhenhua, et al. Impact of working pressure and surfactant concentration on air-water transmission in drip irrigation tape under cycle aeration[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(22): 63-69. (in Chinese with English Abstract)
[19]万书勤,闫振坤,康跃虎,等. 土壤基质势调控对温室滴灌番茄土壤水分分布和产量的影响[J]. 灌溉排水学报,2019,38(5):1-11.
Wan Shuqin, Yan Zhenkun, Kang Yuehu, et al. Using soil matric potential underneath the drip emitter to regulate soil moisture distribution and improve greenhouse tomato production[J]. Journal of Irrigation and Drainage, 2019, 38(5): 1-11. (in Chinese with English Abstract)
[20]雷宏军,杨宏光,刘欢,等. 水肥气耦合滴灌番茄地土壤N2O排放特征及影响因素分析[J]. 农业工程学报,2019,35(11):95-104.
Lei Hongjun, Yang Honguang, Liu Huan, et al. Characteristics and influencing factors of N2O emission from greenhouse tomato field soil under water-fertilizer-air coupling drip irrigation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(11): 95-104. (in Chinese with English Abstract)
[21]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000.
[22]Bolyen E, Rideout J R, Dillon M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37: 852-857.
[23]Callahan B J, McMurdie P J, Rosen M J, et al. DADA2: high-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13: 581-583.
[24]DeSantis T Z, Hugenholtz P, Larsen N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72: 5069-5072.
[25]范爱武,刘伟,李光正. 土壤中热、湿、气及溶质耦合迁移的数学模型[J]. 华中科技大学学报:自然科学版,2005,33(9):59-61.
Fan Aiwu, Liu Wei, Li Guangzheng. Modeling for simultaneous transfer of heat, moisture, gas and solute in soil with plants growing[J]. Journal of Huazhong University of Science and Technology: Natural Science Edition, 2005, 33(9): 59-61. (in Chinese with English Abstract)
[26]Biemelt S, Keetman U, Albrecht G. Re-aeration following hypoxia or anoxia leads to activation of the antioxidative defense system in roots of wheat seedlings[J]. Plant Physiology, 1998, 116(2): 651-658.
[27]Bohrerova Z, Stralkova R, Podesvova J, et al. The relationship between redox potential and nitrification under different sequences of crop rotations[J]. Soil & Tillage Research, 2004, 77(1): 25-33.
[28]臧明,雷宏军,潘红卫,等. 增氧地下滴灌改善土壤通气性促进番茄生长[J]. 农业工程学报,2018,34(23):117-126.
Zang Ming, Lei Hongjun, Pan Hongwei, et al. Aerated subsurface drip irrigation improving soil aeration and tomato growth[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(23): 117-126. (in Chinese with English Abstract)
[29]肖胜生,熊永,段剑,等. 基于组分区分的南方红壤丘陵土壤呼吸对植被类型转换的响应[J]. 农业工程学报,2015,31(14):123-131.
Xiao Shengsheng, Xiong Yong, Duan Jian, et al. Responses of soil respiration to vegetation type conversion in south hilly red soil based on main components[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(14): 123-131. (in Chinese with English Abstract)
[30]Bhattarai S P, Midmore D J, Su N. Sustainable irrigation to balance supply of soil water, oxygen, nutrients and agro-chemicals[M]// Lichtfousee. Biodiversity, Biofuels, Agroforestry and Conservation Agriculture. Netherlands: Springer, 2010: 253-286.
[31]朱艳,蔡焕杰,宋利兵,等. 加气灌溉改善温室番茄根区土壤通气性[J]. 农业工程学报,2017,33(21):163-172.
Zhu Yan, Cai Huanjie, Song Libing, et al. Oxygation improving soil aeration around tomato root zone in greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(21): 163-172. (in Chinese with English Abstract)
[32]Giles M, Morley N, Baggs E M, et al. Soil nitrate reducing processes-drivers, mechanisms for spatial variation, and significance for nitrous oxide production[J]. Frontiers in Microbiology, 2012, 3(407): 1-16.
[33]戴雅婷,闫志坚,解继红,等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报,2017,54(3):735-748.
Dai Yating, Yan Zhijian, Xie Jihong, et al. Soil bacteria diversity in rhizosphere under two types of vegetation restoration based on high throughput sequencing[J]. Acta Pedologica Sinica, 2017, 54(3): 735-748.
[34]Ma Lan, Shan Jun, Yan Xiaoyuan. Nitrite behavior accounts for the nitrous oxide peaks following fertilization in a fluvo-aquic soil[J]. Biology and Fertility of Soils, 2015, 51(5): 563-572.
[35]Taylor A E, Zeglin L H, Dooley S, et al. Evidence for different contributions of archaea and bacteria to the ammonia-oxidizing potential of diverse Oregon soils[J].Applied and environmental microbiology, 2010, 76(23): 7691-7698.
[36]Wagg C, Bender S F, Widmer F, et al. Soil biodiversity and soil community composition determine ecosystem multifunctionality[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111: 5266-5270.
[37]赵丰云,杨湘,董明明,等. 加气灌溉改善干旱区葡萄根际土壤化学特性及细菌群落结构[J]. 农业工程学报,2017,33(22):119-126.
Zhao Fengyun, Yang Xiang, Dong Mingming, et al. Aeration irrigation improving grape rhizosphere soil chemical properties and bacterial community structure in arid area[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(22): 119-126. (in Chinese with English Abstract)
[38]Goldfarb K C, Karaoz U, Hanson C A, et al. Differential growth responses of soil bacterial taxa to carbon substrates of varying chemical recalcitrance[J]. Frontiers in Microbiology, 2011, 2: 94.
Effects of oxygen and nitrogen coupled irrigation on soil fertility and bacterial community under greenhouse pepper cropping system
Lei Hongjun1, Xiao Zheyuan1, Zhang Zhenhua2, Jin Cuicui1, Pan Hongwei1, Sun keping1, Xi Haipeng1
(1,,450046,; 2,,264039,)
Relationship between soil aeration, soil fertility and bacterial community structure was less known so far, particularly under the oxygen and nitrogen coupled irrigation. In this study, a three-factor randomized block experiment was designed with two levels of nitrogen application rate as 225 and 300 kg/hm2, two aeration levels of air void fraction as 15% and 0, and two levels of irrigation amount of 0.6 and 0.9 times of crop/pan coefficient on the experimental farm of North China University of Water Resources and Electric Power (34°47′5.91″N, 113°47′20.15″E), Henan province, China. Taking the greenhouse pepper as test crop, a high-throughput 16S genome sequencing technique was used to investigate the effects of oxyfertigation on soil aeration, soil chemical index, and soil bacterial community in the rhizosphere. The results showed that the oxyfertigation improved significantly the soil aeration, fertility, rhizosphere soil bacterial diversity, and community structure. Compared with non-aeration treatment, the soil dissolve oxygen, soil respiration, and soil redox potential in the treatments of 300 kg/hm2, 15% air void fraction, 0.6 and 0.9 times of crop/pan coefficient increased by 16.73%, 38.78%, 26.04% and 18.58%, 46.58%, 29.09%, respectively on the 3thday after irrigation at fruit expanding period (<0.05). Compared with the non-aeration treatments, the average soil dissolve organic carbon, nitrate content increased by 26.40%, 28.22% under the treatments of 225 kg/hm2nitrogen rate, 15% air void fraction, 0.6 times of crop/pan coefficient, while increased by 19.67%, 18.46% under 225 kg/hm2nitrogen rate, 15% air void fraction, 0.9 times of crop/pan coefficient (<0.05), respectively. Compared with the non-aeration treatments (<0.05), theaverage soil dissolved organic carbon, nitrate increased by 20.38%, 19.25% in the treatments of 300 kg/hm2nitrogen rate, 15% air void fraction, 0.6 times of crop/pan coefficient, and increased by 17.49%, 17.93% in 300 kg/hm22 nitrogen rate, 15% air void fraction, 0.9 times of crop/pan coefficient, respectively. In nitrogen metabolism, the rhizosphere aeration and high nitrogen application can promote the content of Nitrospira associated with nitrification, andassociated with nitrogen fixation, while inhibit Pedomicrobium associated with denitrifying bacteria under soil aeration. The Shannon and Pielou-e index significantly increased in the aerated treatment, compared with the non-aeration treatment (<0.05). Furthermore, the Pielou-e index significantly increased in the treatment of high irrigation and normal nitrogen rate (<0.05), compared with low irrigation and low nitrogen treatments. In the phylum and class level, the copies of Proteobacteria, Actinobacteria, Acidobacteria, Alphaproteobacteria, and Deltaproteobacteria increased (<0.05), whereas, the abundance of Gammaproteobacteria decreased, in the aerated treatments, compared with the non-aeration treatments (<0.05). The copies of Proteobacteria decreased significantly (<0.05), whereas, the abundance of Acidobacteria increased (<0.05), in the high irrigation treatments, compared with the low irrigation treatment. Theabundance of Proteobacteria and Alphaproteobacteria increased under a high nitrogen rate, compared with low nitrogen rate (<0.05). Correlation analysis showed that the improvement of soil aeration significantly increased the diversity and uniformity of soil bacteria community in the rhizosphere, and the relative abundance of Acidobacteria at the level of phylum, thus to enhance the soil fertility for soil health, while suppress diseases in the soil rhizosphere environment. Therefore, results of this research would provide a theoretical basis for efficient utilization of water and fertilizer in the greenhouse pepper cropping system.
irrigation; water; soil; oxygen and nitrogen coupled irrigation; soil fertility; greenhouse pepper
雷宏军,肖哲元,张振华,等. 水氮耦合氧灌对温室辣椒土壤肥力及细菌群落的影响[J]. 农业工程学报,2021,37(1):158-166.doi:10.11975/j.issn.1002-6819.2021.01.020 http://www.tcsae.org
Lei Hongjun, Xiao Zheyuan, Zhang Zhenhua, et al. Effects of oxygen and nitrogen coupled irrigation on soil fertility and bacterial community under greenhouse pepper cropping system[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(1): 158-166. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.01.020 http://www.tcsae.org
2020-07-16
2020-10-25
国家自然科学基金资助项目(52079052);河南省科技攻关计划(212102110032);山东省重点研发计划重大科技创新工程项目(2019JZZY010710);山东省农业重大应用技术创新项目(SD2019ZZ017);华北水利水电大学研究生创新课题(YK2020-07);国家大学生创新创业训练计划项目(202010078016,2019XA051)
雷宏军,博士,教授,博士生导师,主要从事节水灌溉理论与技术研究。Email:hj_lei2002@163.com
10.11975/j.issn.1002-6819.2021.01.020
S152.7; S275.4
A
1002-6819(2021)-01-0158-09

