金花葵花总黄酮提取条件优化
周宇涵,徐小迪,石其宇,高 君,曹 丽
(延边大学农学院,吉林 延吉 133002)
金花葵(HibiseumanihotL.)别名菜芙蓉、山榆皮,锦葵科秋葵属一年生植物[1]。野生金花葵大多生长在深山崖隙间,主要分布于河北地区[2],是濒临绝种的植物之一。金花葵中含有多种黄酮类化合物,是植物界中天然黄酮含量较高的品种,所含的黄酮类化合物主要有5种,分别是槲皮素-3-洋槐糖苷、金丝桃苷、槲皮素、槲皮素-3-葡萄糖苷、杨梅素[3]。现阶段,黄酮生产中应用较广的原料为大豆、银杏,而这些植物的黄酮含量远远低于金花葵[4]。金花葵能够缓解疼痛、清热解毒,具有提高免疫力、抗衰老氧化、降血压血脂等功效;花蕾晒干后泡水饮用对血管扩张有一定作用;幼果富含植物雄激素,在一定程度上对滋阴壮阳起作用;叶、茎、根等部位制作成面粉食用营养价值极高[5-8]。
黄酮类化合物在植物界中分布广泛,主要存在于植物叶片和果实中,且分子量相对较低,大部分与糖结合成苷类以配基的形式存在,少数以游离形态存在[8]。目前,金花葵总黄酮提取工艺有4种,分别为有机回流法[9]、微波提取法、超声波提取法以及酶解法[10]。前期有多篇文献报道,花类药材采用超声波提取具有提取率高、环保无污染、提取效率快等优点[11-14],因此,该实验选择超声提取方法对金花葵花总黄酮进行提取。金花葵是天然黄酮含量较高的植物品种之一,有研究对金花葵不同部位的总黄酮含量进行考查。夏文宽[15]通过硝酸铝显色法测定金花葵花、根、茎、叶和籽等不同部位中总黄酮的含量得出该花中总黄酮含量最高。危晴和兰蓉[16]利用紫外分光光度法测定籽中总黄酮含量为0.005~0.025 mg/mL,并且浓度与吸光度间线性关系良好,最终得出结论为总黄酮含量为2.08%。吴正超等[17]利用高效液相色谱法测定金花葵花朵中的黄酮物质时,共分离出63个黄酮类物质色谱峰,其中,金丝桃苷含量最多,高达11 320 mg/kg,总黄酮中含量占比为23.31%,已知的芦丁、牡荆素鼠李糖苷、槲皮素均被检测出。金花葵中黄酮含量可能因其产地、采摘时间、气候等原因而存在差异。前期试验中发现,采自长白山地区的金花葵黄酮组分及含量与其它地区存在差异,但对此金花葵中黄酮提取条件尚未进行详尽报道。因此,该研究在单因素试验基础上,通过正交试验设计对延边地区金花葵花提取工艺进行优化,确定最佳提取工艺,为后续探索适合延边地区金花葵生长的栽培方式提供理论基础。
1 材料与方法
1.1 仪器与设备
KQ-250B型超声波清洗器(昆山市超声仪器有限公司)、101-1A型电热鼓风干燥箱(天津市泰斯特仪器有限公司)、高速多功能粉碎机(浙江武义海纳电器有限公司)、RE 52-99 旋转蒸发仪(上海亚荣生化仪器厂)、7230G可见分光光度计(上海精密仪器仪表有限公司)、高效液相色谱仪购自日立高新技术公司的Primaide系统;色谱柱为Promosil C18(4.6 mm×250mm,5 μm)。
1.2 材料
金花葵花样品采自吉林省安图县石门镇金花葵栽培基地。
将新鲜的金花葵花置于干燥箱中60 ℃左右烘干24 h。将烘干后的花打碎成粉末,过筛备用。
1.3 方法
1.3.1 不同提取条件对金花葵花总黄酮含量的影响
参照梅洪睿[18]的方法并稍作修改后展开试验。称取鲜花粉末1 g,在不同乙醇浓度、提取时间、提取温度及料液比等条件下,通过超声法(40 kHz)进行提取,离心后取其滤液,旋转蒸发后转移至50 mL容量瓶中,用相应浓度的乙醇溶液定容,摇匀后备用。在提取时间为30 min,提取温度60 ℃,料液比为1∶20 (g∶mL)的提取条件下,分别选择50%,60%,70%,80%和90%乙醇作为试验条件进行超声提取,以总黄酮含量为指标筛选提取溶剂的最佳浓度;根据确定的最高溶剂浓度80%,确定最佳提取时间,即在温度为60 ℃,料液比1∶20 (g∶mL)的条件下,分别测定20,25,30,35和40 min的提取效果,筛选出最佳的提取时间;再以总黄酮得率最高的30 min作为提取时间,将温度设定为30,40,50,60和70 ℃,在料液比为1∶20 (g∶mL)的条件下进行提取,进行提取温度优化试验;基于前面筛选确定的总黄酮含量处于最高状态时的乙醇浓度为80%、提取时间30 min及提取温度60 ℃为试验条件,分别在料液比1∶15,1∶20,1∶25,1∶30和1∶35 (g∶mL)的条件下进行料液比筛选试验。
1.3.2 提取工艺优化研究
在以上单因素试验结果的基础上,选择乙醇浓度、提取时间、提取温度及料液比,设定4因素3水平L9(34)正交设计试验(正交试验因素水平见表1)后,尝试对提取条件进行多样化的组合(正交表头设计见表2),并测定各种组合条件下的黄酮提取总量,以此为依据确定提取的最佳工艺条件。

表1 L9(34)正交试验因素水平Table 1 Factors and levels of L9 (34)
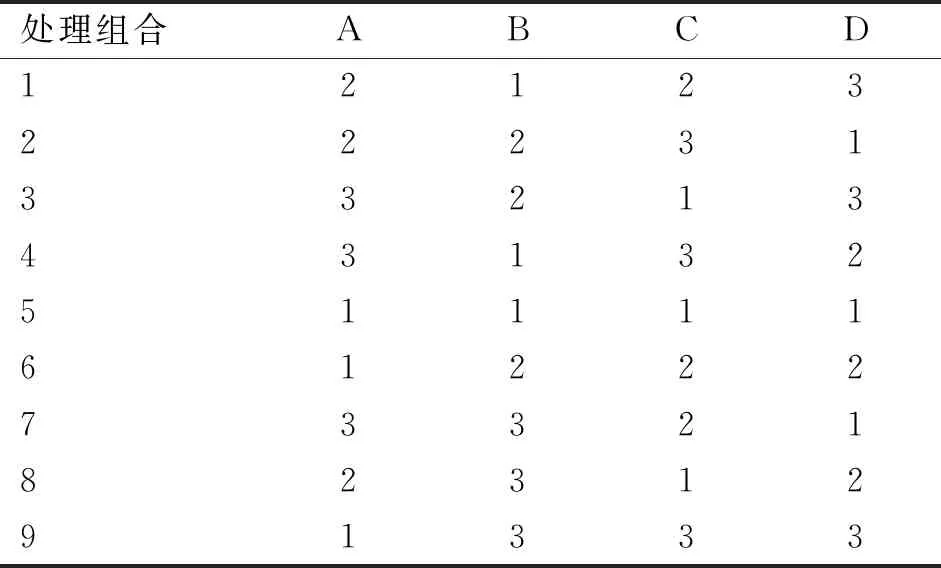
表2 L9(34)正交表头设计Table 2 Factors and levels of L9 (34)
1.4 总黄酮提取率的测定
参照王璐姗等[19]采用分光光度计法并稍作修改后测定总黄酮含量。取3支比色管分别作为空白、样品和样品校正。依次精确吸取0、2.0、2.0 mL样液于3支比色管中,再依次加入60%乙醇溶液至5.0 mL,样品校正管中再加入5.0 mL 60%乙醇溶液定容至10 mL,然后空白及样液依次加入5%Na2NO2溶液0.3 mL,摇匀,静置6 min;加10% Al(NO3)3溶液 0.3 mL,摇匀,静置6 min;加入1 mol/L NaOH 溶液 4.0 mL,去离子水0.4 mL,摇匀,静置15 min,用分光光度计于510 nm波长下测定其吸光度(OD)。通过标准曲线计算出总黄酮的含量。
提取率/%=提取液中黄酮含量/所用金花葵花重量×100%
1.5 黄酮单体物质的测定
色谱条件:流动相为甲醇-0.2%磷酸水溶液(50∶50),流速1.0 mL/min,波长360 nm,柱温35 ℃。配制浓度为1.0 mg/mL的芦丁标准品溶液及0.5 mg/mL的槲皮素标准品溶液,备用。再根据优化后的提取条件,即乙醇浓度80%,提取时间30 min,提取温度60 ℃,料液比1∶25 (g∶mL)条件下提取黄酮类化合物粗提液,4 000 r/min离心6 min,取上清液过0.22 μm微孔滤膜,用于HPLC分析。
通过芦丁和槲皮素标准曲线计算黄酮单体含量。
黄酮单体含量/μg·mL-1= 线性回归方程计算出的样品中总黄酮含量/(进样体积×1/样液稀释后体积)
1.6 数据分析
该试验中利用 SPSS 22.0分析试验数据,显著水平为0.05时,各项处理分别做3次重复。
2 结果与分析
2.1 不同提取条件对总黄酮含量的影响
2.1.1 乙醇浓度
在料液比1∶20 g/mL,不同乙醇浓度(50%,60%,70%,80%和90%),提取时间30 min的条件下,提取温度设定为60 ℃时,研究不同乙醇浓度对总黄酮提取率的影响。乙醇浓度为50%~80%时,总黄酮含量表现出递增的现象,当浓度处于80%时,升至最高水平,之后开始回落,随着乙醇浓度的提高呈递减现象。出现这一现象的原因可能是由于溶质达到一定比例时,总黄酮在乙醇中的溶解达到平衡状态,继续增加溶质的量,反而会增加杂质的溶出,使金花葵花提取物中总黄酮的含量下降(图1)。
2.1.2 提取时间
在乙醇浓度为80%,料液比1∶20 (g∶mL),不同提取时间(20,25,30,35,40 min),提取温度为60 ℃的条件下,研究不同提取时间对总黄酮含量的影响。总黄酮提取率在20~30 min这一时间段呈上升趋势,当提取时间为30 min时,总黄酮提取率最高(7.81%)(图2)。随着提取时间的延长,提取率逐渐下降。产物的浸出程度与提取时间联系紧密,若时间过短产物则会溶解不充分,但时间过长又会造成产物结构发生变化,使样品中总黄酮含量降低。综合考虑,确定30 min为提取的最佳时间。
2.1.3 提取温度
在乙醇浓度为80%,料液比1∶20 (g∶mL),提取时间30 min时,选择不同提取温度(30,40,50,60,70 ℃)来研究总黄酮含量与提取温度的关系(图3)。
由图3可知,总黄酮含量会因为提取温度的上升而提高,在60 ℃时达到最大提取率,随着温度的持续升高,总黄酮含量开始缓慢下降。其原因可能是因为过高的温度在一定程度上对总黄酮的结构造成破坏,因此,60 ℃是提取的最佳温度点。
2.1.4 料液比
不同料液比对提取物中总黄酮含量的影响见图4。
在料液比1∶10,1∶15,1∶20,1∶25,1∶30 (g∶mL),乙醇浓度80%,提取时间30 min,提取温度为60 ℃的条件下,研究在不同料液比条件下样液中总黄酮提取率的变化。当料液比为1∶10 ~1∶20 (g∶mL)时,总黄酮含量显著提高,在料液比为1∶20 (g∶mL)时,总黄酮提取率达到最高(7.81%)。由于随着料液比的减小,使有效成分溶出的速度加快,使总黄酮提取率增高;当料液比在较低状态下,有效成分无法被充分提取。综上所述,确定最佳料液比为1∶20 (g∶mL)。
2.2 正交设计试验提取条件筛选
以单因素试验结果为依据,设计L9(34)正交试验方案,将乙醇浓度(A)、提取时间(B)、提取温度(C)和料液比(D)4个因素进行不同组合,通过研究在这些组合下对总黄酮提取率的影响。正交试验结果见表3。
由表3可知,第2组A2B2C3D1,即在乙醇浓度80%、提取时间30 min、提取温度70 ℃、料液比1∶15 (g∶mL)这一组合中,总黄酮提取率最高(7.98%)。通过对极值R进行比较,分析不同提取条件对总黄酮含量的影响。R值由大到小为提取温度(C)、乙醇浓度(A)、料液比(D)、提取时间(B),这说明对提取率影响最大的因素是提取温度,之后依次是乙醇浓度、料液比和提取时间。计算各因素水平对总黄酮提取率的平均值K,其中,乙醇浓度(A)的K2值最大,提取时间(B)的K1值最大,提取温度(C)及料液比(D)的K3值最大,综上所述,最佳试验组合为A2B1C3D3,即当乙醇浓度80%、提取温度70 ℃、提取时间25 min及料液比1∶25 (g∶mL)的条件下,总黄酮提取率可达到最高。
进一步对设定的4个因素分别进行方差分析,结果表明,乙醇浓度、提取时间、提取温度及料液比均存在显著的差异(表4)。因此,确定优化后的组合为乙醇浓度80%、提取时间25 min、提取温度70 ℃、料液比1∶25 (g∶mL)。以此组合作为试验条件重复3次试验,对总黄酮提取率进行研究。通过表5得到,总黄酮含量在重复的3次试验中并未出现较大的差异,平均提取率为8.03%,相较于正交试验中第2组的提取率(A2B2C3D1,7.98%)略高一些,验证试验结果的RSD(相对标准偏差)是1.23%,说明该结果稳定性较好。综合考察得出,金花葵花中总黄酮提取的最佳提取条件为:乙醇浓度80%、提取时间25 min、提取温度70 ℃、料液比1∶25 (g∶mL)。
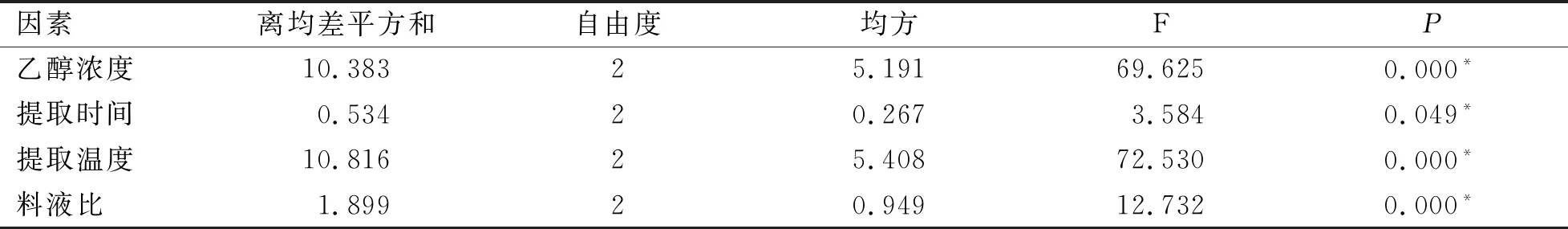
表4 试验方差分析表Table 4 Test analysis of variance table
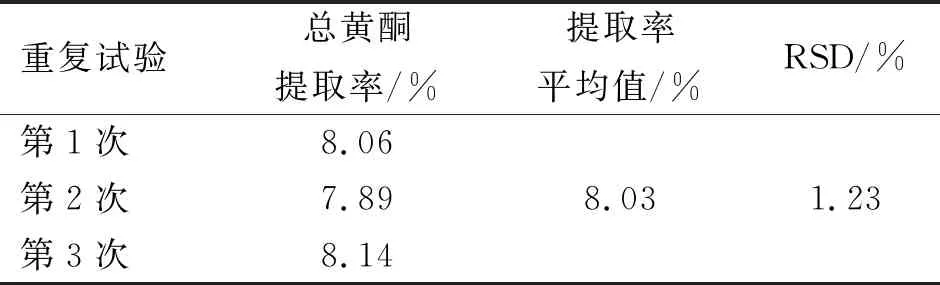
表5 试验结果验证Table 5 Verification of test results
2.3 黄酮单体物质含量
以标准品溶液色谱图为参考,对比样品溶液在相同色谱条件下形成的色谱图,通过一致的保留时间能够明确样品内所含的黄酮类化合物成分;将黄酮类标准品溶液加入到样品溶液中,通过峰高的变化可以进一步明确色谱峰的归属。综合上述方法对金花葵花中黄酮类化合物的组成进行分析,图5和图6分别为2种黄酮标准品和金花葵花提取物在360 nm检测条件下的液相色谱图。从出峰时间来看,芦丁标准品的出峰时间为5.840 min,槲皮素为9.264 min。样品提取液中峰1的出峰时间为5.998 min,与标准品色谱图中芦丁的出峰时间相近,考虑实验操作、仪器等存在误差,可认为峰1为芦丁;同理,可认为出峰时间分别为9.274 min的峰2是槲皮素。对比发现金花葵花中含有芦丁、槲皮素两种黄酮类化合物。根据芦丁及槲皮素标准品线性回归方程,分别计算芦丁及槲皮素含量,其中芦丁含量较高,为114.59 mg/mL,槲皮素含量为14.04 mg/mL。
3 讨论
研究表明,黄酮能明显改善心肌缺血及缩小心梗范围、降低血小板聚集程度、有效抑制凝血和血栓形成,对脑缺血有一定的保护作用[20]。金花葵花中含有多种黄酮类化合物,在200多个秋葵属植物中,其最具食用、药用、保健功能[21]。试验结果显示,延边地区栽培的金花葵黄酮含量与华北地区相比较低,其组份及含量存在差异可能是由于不同的生态条件、地理位置以及遗传性状与其他多种因素共同作用的结果。因此,寻找与金花葵类黄酮合成相关的基因资源,对其进行深入研究,探索基因表达与类黄酮物质积累之间的关系并有效提高其黄酮含量具有深刻的意义。
同种植物的有效成分在不同提取条件下的提取效果不同,探究提取工艺的不断优化,可达到更大程度地获得较高的提取率[22]。宋琳琳[23]用比色皿法测定金花葵中总黄酮含量,利用单因素和正交试验设计筛选最优条件,得出在乙醇浓度为80%、料液比1∶25 (g∶mL)的条件下总黄酮提取率最高,这与该试验中筛选出的乙醇提取浓度以及料液比条件一致。王菲等[24]采用响应面法对金花葵花总黄酮的溶剂提取条件进行优化,试验结果表明,在提取温度为60 ℃时,总黄酮提取率最高,这与该试验中筛选的最佳提取温度70 ℃相似。
随着人们对金花葵的不断研究,发现它的药理功能受到越来越多人的关注,其药用、食用价值都有着巨大的开发利用空间,对金花葵植株所含总黄酮及其化学成分的研究在国内掀起了高潮,且研究成果能够有效的带动延边地区的发展,对金花葵未来的开发及综合利用起到了潜移默化的作用。同时,由于试验条件的影响,收集的金花葵植株及其提取物可能并不完全,后续试验可加强样品的补充,使数据更加全面。
4 结论
当提取条件为乙醇浓度80%、提取时间25 min、提取温度70 ℃、料液比为1∶25 (g∶mL)时,金花葵花中总黄酮提取率达到最高,为8.03%。金花葵花中含有芦丁及槲皮素2种黄酮单体,含量分别为114.59和14.04 mg/mL。

