猪霍乱沙门菌胞外产物的核酸酶活性及其对巨噬细胞胞外诱捕网形成的影响
李 琦,牛俊辉,王晓利,毛 静,全映颖, 刘桂坤,雷显前,朱鹏瑶,廖成水*
(1. 河南科技大学 动物科技学院/洛阳市活载体生物材料与动物疫病防控重点 实验室,洛阳 471023;2. 河南科技大学 基础医学院,洛阳 471023)
猪霍乱沙门菌(SalmonellaCholeraesuis)是一种广泛存在于自然界中的革兰阴性兼性厌氧菌,是引起仔猪副伤寒的主要病原菌[1]。同时,猪霍乱沙门菌亦可造成人类肠道外感染[2]。沙门菌、大肠杆菌、单增李斯特菌和金黄色葡萄球菌等属于常见的食源性病原菌。肠炎沙门菌和鼠伤寒沙门菌是人和动物沙门菌病的主要血清型[3],但猪霍乱沙门菌作为一种人兽共患致病菌引发的公共卫生安全问题仍不可被忽视[4-5]。细菌分泌的胞外产物在细菌与宿主互用过程中起着关键性作用,胞外产物有助于猪霍乱沙门菌侵袭宿主细胞,并在吞噬细胞内复制和增殖,从而导致人类和猪群产生炎症、高烧和腹泻等症状[6]。
核酸酶广泛存在于各种微生物胞外产物中,在微生物感染和宿主免疫中发挥着重要作用[7]。胞外核酸酶可以分解外源DNA作为微生物生存的营养物质并且保护自身结构不被破坏[8]。胞外核酸酶可以作为毒力因子在细菌侵入宿主机体时发挥作用[9]。大量的外源DNA能使宿主细胞表面的黏性分泌物增多,而胞外核酸酶可局部降解这些分泌物,从而导致细菌更容易附着在隐藏的细胞表面,有助于细菌成功感染宿主[10]。探究细菌胞外产物有助于揭示病原体的致病机制,但目前未见关于猪霍乱沙门菌胞外产物核酸酶活性的报道。
胞外诱捕网(extracellular traps,ETs)是新发现的一种由DNA和颗粒蛋白组成的固有免疫防御机制[11],ETs广泛存在于中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞和巨噬细胞/单核细胞,在体内外可捕获和杀灭细菌、病毒、真菌和寄生虫等绝大多数病原[12]。构成ETs的主骨架是DNA,因此,DNA酶可降解这种结构物质。猪霍乱沙门菌胞外产物是否可降解ETs值得探究。为此,本研究通过平板培养法、琼脂糖凝胶电泳法和琼脂扩散法观察猪霍乱沙门菌胞外产物的核酸酶活性,同时分析不同温度、pH和金属离子对猪霍乱沙门菌胞外产物核酸酶活性的影响以及猪霍乱沙门菌胞外产物对巨噬细胞胞外诱捕网(macrophage extracellular traps,METs)形成的影响,为猪霍乱沙门菌胞外产物在致病性和免疫逃避方面的研究奠定基础。
1 材料与方法
1.1 菌株与细胞系
猪霍乱沙门菌C78-1株、白色念珠菌ATCC 10231株和小鼠巨噬细胞细胞系J774A.1由洛阳市活载体生物材料与动物疫病防控重点实验室保存。
1.2 主要试剂
10×Loading Buffer购自日本TaKaRa公司;琼脂糖、琼脂粉、核酸染料Goodview、氯化钠和葡萄糖等购自北京索莱宝科技有限公司;DNase I(1 000 U) 和10×DNase I Buffer购自宝生物工程(大连)有限公司;胰蛋白胨、酵母浸出物等购自英国OXOID公司;λDNA、BCA蛋白质定量分析试剂盒、胰蛋白酶、谷氨酰胺、青霉素和硫酸链霉素购自生工生物工程(上海)股份有限公司;高糖DMEM培养基和胎牛血清购自Hyclone公司;Hoechst 33342和Sytox Green购自碧云天生物技术有限公司。
1.3 猪霍乱沙门菌的复苏及其胞外产物的收集
将-80 ℃保存的猪霍乱沙门菌C78-1株于LB固体平板进行复苏,然后挑取单个菌落于LB液体培养基中,37 ℃ 180 r·min-1震荡培养12~16 h。将培养液按1∶10比例接种于新鲜LB液体培养基,37 ℃ 180 r·min-1继续培养6 h后离心法收集上清液。然后用透析袋多次透析收集胞外产物,经BCA蛋白质定量分析试剂盒测定蛋白浓度后备用。
1.4 平板培养法观察猪霍乱沙门菌胞外产物的核酸酶活性
用50 mmol·L-1磷酸盐缓冲液(pH 7.0)配制1.0% LB固体培养基,在倒板前添加终浓度分别为50 μg·mL-1的λDNA和1 μg·mL-1的核酸染料。用PBS稀释新鲜培养的猪霍乱沙门菌,然后均匀涂布于LB固体平板上,37 ℃温箱培养24 h,在凝胶成像系统下观察猪霍乱沙门菌单个菌落周围的λDNA是否被降解。
1.5 琼脂扩散法观察猪霍乱沙门菌胞外产物的核酸酶活性
常规配制1.0%琼脂平板,添加λDNA和核酸染料Goodview使得终浓度分别达到50 μg·mL-1和1 μg·mL-1。利用打孔器在琼脂平板上打若干个直径为5 mm的孔,封底后,分别添加胞外产物(5 μg·mL-1)、 DNase I(10 U)和LB液体培养基,37 ℃湿盒孵育24 h,在凝胶成像系统下观察孔周围的λDNA是否被降解。
1.6 琼脂糖凝胶电泳法观察猪霍乱沙门菌胞外产物的核酸酶活性
酶切体系(50 μL):50 mmol·L-1磷酸盐缓冲液(pH 7.0)5 μL、λDNA(0.1 mg·mL-1)1 μL、猪霍乱沙门菌胞外产物(5 μg·mL-1)5 μL,补充ddH2O至总体积为50 μL,于37 ℃水浴锅中进行酶切反应,孵育20 min,用1.0%琼脂糖凝胶电泳分析酶切情况。
1.7 不同温度对猪霍乱沙门菌胞外产物核酸酶活性的影响
按照“琼脂糖凝胶电泳法测定猪霍乱沙门菌胞外产物的核酸酶活性”的方法观察温度对猪霍乱沙门菌胞外产物(5 μg·mL-1)降解λDNA的影响,温度设置16、25、30、37、42、50和60 ℃。同时,为观察胞外产物核酸酶的耐热性,胞外产物(5 μg·mL-1)分别经65、70、75和80 ℃预处理20 min,然后按上文所述方法分析酶切变化情况。
1.8 不同pH对猪霍乱沙门菌胞外产物核酸酶活性的影响
按照“琼脂糖凝胶电泳法测定猪霍乱沙门菌胞外产物的核酸酶活性”的方法观察温度对猪霍乱沙门菌胞外产物(5 μg·mL-1)降解λDNA的影响,反应缓冲液的pH设置4.0(甲苯酸盐缓冲液)、5.0(醋酸盐缓冲液)、6.0(柠檬酸盐缓冲液)、7.0(磷酸盐缓冲液)、8.0(Tris缓冲液)、9.0(硼酸盐缓冲液)、10.0(甘氨酸缓冲液)和11.0(甲胺缓冲液),其他参数不变,然后按上文所述方法分析酶切变化情况。
1.9 不同金属离子对猪霍乱沙门菌胞外产物核酸酶活性的影响
按照“琼脂糖凝胶电泳法测定猪霍乱沙门菌胞外产物的核酸酶活性”的方法观察金属离子对猪霍乱沙门菌胞外产物(5 μg·mL-1)降解λDNA的影响,金属离子设置Na+、K+、Ca2+、Co2+、Ba2+、Mg2+、Ni2+、Zn2+、Cu2+、Mn2+和Fe3+,使得反应体系中金属离子的终浓度分别为0.01、0.10、1.00、5.00和10.00 mmol·L-1, 其他参数不变,然后按上文所述方法分析酶切变化情况。
1.10 猪霍乱沙门菌胞外产物对白色念珠菌刺激巨噬细胞METs形成的影响
常规方法复苏巨噬细胞J774A.10,取24孔细胞培养板按1×105个·孔-1加入巨噬细胞,孵育1 h 后加入新鲜培养好的白色念珠菌1×105CFU,培养基为不含胎牛血清和双抗的DMEM,于5% CO237 ℃ 孵育2 h。然后加入胞外产物(5 μg·mL-1)、热灭活胞外产物或DNase I。37 ℃孵育10 min后,轻轻去除上清液,加入Hoechst 33342和Sytox Green(5 μmol·L-1) 染料孵育5 min,利用荧光显微镜观察METs形成的情况。同时,为了定量分析胞外诱捕网形成情况,按照同样的试验条件和方法进行巨噬细胞和白色念珠菌共孵育,培养基为不含胎牛血清和双抗的无酚红DMEM培养基。孵育结束后,加入Sytox Green(5 μmol·L-1)染料,于5% CO237 ℃ 作用5 min后,检测METs的形成。以巨噬细胞空白对照组的荧光水平为1,从而分析各组METs形成的情况。在两个试验中均设置猪霍乱沙门菌单独感染巨噬细胞的对照研究。
2 结 果
2.1 平板培养法观察猪霍乱沙门菌胞外产物的核酸酶活性
λDNA被核酸染料Goodview染色后在紫外线下观察时颜色呈灰白色(图1C),而不含λDNA或者λDNA被降解后,在紫外线下观察时颜色呈黑色(图1A)。因此,当LB固体琼脂中均匀混合了λDNA,在紫外灯下观察时琼脂颜色呈灰白色,而如琼脂上生长的细菌分泌核酸酶,细菌周围琼脂中的λDNA可被降解,经核酸染料Goodview染色后紫外线下观察显示菌落周围琼脂表现为黑色。在本试验中,将新鲜培养的猪霍乱沙门菌均匀涂布于含有λDNA和核酸染料的LB固体平板上,37 ℃温箱培养24 h后,凝胶成像系统观察结果显示,在紫外灯下猪霍乱沙门菌菌落周围琼脂显示出一圈黑色区域(图1B),表明菌落周围琼脂中的λDNA已被降解,提示猪霍乱沙门菌生长过程中可分泌具有核酸酶活性的胞外产物。

A.不含λDNA阴性对照组;B. 猪霍乱沙门菌组;C. 含λDNA阳性对照组。白色箭头所指黑色区域为λDNA被降解区域 A. Negative control without λDNA; B. The extracellular products from S. Choleraesuis; C. Positive control with λDNA. The white arrow represents λDNA digestion around colony图1 平板培养法测定猪霍乱沙门菌胞外产物的核酸酶活性Fig.1 Detection of the nuclease activity of the extracellular products from S. Choleraesuis by agar culture assay
2.2 琼脂扩散法测定猪霍乱沙门菌胞外产物的核酸酶活性
为单独分析猪霍乱沙门菌胞外产物的核酸酶活性,收集猪霍乱沙门菌胞外产物加到含有λDNA和核酸染料的琼脂平板孔中,如胞外产物具有核酸酶活性,在紫外线下就可显示琼脂孔周围的λDNA被降解。凝胶成像系统观察结果显示,37 ℃湿盒孵育24 h后,LB培养基阴性对照孔在紫外灯照射下周围未出现颜色变化,而DNase I阳性对照孔周围出现黑色环状区域,胞外产物也出现相似的情况(图2),说明猪霍乱沙门菌分泌的胞外产物具有降解λDNA的活性。

A. DNase I;B. 猪霍乱沙门菌胞外产物;C. LB培养基对照 A. DNase I; B. The extracellular products from S. Choleraesuis; C. LB control图2 琼脂扩散法检测猪霍乱沙门菌胞外产物的核酸酶活性Fig.2 Detection of the nuclease activity of the extracellular products from S. Choleraesuis by agar diffusion method
2.3 琼脂糖凝胶电泳法观察猪霍乱沙门菌胞外产物的核酸酶活性
为进一步分析猪霍乱沙门菌胞外产物的核酸酶活性,收集猪霍乱沙门菌胞外产物与λDNA共孵育,琼脂糖凝胶电泳可观察λDNA降解情况。凝胶成像系统观察结果显示,LB液体培养基阴性对照组未显示出降解λDNA的能力,DNase I阳性对照组λDNA全部被降解,1 μg·mL-1胞外产物即表现出降解λDNA的能力,并随着胞外产物浓度增加,λDNA逐渐被降解,并且在5 μg·mL-1时λDNA可被完全降解(图3)。结果进一步证实了猪霍乱沙门菌胞外产物具有核酸酶活性。
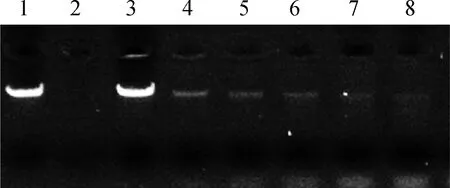
1.λDNA;2.DNase I + λDNA;3.LB + λDNA;4~8. 1、2、3、4 和5 μg·mL-1胞外产物 1. λDNA; 2. DNase I + λDNA; 3. LB + λDNA. 4-8. The extracellular products from S. Choleraesuis with 1, 2, 3, 4, and 5 μg·mL-1, respectively图3 琼脂糖凝胶电泳法测定猪霍乱沙门菌胞外产物的核酸酶活性Fig.3 Detection of the nuclease activity of the extracellular products from S. Choleraesuis by agarose gel electrophoresis
2.4 不同温度对猪霍乱沙门菌胞外产物核酸酶活性的影响
为研究不同温度对猪霍乱沙门菌胞外产物核酸酶活性的影响,在16、25、30、37、42、50和60 ℃下进行酶切反应。结果显示,反应温度为16 ℃时胞外产
物降解λDNA的活性较弱,随着孵育温度增高,降解λDNA活性也逐渐增强,且反应温度达到42 ℃时表现出最强的核酸酶活性,但温度继续升高后(50和60 ℃)胞外产物核酸酶的活性被抑制(图4A)。同时,胞外产物的耐热性较差,经65 ℃以上温度处理后核酸酶活性被完全抑制(图4B)。
2.5 不同pH对猪霍乱沙门菌胞外产物核酸酶活性的影响
为研究不同pH对猪霍乱沙门菌胞外产物核酸酶活性的影响,在pH 4.0~11.0条件下进行酶切反应。结果显示,反应pH为4.0和5.0时胞外产物表现出较弱的核酸酶活性,随着反应pH增高,降解λDNA活性也逐渐增强,且pH达到9.0时表现出最强的核酸酶活性,但pH继续升高后(pH 10.0和11.0)胞外产物核酸酶的活性被抑制(图5)。
2.6 不同金属离子对猪霍乱沙门菌胞外产物核酸酶活性的影响
为研究金属离子对猪霍乱沙门菌胞外产物核酸酶活性的影响,酶切反应中添加浓度为0.01、0.10、1.00、5.00和10.00 mmol·L-1的Na+、K+、Ca2+、Co2+、Ba2+、Mg2+、Ni2+、Zn2+、Cu2+、Mn2+和Fe3+。结果显示,Na+、K+、Ca2+和Ni2+对胞外产物的核酸酶活性没有影响,高浓度(5.00~10.00 mmol·L-1)的Ba2+、Mg2+和Mn2+可提高胞外产物切割λDNA的活性,低浓度无影响;低浓度(0.01~1.00 mmol·L-1)的Zn2+、Cu2+和Fe3+促进胞外产物切割λDNA的活性,高浓度无影响;相反地,低浓度(0.01~1.00 mmol·L-1) Co2+则抑制胞外产物切割λDNA的活性(图6),提示不同金属离子对猪霍乱沙门菌胞外产物切割核酸酶活性的影响存在差异。
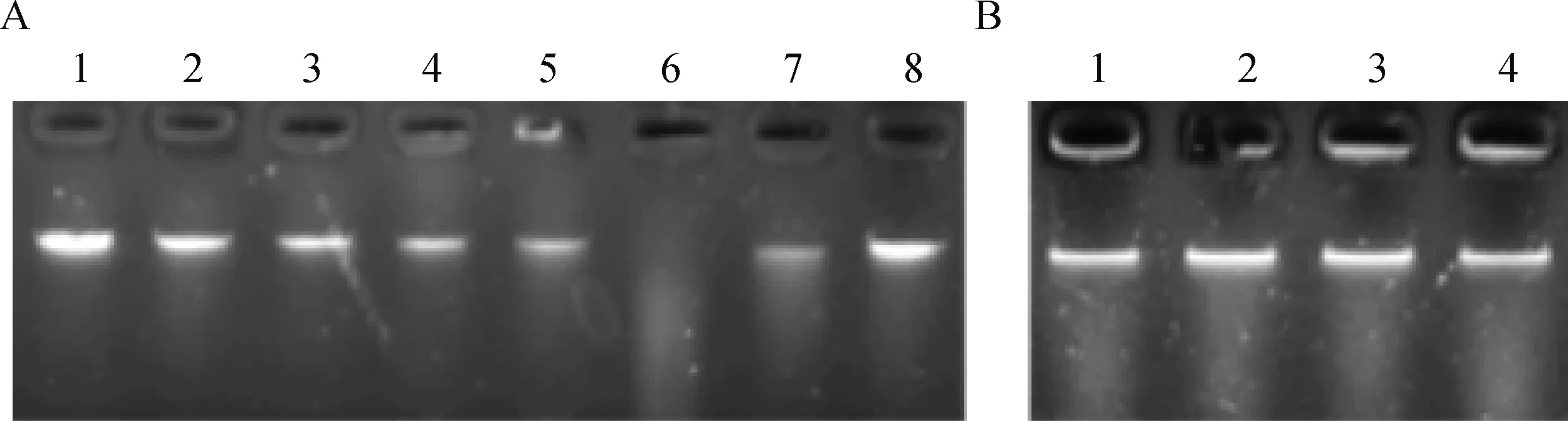
A. 胞外产物在不同孵育温度下的核酸酶活性(1. λDNA;2~8. 分别代表反应温度为16、25、30、37、42、50和60 ℃);B.胞外产物在高温条件下的热稳定性(1~4.分别代表温度为65、70、75和80 ℃) A. The nuclease activity of the extracellular products was measured at different temperature (1. λDNA; 2-8. Represent 16, 25, 30, 37, 42, 50 and 60 ℃, respectively); B. The heat stability of the extracellular products (1-4. Represent 65, 70, 75 and 80 ℃, respectively)图4 温度对猪霍乱沙门菌胞外产物核酸酶活性的影响Fig.4 Effect of temperature on the nuclease activity of the extracellular products from S. Choleraesuis
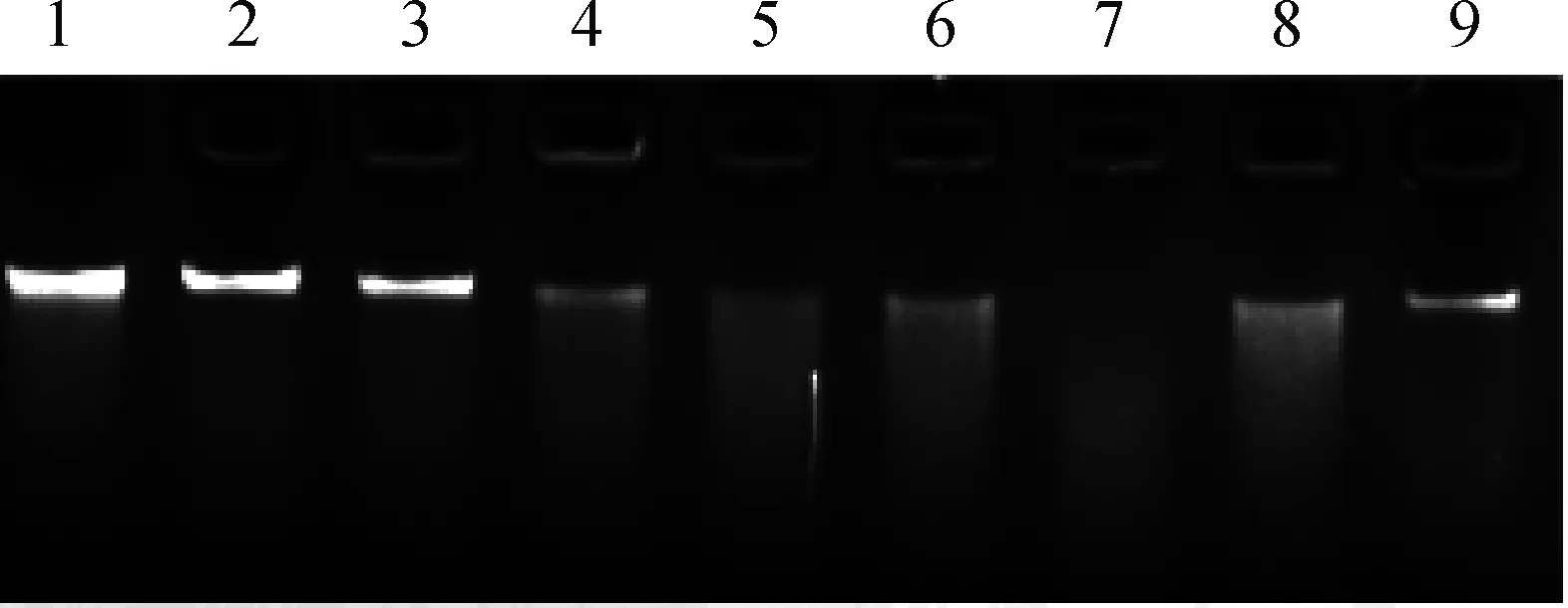
1.λDNA;2~9.分别代表pH在4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0下检测胞外产物活性 1. λDNA; 2-9. Represent pH 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0 and 11.0, respectively图5 pH对猪霍乱沙门菌胞外产物核酸酶活性的影响Fig.5 Effect of pH on the nuclease activity of the extracellular products from S. Choleraesuis
2.7 猪霍乱沙门菌胞外产物对白色念珠菌刺激巨噬细胞METs形成的影响
将巨噬细胞J774A.1与白色念珠菌ATCC 10231共孵育,经Hoechst 33342染色后用荧光显微镜观察。结果显示,白色念珠菌可诱导巨噬细胞产生明显的胞外DNA的纤维状结构(图7B),而未与白色念珠菌共孵育的细胞未见这种结构物质(图7A)。当往白色念珠菌诱导的胞外诱捕网加入5 μg·mL-1猪霍乱沙门菌胞外产物后,胞外DNA的纤维状结构物质明显减少(图7C),这种现象与DNase I阳性处理组的结果相似(图7D),但经热灭活处理的猪霍乱沙门菌胞外产物组未见这种现象(图7E),说明猪霍乱沙门菌胞外产物可抑制白色念珠菌诱导的胞外诱捕网。同时,还发现猪霍乱沙门菌单独与巨噬细胞共孵育时并不能刺激释放METs(图7F)。同样地,荧光酶标仪定量结果显示,白色念珠菌刺激巨噬细胞产生的荧光强度是未处理组的65倍左右,而加入猪霍乱沙门菌胞外产物,白色念珠菌诱导的胞外DNA含量显著减少,约减少至未处理组的25倍左右,这与荧光显微镜观察得到的结果一致(图8)(P<0.01)。
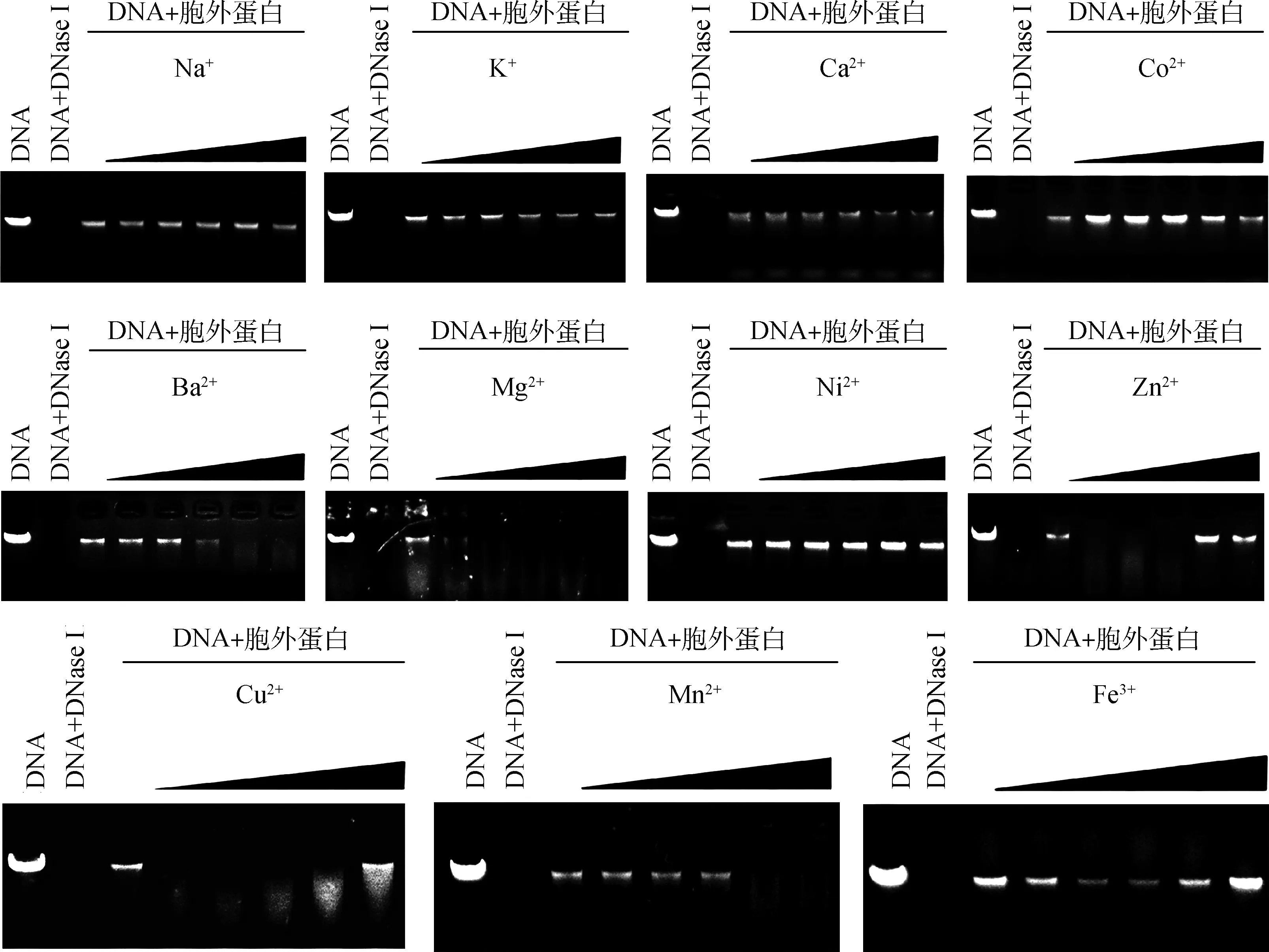
各图中离子浓度分别为0、0.01、0.10、1.00、5.00、10.00 mmol·L-1 The ion concentrations in the figures are 0,0.01,0.10,1.00,5.00 and 10.00 mmol·L-1, respectively图6 金属阳离子对猪霍乱沙门菌胞外产物核酸酶活性的影响Fig.6 Effect of metal ions on the nuclease activity of the extracellular products from S. Choleraesuis
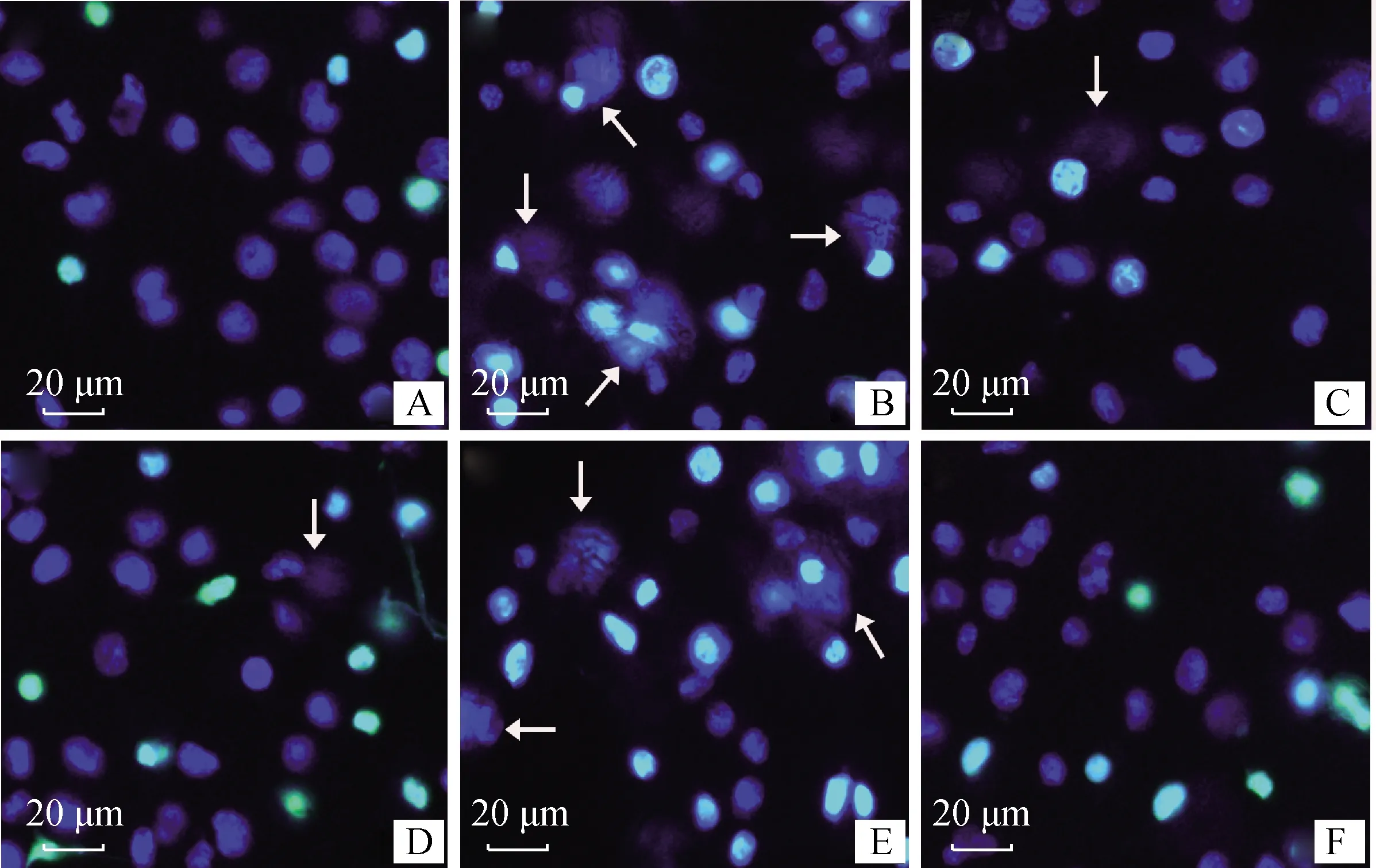
A.空白对照组;B.白色念珠菌组;C.白色念珠菌+胞外产物组;D.白色念珠菌+DNase I组;E.白色念珠菌+热灭活胞外产物组;F.猪霍乱沙门菌组。白色箭头所指为METs A. Control; B. Candida albicans; C. Candida albicans + the extracellular products; D. Candida albicans + DNase I; E. Candida albicans + the heat inactivated-extracellular products; F. S. Choleraesuis. The white arrow represents METs图7 荧光显微镜观察猪霍乱沙门菌胞外产物对白色念珠菌刺激METs形成的影响Fig.7 Effect of the extracellular products from S. Choleraesuis on METs induced by Candida albicans under fluorescence microscope
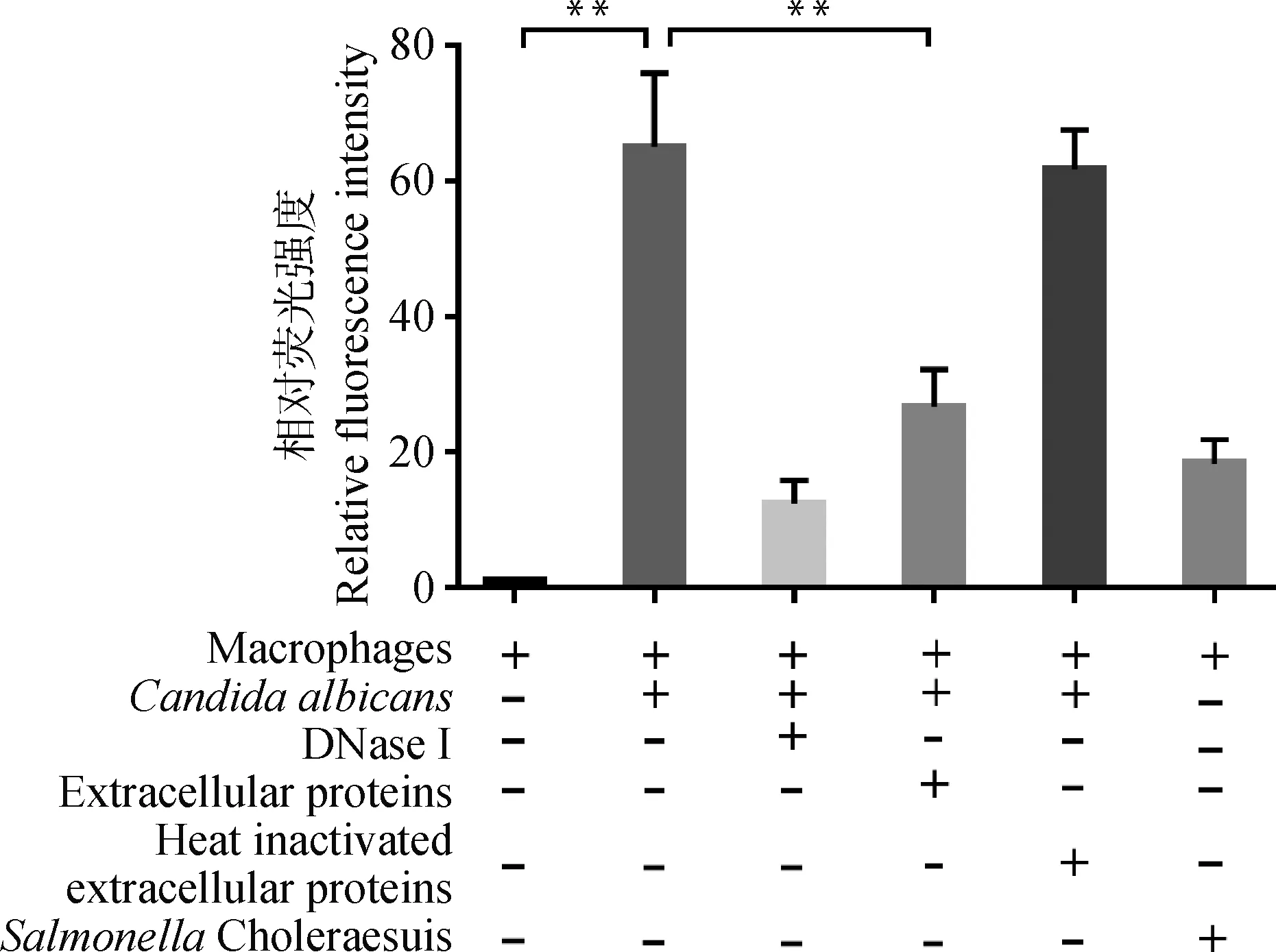
**.P<0.01图8 定量分析猪霍乱沙门菌胞外产物对白色念珠菌刺激METs形成的影响Fig.8 Quantification of effect of the extracellular products on METs induced by Candida albicans
3 讨 论
核酸酶主要参与机体的营养代谢、遗传物质的复制、重组和修复机制以及病原感染和免疫等生理和病理过程[13]。具有核酸酶活性的胞外产物对于细菌进入非吞噬细胞或在吞噬细胞中存活和增殖是必需的[14]。胞外核酸酶在细菌生物被膜形成过程中降解胞外DNA以提供自身的营养物质,如MR-1胞外核酸酶[15]。沙门菌基因组分析发现具有编码核酸酶的基因,但猪霍乱沙门菌胞外产物的确切核酸酶活性却未见报道。本研究通过平板培养法、琼脂糖凝胶电泳法和琼脂扩散法均证实了猪霍乱沙门菌分泌的胞外产物具有降解λDNA的核酸酶活性。
本研究利用琼脂糖凝胶电泳法观察了温度、pH和金属离子对猪霍乱沙门菌胞外产物的核酸酶活性的影响。微生物分泌的核酸酶在较宽的pH范围(pH 6.0~10.0)可发挥活性,且一般情况下在pH 8.0~8.5的条件下活性最高[16]。猪霍乱沙门菌胞外产物的核酸酶活性在pH 4.0~6.0的酸性条件下胞外产物的核酸酶活性较弱,在pH为9.0的碱性条件下活性最强。35~44 ℃是绝大多数微生物核酸酶表现出活性的最佳温度[16]。本研究发现,猪霍乱沙门菌胞外产物在42 ℃时表现出较好的核酸酶活性。同时,多数核酸酶经70 ℃作用30 min后活性可被灭活[17],而猪霍乱沙门菌胞外产物在温度高于60 ℃时核酸酶活性降低,这有可能是温度的升高造成了酶蛋白或者酶核酸发生了变性。金属离子对胞外产物的核酸酶活性具有多重影响[18]。Dunn[19]对大肠杆菌核酸酶活性的研究表明,大肠杆菌核酸酶是依赖二价金属离子的核酸酶。本研究结果发现,5.00~10.00 mmol·L-1Ba2+、Mg2+和Mn2+可提高猪霍乱胞外产物切割λDNA的活性;0.01~1.00 mmol·L-1的Zn2+、Cu2+和Fe3+促进胞外产物切割λDNA的活性。虽然本研究初步证实了猪霍乱沙门菌胞外产物的核酸酶活性,但从核酸酶的部分酶学特性来看,猪霍乱沙门菌分泌的胞外产物可能含有多种核酸酶。
研究证实病原微生物通过分泌胞外核酸酶降解固有免疫细胞ETs的DNA骨架是逃避免疫杀伤的主要途径之一[21]。霍乱弧菌、链球菌属和金黄色葡萄球菌等病原菌的胞外核酸酶具有促进降解中性粒细胞ETs从而逃避中性粒细胞ETs捕获的能力[20-22]。本研究证实猪霍乱沙门菌胞外产物具有核酸酶活性,我们之前的研究发现白色念珠菌可刺激巨噬细胞释放ETs[23],而猪霍乱沙门菌胞外产物可降解这种胞外网状结构。同时猪霍乱沙门菌并不能刺激巨噬细胞释放METs,推测猪霍乱沙门菌胞外产物可能与细菌免疫逃避有关。因此,分离和鉴定猪霍乱沙门菌胞外核酸酶的种类与特性以及分析猪霍乱沙门菌胞外核酸酶在感染和宿主免疫中的确切作用是我们下一步重点研究的方向。
4 结 论
猪霍乱沙门菌分泌的胞外产物具有降解λDNA的核酸酶活性,胞外产物可显著降解白色念珠菌刺激巨噬细胞形成的胞外诱捕网。

