海拔对乌红杂交天麻产量与品质的影响及其酶学作用机制
杨 婧,王传华,曾春函,王洋洋,侯云波,杨 林
(1 三峡库区生态环境教育部工程研究中心,湖北宜昌443002;2 湖北省三峡地区生态保护与治理国际联合研究中心,湖北宜昌443002;3 三峡大学生物与制药学院,湖北宜昌443002;4 贵州健康职业学院,贵州铜仁 554300)
天麻(GastrodiaelataBl.)是一种具有很高药用价值的异养型兰科植物[1],需要与萌发菌、蜜环菌共生才能完成生活史[2]。蜜环菌隶属于担子菌门(Basidiomycota)伞菌目(Agaricales)小皮伞科(Marasmiaceae)蜜环菌属[Armillaria(Vahl) P.Kumm.][3],广泛分布于欧洲、亚洲、非洲、北美洲等地。蜜环菌具有兼性寄生特性,需从朽木或活树根汲取营养[4-5],目前世界上已知有近40 个生物种[6],部分种是重要的食药用真菌[7]。天麻与蜜环菌具有特殊的共生关系,天麻球茎一方面依赖于真菌的侵染而获得营养,另一方面又具有强有力的阻止或限制真菌侵染的防卫机制以避免自身感病[8]。
海拔(温度)是影响天麻生产的重要因素。天麻适宜在夏季凉爽且冬季温和的环境中生长[9],其自然分布具有明显的海拔地带性,垂直分布的高度由南到北逐渐下降[10],适宜温度为-4~20 ℃[11]。外界温度为14 ℃左右时,天麻开始生长;升高到20 ℃时,天麻进入迅速生长期;但达到28 ℃时,温度会抑制天麻的生长,因此,天麻的最适生长温度是15~24 ℃。另一方面,当温度低于8 ℃或高于28 ℃时,天麻将停止生长,进入休眠状态[10,12-14]。生产实践中,在低海拔地区栽培天麻常因蜜环菌过量繁殖导致其腐烂[15],同时海拔不同也导致药用化学物质含量不同[16]。因此,深入研究温度对天麻-蜜环菌共生关系的影响并揭示其作用机制,对提高天麻产量、改善天麻品质具有重要意义。
天麻抵御蜜环菌的入侵机制中,多种消化酶和抗真菌蛋白扮演着重要角色。研究表明,天麻皮层的抗真菌蛋白(GAFP)是抵御蜜环菌入侵的主要物质[17-20],而皮层细胞与消化细胞溶酶体细胞释放的消化酶及几丁质酶(EC3.2.1.14)在消化入侵菌丝流过程中发挥关键作用[10,21-22]。研究还发现,几丁质酶作为一种糖苷水解酶,在蜜环菌的生长发育及其与天麻的共生过程中发挥重要作用[23-25],而β-1,3-葡聚糖酶(EC3.2.1.39)在天麻初生球茎消化蜜环菌菌丝的过程中起重要作用[13]。同时,植物病理学的研究表明,一些酶类如多酚氧化酶(PPO,EC1.10.3.1)、苯丙氨酸解氨酶(PAL,EC4.3.1.5),也参与植物的抗病过程。王曼玲等认为,PPO在水稻、烟草、棉苗及苹果抵御各种病菌的过程中起重要作用[26],而植株感染真菌后PPO 活性明显增强,且其活性沿着感染部位到未感染的边缘有明显的梯度变化[27]。另外,当植物受到病原菌的侵染时,PAL活性也有明显的变化,因此,PAL活性的变化与植物的抗病性也密切相关[28]。迄今,温度变化对天麻抗侵染及消化酶系统影响的研究仍未见报道,有关植物抗病酶类是否在天麻-蜜环菌的共生机制中扮演角色尚不清楚。
那么,天麻的产量及品质随海拔升高呈现何种变化趋势?温度升高对天麻体内消化酶、防御酶及组织液抑制菌丝体生长的活性有何影响?进而对天麻-蜜环菌共生关系有何影响?为了回答以上问题,本研究以在中国广泛种植的乌红杂交天麻作为实验材料,在不同海拔开展天麻栽培实验,以考察海拔影响天麻生物量与药用品质(天麻素、对羟基苯甲醇含量)的效应;同时,在室内控制条件下测定温度变化对天麻消化酶、防御酶活性,以及天麻组织液抗蜜环菌菌丝体生长效果的影响,揭示温度对天麻-蜜环菌共生体的生长与存活的作用机制。本研究结果对于揭示蜜环菌-天麻的共生机制具有重要科学价值,并对天麻栽培的区划具有重要实际指导意义。
1 材料和方法
1.1 研究区域概况
本研究选择湖北宜昌市五峰县五峰镇和牛庄乡开展天麻田间栽培实验。近30年来,该地区已经形成了成熟的天麻栽培管理技术体系,是中国著名的天麻主产区之一。试验场地处鄂西南的武陵山余脉,境内山地资源丰富,最高海拔达到2 320.3 m,年均日照1 533 h,年均气温13~17 ℃,无霜期240 d,年均降水量1 600 mm,部分地区拥有独特的沙性壤土。
1.2 试验材料
供试的天麻种质为乌红杂交天麻。父本乌天麻(G.elataB1. f.glauca)和母本红天麻(G.elataB1. f.elata)种源均为野生天麻的自交系。根据前期实验结果,选择CBS F二倍体菌株用于培养天麻栽培用蜜环菌材;选择CBS A、CBS B、CBS D、CBS F、CBS H、CBS J、CBS M和CBS N的单倍体菌丝作为天麻组织液抑菌效果的蜜环菌株(表1)。

表1 参试天麻组织液抑制蜜环菌菌丝体生长试验的蜜环菌生物种
1.3 海拔对天麻生物量与品质的影响试验
1.3.1 实验设计本试验采用单因素3水平设计,以海拔为固定因子。由于中国杂交天麻适生海拔为800~1 900 m[27],故在研究区域内五峰县五峰镇、牛庄乡选择850 m、1 600 m和1 900 m 三个海拔梯度,地势较为平坦、坡向一致的撂荒农地(5年以上)设置试验场。
1.3.2 大田栽培2018年元月,采用熟料段木法准备蜜环菌材。具体方法为:选择长20 cm、直径约15 cm、鲜重约2 500 g(±50 g)的白栎(QuercusfabriHance)段木,装入聚氯乙烯袋常压灭菌8 h,接种CBS F后在25 ℃下培养60 d备用。乌红杂交天麻种麻的质量约10 g/头,用种量每段木为m0(约50 g)。2018年4月初,参考徐锦堂的方法[10],采用单棒法栽培天麻。行宽30 cm,每根菌材作为一个处理单位,处理间距离30 cm,每个处理20个重复。
1.3.3 生物量测定2018年10月收获栽培的天麻。以菌棒为单位,测定天麻的鲜重(m1)和个体数,计算增殖率[G= (m1-m0)/ m0×100%]。带回实验室后,分拣个体鲜重大于50 g的所有个体,用天平(精度0.01g)测定总鲜重(W1),然后在常压下将天麻样品蒸制20 min,在60 ℃的烘箱内烘干至恒重[28],用天平(精度0.01 g)测定干重(W2),计算折干率(D= W2/ W1×100%)。将每一菌棒产生的天麻烘干后,粉碎过60目筛,烘干后低温保存,用于天麻素和对羟基苯甲醇的含量测定。
1.3.4 天麻有效药用成分的测定取样品粉末,准确称定1.0 g,置于具塞锥形瓶中,用移液管加入稀乙醇25 mL,超声处理30 min,放至室温,5 000 r/min离心20 min;取上清液5 mL,在50 ℃旋蒸浓缩至近干无醇味,残渣加乙腈-0.05%磷酸溶液(5∶95)混合溶解,定容至10 mL容量瓶,用1 mL一次性无菌注射器吸入,从0.22 μm的微孔滤膜滤头过滤至EP管。从EP管中吸取15 μL样品液,注入色谱仪进样器中,检测波长为220 nm,测定峰面积[29]。
精密量取对照品天麻素和对羟基苯甲醇原溶液适量,加乙腈-0.05%磷酸溶液(5∶95)溶液制成质量浓度梯度的溶液,依次测定出峰面积,建立峰面积(y)与质量浓度(x)间的标准曲线及其方程(表2)。根据样品的出峰面积按标准曲线计算样品的天麻素和对羟基苯甲醇含量。根据每棒的天麻总鲜重(m1)、增值率(G)和天麻样品药用成分含量C(%)计算每菌棒所产天麻含有的天麻素总量、对羟基苯甲醇总量及二者合量。

表2 天麻素和对羟基苯甲醇标准曲线
1.4 温度对天麻抗蜜环菌侵染及消化系统的影响试验
1.4.1 天麻消化酶和防御酶活性对温度的响应1)天麻样品的采集 2018年10月,从海拔1 900 m、1 600 m和800 m三处野外种植的乌红杂交天麻中随机选取5窝,每窝取100 g同一规格(长约2~3 cm大小)的白麻放入自封袋,置-80 ℃保存[30],用于背景值测定;另在海拔1 600 m处(3个海拔点表现最好)的每窝取100 g规格一致的白麻用于温度胁迫实验。2)温度处理 将天麻样品置于15 ℃、25 ℃和30 ℃的湿润河沙中暗培养7 d[31-32]。 3)粗酶液的制备 分别参考Boller T[33]、史益敏[34]、张温典[35]及胡月[36]的研究方法制备β-1,3-葡聚糖酶、几丁质酶、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)的粗酶液。4)酶活性测定 采用用酶免ELISA试剂盒测定4种酶的活性(江苏酶免实业有限公司,批号LOT NO.:1909P)。将试剂盒标准品稀释成浓度梯度为12.5、25、50、100、200 U/L的标准品稀释液,根据说明书步骤进行实验测定,以标准物浓度为横坐标(x),其吸光度值(OD)为纵坐标(y),绘制标准曲线(表3)。然后,测定样品的OD值,计算各酶的活性。

表3 4种酶的标准曲线方程与活性计算公式
1.4.2 不同培养温度天麻粗提物对蜜环菌生长的抑制作用1)天麻材料收集与处理 2018年10月选取野外海拔1 600 m处栽培(3个海拔点表现最好)的乌红杂交天麻3窝,每窝选取长度约2~3 cm的白麻1~1.5 kg,4 ℃保存备用。2)温度处理 设15 ℃、25 ℃和30 ℃ 三个温度梯度[39]。每个处理约700 g鲜天麻,装入透气的泡沫盒中,处理时湿沙覆盖[38],处理时间1周。每处理3个重复。3)天麻组织粗提液制备 参考胡忠等的方法提取天麻具有抗真菌蛋白活性的组织粗提液[18,39]。将提取液分为两部分,2/3体积提取液用于实验组,1/3的提取液121 ℃高温高压灭菌20 min,作为对照组;试验和对照组均采用0.22 μm微孔滤膜抽滤制备无菌滤液,得到抗真菌蛋白(GAFP)粗提液。4)抑菌效果测定 在无菌环境下将抗真菌蛋白粗提液添加到PDA培养基中[20,40],并接入8个种的蜜环菌生物种单倍菌丝体(表1),放入恒温培养箱24~25 ℃恒温培养20 d。然后用扫描仪(EPSON PERFECTION 4870 PHOTO)扫描并用根系分析系统WinRHIZO测定菌落面积,计算菌落面积变化比率(HC),HC=(Si-Sa)/Sa×100,其中Si和Sa分别为试验组和对照组各蜜环菌生物种的菌落面积。将长有蜜环菌单倍体的培养基放入沸水中煮至培养基融化,然后将菌索65 ℃烘干至恒重,称重。计算生物量变化比率(HB),HB=(Bi-Ba)/Ba×100,其中Bi和Ba分别为试验组和对照组的菌索生物量。
1.5 数据分析
以海拔为固定因子,采用SPSS20.0软件对增长率(G)、折干率(D)、天麻素含量、对羟基苯甲醇含量和总药用成分含量(S,天麻素含量+对羟基苯甲醇含量)进行单因素方差分析;采用Duncan进行多重比较,显著性水平设置为0.05。另外,对β-1,3-葡聚糖酶、几丁质酶、PPO、PAL活性、蜜环菌菌落面积、生物量及抑菌效果,以温度为固定因子,采用SPSS22.0进行单因素ANOVA分析,然后采用邓肯法进行处理间显著性差异检验(P<0.01);采用Origin2018作图。
2 结果与分析
2.1 海拔对乌红杂交天麻生长及药用品质的影响
实际栽培结果表明,海拔乌红杂交天麻的增长率、天麻素含量及总对羟基苯甲醇含量存在显著影响,而对折干率无显著影响(表4)。其中,乌红杂交天麻增长率在海拔1 600 m最高,并显著高于其他海拔,分别比海拔850 m 和 1 900 m显著提高64.06%和98.93%;天麻素含量却在1 900 m海拔处最高,并显著高于其他海拔,分别比海拔850 m 和 1 600 m显著提高20.1%和25.13%; 总对羟基苯甲醇含量在1 600 m处最高,分别比海拔850 m 和 1 900 m显著提高46.15%和40.74%。综合而言,乌红杂交天麻有效成分总量在海拔1 600 m处最高,分别比海拔850 m和1 900 m提高31.10%和8.39%,但差异均未达到显著水平。可见,海拔1 600 m环境最有利于乌红杂交天麻的生长和药用有效成分的积累。
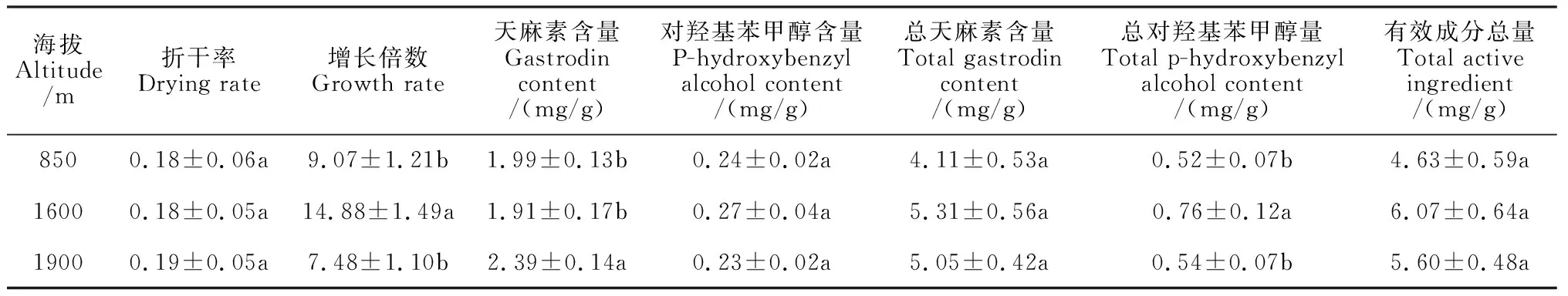
表4 不同海拔下杂交天麻生长与药用品质的变化
2.2 培养温度对乌红杂交天麻体内消化酶与防御酶活性的影响
图1显示,乌红杂交天麻体内消化酶(几丁质酶、β-1,3-葡聚糖酶)活性随温度而降低,表现为15 ℃处理显著高于25 ℃和30 ℃处理,这表明高温显著破坏了杂交天麻的消化酶活性。同时,β-1,3-葡聚糖酶活性对温度的反应更敏感,受温度的影响更大,且在各温度处理间具有显著性差异(图1)。杂交天麻体内多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性在不同温度下也差异显著。PPO活性随着温度的上升而逐渐增强,且各温度处理间均存在显著性差异;PAL活性随着温度的升高先下降然后上升,且25 ℃处理显著低于15 ℃和30 ℃处理(图1)。以上结果表明乌红杂交天麻各防御酶活性在温度升高时变化趋势不尽相同,PPO活性具有增强趋势,而PAL活性却有降低趋势。
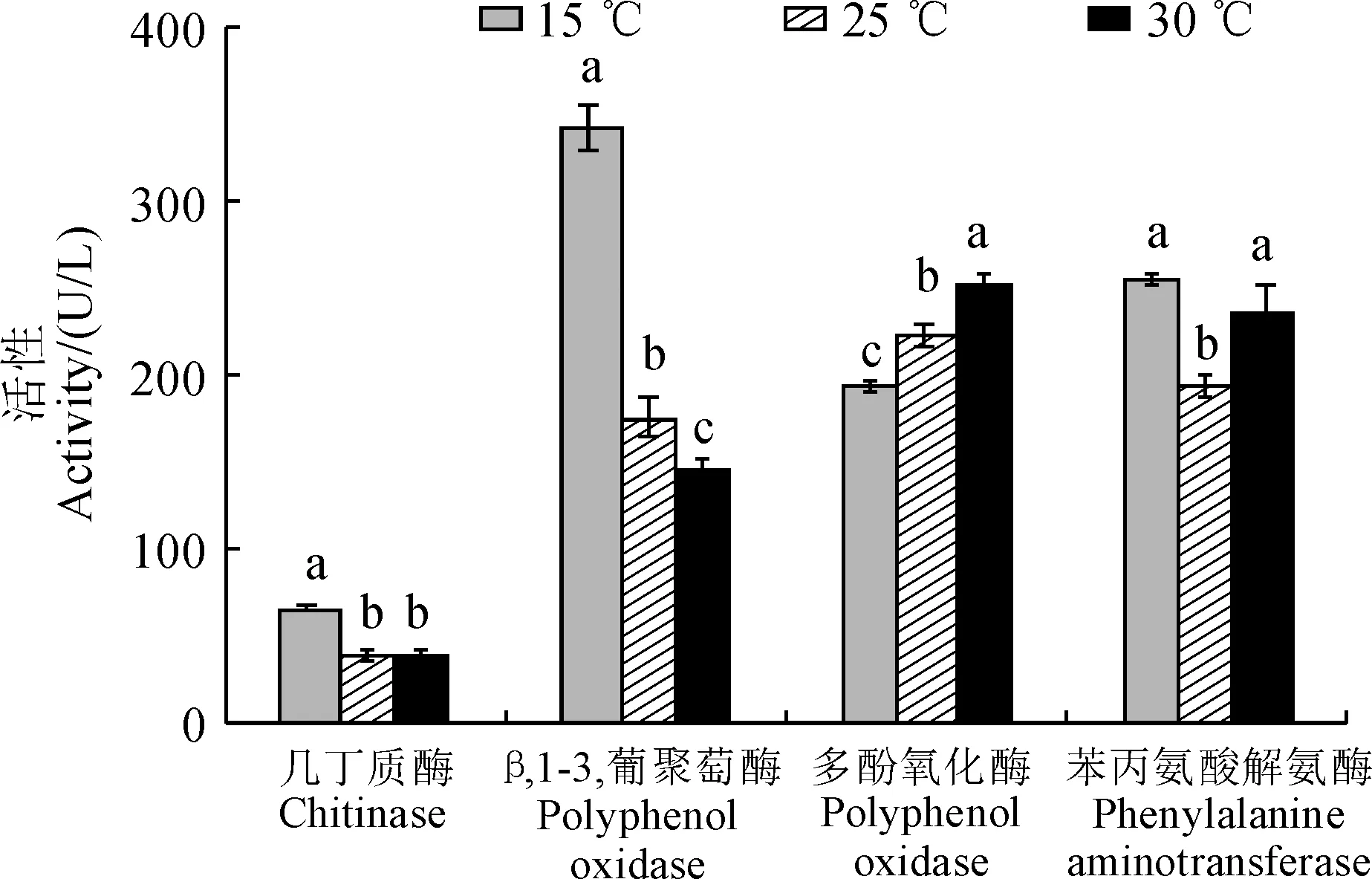
每种酶内不同小写字母表明温度处理间在0.05水平上存在显著性差异(Duncan,P<0.05)
2.3 培养温度对天麻组织粗提液抑制蜜环菌生长的影响
图2,A显示,在不同培养温度天麻提取物(抗真菌蛋白,GAFP)处理下,各蜜环菌菌种单倍体菌丝菌落面积变化率表现复杂多样,且温度处理间均存在显著性差异;菌落面积变化率不仅有上升和下降差异,更有正值和负值之别。其中,在各温度提取液处理下,菌种CBSA菌落面积变化率均为正值,菌落生长得到促进;而菌种CBSF和CBSG菌落面积变化率均为负值,菌落生长均受到抑制;其余菌种的菌落面积变化率既有正值,也有负值,说明菌落生长有些情况下得到促进,有些情况受到抑制。在15 ℃培养天麻提取物处理下,菌落面积变化率仅菌种CBSA和CBSN为正值,其余菌种菌落面积变化率为负值,即多为抑制作用且大多较大;在25 ℃培养天麻提取物处理下,菌落面积变化率除菌种CBSF和CBSJ外均为正值,即多为促进作用;30 ℃培养天麻提取物处理下,菌落面积变化率仅菌种CBSA、CBSH和CBSM为正值但促进作用很明显,其余菌种均为负值但抑制作用相对较小。可见,大多数蜜环菌菌种菌落生长的抑制效果均以15 ℃培养天麻提取物处理最显著,随着培养天麻温度的上升,抑菌效果有显著降低的趋势,但其抑制效应在8个生物种间存在显著差异。

正值代表促进生长,负值代表抑制生长;同一菌种内不同小写字母代表温度处理间在0.05水平存在显著性差异(Duncan,P<0.05)
同时,与试验预期相反,菌落生物量的变化率除CBSJ外均为正值,即未灭活天麻组织液(天麻抗真菌蛋白)均明显促进各蜜环菌菌种的生长,但不同培养温度组织液的促进效应有显著差异,在低温时促进效应较弱,而在中温时促进效应相对较强(图2,B)。其中,除菌种CBSJ以外,随着培养温度的升高,大部分蜜环菌生物量先增加后降低,也就是天麻提取物对生物量增加的相对抑制能力先降低后升高,在25 ℃达到最低值,大多数在15 ℃达到最高值。上述结果表明,尽管天麻组织液中存在具有抑菌活性的抗真菌蛋白(GAFP),但天麻组织粗提液中可能同时存在对高温敏感的未知活性物质,二者综合作用呈现出对蜜环菌生长具有促进作用。
3 讨 论
经过实验地栽培研究,发现在海拔1 900 m处由CBS F伴栽的红天麻有效成分含量最高,杂交天麻适合种植在1 600 m海拔范围。也有学者发现,无论在原位还是模拟条件下,植物与真菌共生体双方的海拔来源及海拔梯度上的环境(或温度)变化均显著影响其生长[41]。结合彭华胜的研究结果[11],天麻的分布有一定海拔要求,其中西南地区以1 200~1 800 m较多,东北地区多分布在海拔300~1 000 m。而在邻近纬度,低海拔地区温度较高,高温抑制了天麻中消化酶的活性,但是蜜环菌胞外酶活性随温度的升高先增加后降低,这就可能使天麻-蜜环菌的共生关系遭到破坏。
本研究的结果表明,天麻体内消化酶和防御酶系统对于温度升高的响应具有差异。低温下天麻消化酶活性升高,而高温下天麻的保护酶活性则增加。早在20世纪80年代研究发现,天麻皮层细胞具有消化功能,菌丝的细胞壁就是在其中被消化的,发挥作用的主要是天麻皮层分泌的几丁质酶、β-1,3-葡聚糖酶[42-43]。因此,这些消化酶活性的变化直接影响天麻的营养供给,也与天麻免受蜜环菌侵染密切相关。同时,本研究发现,高温下天麻体内防御酶活性增强,这与戴明凯等以马铃薯为研究对象,发现高温胁迫下马铃薯体内保护酶活性随时间推移增加的结果相似[44]。因此,天麻响应蜜环菌侵染的策略随着温度的升高发生变化,由低温的消化蜜环菌菌丝体供自生需要,转向高温下保护自身免受侵害为主。
与此同时,我们还研究了温度变化对天麻体内组织粗提液抑制蜜环菌单倍体菌丝生长的影响,发现温度升高削弱了天麻对蜜环菌菌丝体的抑制能力。本研究中采用的是天麻组织的粗提液,包含各种酶类和抗真菌蛋白以及其他成分不明的物质[45-47]。抗真菌蛋白(GAFP)是一类对真菌具有抑制作用的蛋白质,在芝麻菜种子和天麻的块茎中均有发现[48-49]曾从新生麻块茎中检测并纯化出一种抗真菌蛋白,并对其进行了免疫荧光定位,发现抗真菌蛋白定位于新生麻表皮及皮层细胞的外缘,是新生麻避免被蜜环菌侵入的物质基础。而且GAFP是越冬前新生麻阻止蜜环菌侵入的化学防御物质[50],说明低温对于GAFP的抑菌效果显著,可能是高温抑制GAFP的表达,或者活性。这与本试验所发现的天麻组织粗提液在低温下抑菌效果明显较为一致。由于几丁质酶和葡聚糖本身不具有抑菌活性[48],我们推断本研究中发挥抑菌作用的主要物质是GAFP。本研究还发现,天麻组织粗提液中存在促进蜜环菌生长的活性物质,这种活性物质可能存在于天麻皮层中GAFP的外侧,以诱导和促进蜜环菌趋向天麻组织的生长。这也说明天麻与蜜环菌在长期的协同进化过程中具有十分复杂的关系。
温度还可能对天麻伴生蜜环菌的侵染特性产生影响。蜜环菌菌丝体最适宜的生长温度为20~25 ℃,超过30 ℃停止生长[51],施汉钰等也认为最佳的蜜环菌培养温度为恒温25 ℃[37]。也有学者研究发现,蜜环菌的生长量在高温条件下显著高于低温条件下,其差异主要是菌丝生长,而菌索生长的差异并不大[52]。另外,温度还影响蜜环菌胞外酶的分泌。如曾春函等在研究中发现,温度对蜜环菌胞外漆酶和果胶酶活性大小有影响,对产酶时间没有影响;对纤维素酶活性达到峰值的时间和活性大小都有影响[53]。
4 结 论
温度是影响蜜环菌-天麻共生关系的重要环境因子。随着温度升高,天麻抵御蜜环菌入侵的策略发生变化,天麻的消化酶活性和粗提液的抑菌活性下降,但是保护酶活性上升。而且不同海拔下栽培的天麻产量及有效成分也有明显差异,这种适应策略的转变,可能是温度升高导致蜜环菌病理性侵染天麻的重要机制。同时,天麻体内含有某种促进蜜环菌生长的活性物质,说明天麻体内同时存在促进蜜环菌生长和抑制蜜环菌侵染的复杂系统。而且经过研究发现,在海拔1 900 m处,由CBS F伴栽的红天麻产量及有效成分含量均最高。

