新型鹅星状病毒的分离鉴定与全基因序列分析
卢秀娴,张思远*,梁昭平,林举攀,冯盛春,黄 芬,潘俊斌
(1.广州市华南农大生物药品有限公司,广东广州 510300;2.华南农业大学,广东广州 510642)
鹅星状病毒(Goose astrovirus,GoAstV)是近年危害我国养鹅业重要的病毒性传染病病原之一[1],主要感染3周龄以内的雏鹅[2]。感染后鹅群发生高度致死性内脏痛风病,病死率可高达30%,该病的病原是由星状病毒引起的(Astrovirus,AstV),临床病变主要以肾脏及腿部肌肉、关节覆盖大量尿酸盐沉积物为特征[3]。AstV属于星状病毒科,1975年被首次发现[4],是一种无囊膜20面体的单股正链RNA病毒,广泛存在于动物群体中[5]。AstV的基因组全长约6.1~7.9 kb,不同种星状病毒之间序列变异较大,包括5′端未翻译区(untranslation region,UTR)、3个开放性阅读框(ORF1a、ORF1b和ORF2)、3′UTR及多聚腺苷酸(PolyA)尾[6];不同种AstV之间存在基因重组现象,同源重组多发生于基因组ORF1b/ORF2交界区,该区域包含一个稳定的发夹结构,是AstV同源重组的高发部位,但ORF1b区域同样可以发生基因重组[7]。AstV基因组的高度变异使其对环境和宿主具有很强的适应能力,甚至可跨种传播,是威胁人类健康和动物养殖业的重要传染病病原之一[8]。自2017年以来,我国部分地区养鹅场陆续有GoAstV感染的病例报道[9],对鹅内脏痛风病致病原有重新的认识并加强对GoAstV的重视。本试验从2019年山东某养鹅场雏鹅临床上疑似由AstV引起鹅内脏痛风病的病料分离到1株病毒,通过鹅胚病变观察、血凝性试验、病毒半数致死量测定、RT-PCR 检测和基因组序列分析,以期了解该病毒的变异情况,为该病的防控及分子流行病学研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病料 为2019年山东某养鹅场雏鹅出现严重尿酸盐沉积症状的肝脏、肾脏、腿肌等部位;100枚9日龄健康鹅胚、40只1日龄健康雏鹅购广东清远市某鹅场。
1.1.2 主要试剂 核酸提取试剂盒,TIANLONG公司产品;2×EasyPfu PCR SuperMix (-dye),北京全式金生物技术有限公司产品;pMD19-T载体、DNA Marker DL 2 000,TaKaRa公司产品;核酸染料和反转录试剂盒均,TIANGEN公司产品。
1.1.3 主要仪器 全自动样品快速研磨仪,QIAGEN公司产品;小型高速冷冻离心机,Eppendorf公司产品;PCR( C1000)仪 和电泳仪,Bio-Rad公司产品;核酸自动提取仪和凝胶成像系统,Tanon公司产品。
1.2 方法
1.2.1 病料处理 将病料剪碎,与磷酸盐缓冲液(PBS)按1∶1用全自动样品快速研磨仪进行研磨成匀浆,将匀浆液置于冰箱-20℃反复冻融3次,离心后取上清液加入双抗后除菌、分装,于-70℃及以下保存。
1.2.2 病原传代培养 除菌后病料上清液经尿囊膜接种9日龄~11日龄鹅胚,0.2 mL/胚,每日观察胚 死亡情况;收集接种后72 h~168 h死亡鹅胚,收获胚液,继续传代至鹅胚规律性死亡为止,对收集的鹅胚尿囊液进行血凝性检测。病毒纯化后增殖的病毒液进行10倍倍比稀释接种10日龄鹅胚各6枚,按Reed-Muench法计算ELD50。
1.2.3 RT-PCR检测 病料匀浆和传代收获的病毒液离心后取上清液,用核酸提取试剂盒提取病毒RNA并反转录成cDNA,分别用以下6对病毒引物对病料上清液及收获的胚液体进行PCR检测。根据GenBank中已发表的基因序列,用Oligo7.0软件设计特异性检测引物,由上海生工生物工程有限公司合成(表1)。
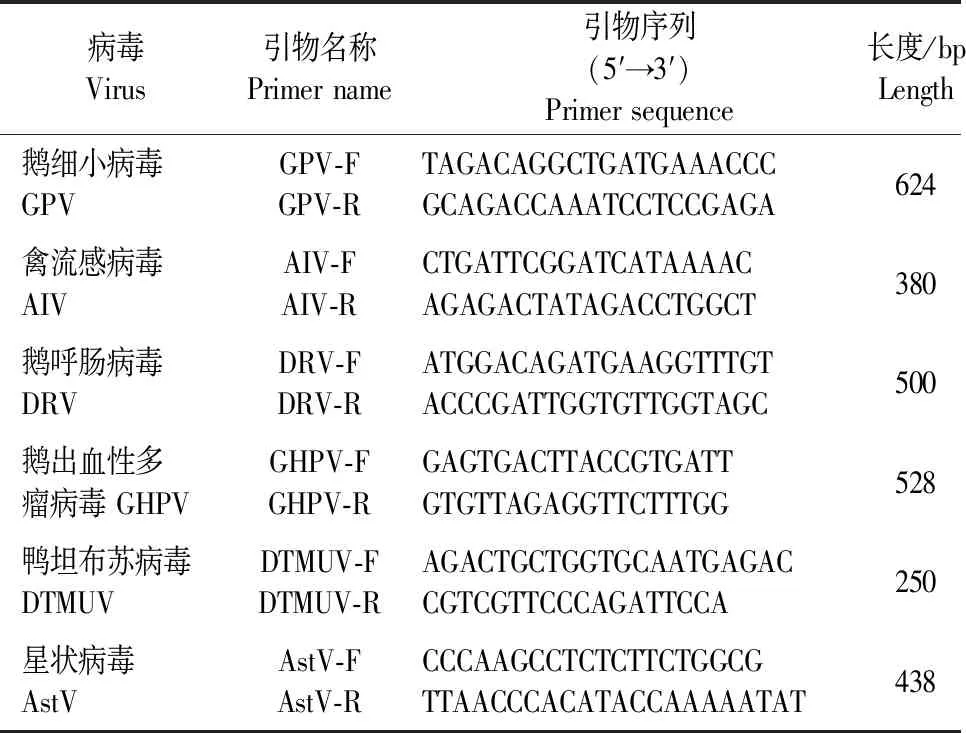
表1 PCR检测引物
1.2.4 组织切片病理观察 收取患鹅肝脏和肾脏固定于100 mL/L的多聚甲醛溶液浸泡48 h,经脱水、透明、石蜡包埋、切片、HE染色,观察病理变化。
1.2.5 动物回归试验 将40只1日龄健康雏鹅,随机分为2组,攻毒组30只经皮下接种病毒液,接种剂量0.2 mL/只;对照组10只以同样的方式和剂量接种PBS。每日观察雏鹅的临床症状和死亡情况,死亡雏鹅立即剖检观察病变,观察15日后处死剖检2组雏鹅。
1.2.6 病毒基因组的扩增及序列分析 参照文献[10]新型GoAstV全部编码区的特异性引物,将获得的cDNA为模板,对分离毒株的基因组进行分段PCR扩增,扩增后的产物送至金唯智有限公司测序。测序结果拼接后用Blast进行比对,同时用DNAStar与其他不同种属星状病毒进行同源性分析,并用MGEA7.0构建遗传系统进化树。
2 结果
2.1 病毒分离
病料经除菌处理后接种鹅胚并进行传代,接种鹅胚第1代未出现死亡,剖检胚体可见鹅胚全身皮肤呈点状出血(图1)。传至第3代,鹅胚出现死亡,死亡胚体充血明显,剖检胚体可见腹膜、肾脏、腿肌有尿酸盐沉积。病毒不能凝集10 mL/L的鸡红细胞,ELD50为10-4.0/0.2 mL。

A.(1~3)胚体全身皮肤呈点状出血;B.(1~3)胚体可见腹膜、肾脏、肝脏及腿肌有尿酸盐沉积
2.2 RT-PCR检测结果
用鹅星状病毒特异性检测引物对病料上清液和接种鹅胚后分离的胚液进行RT-PCR鉴定,均能扩增到大小约438 bp目的片段(图2),应用其他5种病毒基因特异性引物进行RT-PCR检测,结果为阴性,分离到的毒株命名为AstV/Goose/SD776/2019。
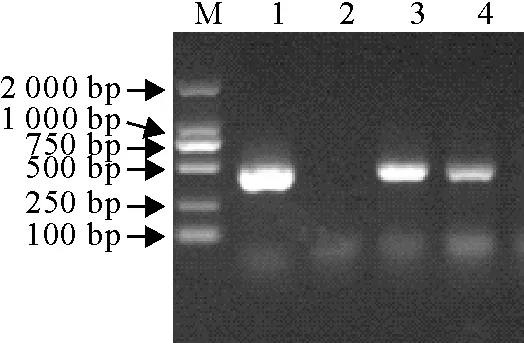
M.DNA标准DL 2 000; 1.阳性对照; 2.阴性对照; 3.胚液; 4.病料
2.3 组织切片病理观察
组织病理学结果显示,肝细胞肿胀、破裂,空泡变性;肾脏肾小管上皮细胞脱落,管腔内充满蓝色尿酸盐颗粒(图3)。
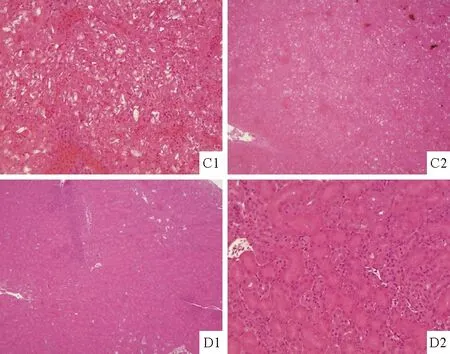
C1.肝细胞肿胀、破裂;C2.肝细胞空泡变性;D1.肾脏肾小管上皮细胞脱落,D2.肾脏管腔内充满蓝色尿酸盐颗粒
2.4 动物回归试验
攻毒组鹅在接毒的第5天开始出现精神萎靡,食欲减退等症状,攻毒后7 d~10 d出现部分鹅死亡,之后鹅群死亡率逐渐减低。剖检死亡雏鹅,可复制出与临床发病病例痛风相似的症状,肾脏肿大,有尿酸盐样沉积物(图4E1~E3),部分感染雏鹅未死亡或未出现内脏痛风,但肾脏均表现发黄、肿胀(图4F1~F3)。

E1~E3.肾脏肿大、充血,有尿酸盐样沉积物;F1~F3.肾脏发黄、肿胀
2.5 基因组序列分析
将该分离株AstV/Goose/SD776/2019各ORF基因序列与GenBank上已发表禽源星状病毒和哺乳动物星状病毒基因序列进行比对析,结果显示,分离株的3个ORF和与近年报道的引起痛风的新型GoAstV毒株(JSHA 、SD01、SDPY、GD)的核苷酸同源性和氨基酸同源性为99.2%以上;与能导致雏鹅肠炎的鹅星状病毒(FLX)及其他种属禽源星状病毒同源性相对较低,全基因组序列同源性不高于70%,ORF1a、ORF1b、ORF2核苷酸序列同源性分别为44.9%~63.2%、57.2%~67.4%和41.0%~59.0% ,氨基酸序列同源性分别为26.8%~59.6%、52.1%~68.8%和26.5% ~57.3%,与哺乳动物星状病毒比对同源性最低,ORF1a、ORF1b、ORF2核苷酸序列同源性分别为34.5%~37.2%、46.5%~49.8%和33.3%~36.2%,氨基酸序列同源性分别为14.4%~16.9%、37.0%~38.4%和16.8%~19.6%。
全基因组核苷酸序列遗传系统进化分析表明,分离株AstV/Goose/SD776/2019与近年报道的引起痛风的GoAstV毒株(JSHA、SD01、SDPY、GD)聚成一个分支,遗传距离较近;与其他禽星状病毒形成了独立的进化支遗传距离较远就(图5);表明分离毒株属于新型鹅星状病毒。

▲本试验分离毒 ▲The virus strain isolated in this experiment
3 讨论
GoAstV主要攻击肾脏上皮细胞,致使肾脏结构和功能损伤,进而影响尿酸的排泄,导致尿酸盐沉积造成痛风[11-12]。造成鹅痛风的原因较多,各种内、外源性因素均会导致血液中尿酸水平升高[13],比如高蛋白饲料引发的蛋白质代谢障碍和肾脏损伤,磺胺类药物引起的中毒和肾脏损伤等[14],都会极易造成误诊,因此需要注意与新型鹅星状病毒引起的痛风病鉴别诊断。
本试验通过PCR分段扩增获得了分离株编码区3个ORF的基因序列,结果显示ORF1a与ORF1b之间含有19 nt核苷酸的重叠区域,该区域参与核糖体移位信号的形成,这与其他星状病毒一致,与已报道的SD01株高度同源,未出现核苷酸的缺失或插入及基因重组现象。基因序列比对分析结果表明,分离株AstV/Goose/SD776/2019与近年报道的引起痛风的新型GoAStv毒株(JSHA、SD01、SDPY、GD) 的核苷酸和氨基酸同源性较高,遗传进化分析结果同样显示其与4株新型鹅星状病毒同属于一个分支。新型GoAStv国内毒株(JSHA 、SD01、SDPY、GD) 的全基因组序列先后被测定,对其进行分子水平上的流行病学调查提供了可靠的依据,也为疫苗的研制与开发奠定了基础。相关研究表明,基因组序列的差异可能会影响RNA的二级结构,从而改变病毒与宿主的亲和力,从而影响病毒的致病性和毒力[15]。基于这些研究可以推测,基因组序列的差异可能是导新型星状病毒的致病性与其他禽类星状病毒致病性存在显著差异的原因之一。

