辅酶Q10通过抑制炎症损伤及细胞凋亡保护创伤性颅脑损伤
郑锐哲 毛旻韬 杨西涛 刘玉梅
1上海交通大学医学院附属同仁医院(上海200336);2上海交通大学医学院附属第九人民医院(上海201999)
创伤性颅脑损伤(traumatic brain injury,TBI)是一个重要的公共卫生问题,TBI 的发生率约为5000 万人次/年[1-2]。由于世界上大约一半的人口在其一生中可能经历一次或多次TBI,TBI 成为当今社会最主要的致残及致死性疾病之一,带来严重的家庭及社会负担。TBI 发生后,脑组织发生一系列变化,包括线粒体功能障碍、氧化应激、细胞凋亡、炎症损伤反应,而这些病理变化会进一步加重脑组织损伤[3-9]。而炎症损伤、细胞凋亡等已成为TBI 发生进展的重要环节。如何有效阻止TBI后的炎症损伤、细胞凋亡等二次损伤对TBI 后神经保护及功能恢复具有重要意义。
辅酶Q10(CoQ10)是有氧氧化呼吸链中不可或缺的电子传递体,其作为细胞内不可或缺的内源性亲脂抗氧化剂,调控着线粒体的功能发挥[10-12]。有研究表明:CoQ10 对脑缺血再灌注损伤、阿尔茨海默病(AD)、帕金森病(PD)及亨廷顿病(HD)等神经退行性疾病起到一定的治疗作用,这得益于其对抗氧化应激损伤,进而增强线粒体的能量代谢的治疗效果[12-15]。然而,针对于CoQ10 对TBI 后脑组织的保护作用的研究甚少。因此,本研究拟采用TBI 小鼠作为研究对象,通过给予不同剂量的CoQ10 干预,评估其神经行为学得分,检测脑组织中TNF-α、IL-6、IL-1β炎症因子的水平、凋亡蛋白Bcl-2、Bax 和c-Caspase3 蛋白以及轴突再生蛋白GAP43 的表达情况,来探讨CoQ10 对TBI 小鼠潜在的保护作用及相关机制,现报告如下。
1 材料与方法
1.1 动物及试剂雄性C57 小鼠均为8 ~10 周,体质量20 ~25 g,购买自上海南方模式生物研究中心。CoQ10 购自卫材(中国)药业有限公司;反转录和实时定量PCR 试剂盒购于TaKaRa 公司。实验所用引物均由生工生物工程(上海)股份有限公司合成。
1.2 分组及给药小鼠随机分为4 组:假手术组(sham)、创伤性颅脑损伤组(TBI)、CoQ10 低剂量组(LDG)和高剂量组(LHQ)。LDG 和HDG 组于造模后予以灌胃给药,剂量分别为10 mg/(kg·d)和30 mg/(kg·d),连续给予1 周。
1.3 模型建立本实验选用经典的控制性脑皮质损伤(CCI)小鼠模型[16],具体步骤如下:腹腔注射5%水合氯醛(0.01 mL/g)对入组小鼠进行麻醉,随后将其固定于立体定向仪上,于无菌条件下作正中切口切开小鼠头皮,无菌镊分离头皮后采用骨膜剥离子剥离骨膜;采用电钻在人字缝与右侧冠状缝之间、中线旁开2 mm 处进行颅骨钻孔,骨窗大小约为径3 mm,暴露出完整的硬脑膜;采用精细颅骨撞击仪设定打击参数(打击时间均为100 ms;打击深度1.5 mm;打击速度均为1.5 m/s)。打击后对小鼠进行骨瓣还纳入,最后缝合小鼠头皮。本研究中的假手术组小鼠在去除骨瓣后不进行打击,其余处理同手术组。为减少操作差异性带来的误差,腹腔内药物注射及TBI 建模均由同一操作者进行。
1.4 Western blot 实验对小鼠进行腹腔注射水合氯醛麻醉药后,即断头取脑,显微镜下分离出损伤侧皮层组织,加入预冷的含有蛋白酶抑制剂PMSF 的细胞裂解液RIPA,冰上超声时间为2 min,随后12 000× g 离心后取上清液,采用分光光度计进行蛋白浓度定量。取8 μg 的蛋白样品进行10% SDS-PAGE 电泳,之后湿转至PVDF 膜,采用5%脱脂奶粉封闭此PVDF 膜1 h。加入一抗4 ℃孵育过夜;TBST 洗膜3 次后,加入相应二抗,随后进行孵育1 h;在TBST 洗膜3 次后,采用ECL 化学发光法显色,同时采用Tanon 4500 自动化学发光图像分析系统扫描并分析结果。实验中所用一抗如下:兔Bax 抗体(1∶1 000 稀释,美国CST,货号14796)、小鼠Bcl-2 抗体(1∶1 000 稀释,美国CST 公司,货号15071),兔Cleaved Caspase-3 抗体(1∶500 稀释,美国CST 公司,货号9664),兔单克隆GAP4 抗体(1∶1 000 稀释,美国abcam 公司,货号ab75810)。所用二抗均购于碧云天生物技术有限公司,辣根过氧化物酶标记的抗小鼠(1∶2 000稀释,货号A0216)及山羊抗兔(1∶2 000 稀释,货号A0208)。
1.5 实时荧光定量PCR采用TRIzol 法提取各组皮层组织总RNA 后,采用NanoDrop 对RNA 的浓度及质量测定。取2 μg RNA 进行反转录为cDNA,具体参照逆转录试剂盒的操作步骤。实时荧光定量PCR 反应在Thermo RT-qPCR 仪进行。操作步骤说明如下:每个反应设3 个复孔。根据实时荧光定量扩增曲线测得目的基因及内参基因的Ct 值,用GAPDH 标准化目的基因的表达水平,通过2-△△Ct法分析,重复实验3次。实验中所用引物序列设计如下:TNF-α:正向(GGAACACGTCGTGGGATAATG),反向(GGCAGACTTTGGATGCTTCTT)、IL-6:正向(TCTATA-CCACTTCACAAGTCGGA),反向(GAATTGCCATTGCACAACTCTTT)、IL-1β:正向(GCAACTGTTCCTGAACTCAACT),反向(ATCTTTTGGGGTCCGTCAACT)、GAPDH:正向(AGGTCGGTGTGAACGGATTTG),反向(TGTAGACCATGTAGTTGAGGTCA)。
1.6 改良神经功能缺损评分在CCI 损伤后的1、3、7、14 d 采用改良的神经功能缺损评分表(modified neurological severity scores,mNSS)对小鼠进行功能评定,具体包括行走测试、感觉实验、提尾实验、平衡木实验、反射缺失和不正常运动实验。
1.7 转棒实验(Rota-Rod test)在CCI损伤后14 d对小鼠进行转棒实验功能评估。具体如下:将损伤后的小鼠置于测试仪器上,首先给予30 s 的时间适应,然后启动转棒式疲劳仪,让小鼠在转速为5 r/min 的转棒上爬行90 s。随后调整转速为16 r/min,同时完成记时,采用红外装置监测小鼠从转棒的跌落,同时自动停止记时,最后记录小鼠在转杆上运动的具体时间,以及小鼠第一次从转棒上跌落的时间(潜伏期)。
1.8 统计学方法采用Quantity one 软件处理Western blot 结果,数据以均数±标准误显示,使用SPSS 22.0 统计软件包作统计分析,多组间进行用单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 CoQ10 可降低TBI 后炎症因子的表达用实时荧光定量PCR 方法检测CoQ10 对TBI 后炎症因子表达的影响。结果显示:与Sham 相比,TBI 组炎症指标TNF-α、IL-6、IL-1β炎症因子表达明显上调(P<0.001);与TBI 组相比,LDG 组和HDG 组的TNF-α、IL-6、IL-1β炎症因子表达显著降低,差异均有统计学意义(P<0.001),见图1。
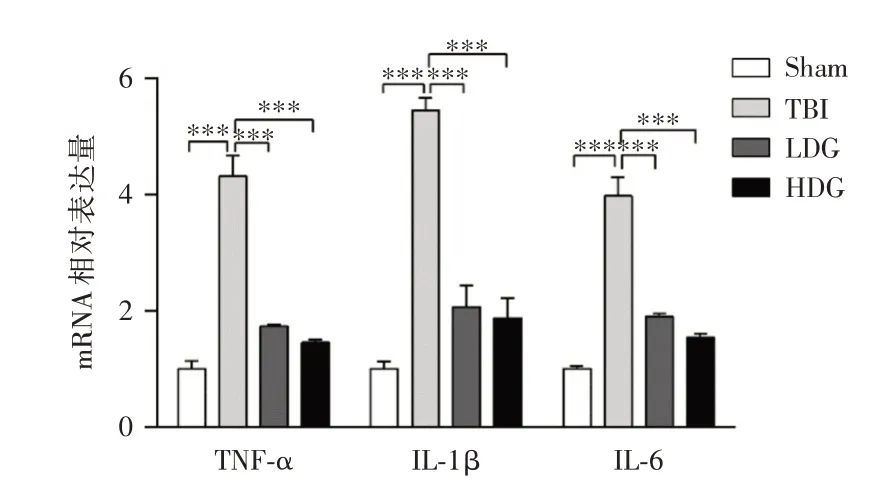
图1 Real-time PCR 检测不同组小鼠皮层组织中炎症因子TNF-α、IL-6、IL-1β 的mRNA 水平Fig.1 Evaluating the mRNA levels of TNF-α,IL-6 and IL-1β in cortex of mice in different groups by Real-time PCR
2.2 CoQ 可抑制TBI 后细胞凋亡与Sham 组相比,TBI 组Bax 和c-Cas3 蛋白表达显著增加,Bcl-2蛋白表达显著降低,同时Bcl-2/Bax 比率显著降低,差异有统计学意义(P<0.001)。与TBI 组相比,LDG组和HDG组Bax和c-Cas3蛋白表达显著降低,Bcl-2蛋白表达显著增加,同时Bcl-2/Bax 比率显著升高,差异有统计学意义(P<0.001),提示低剂量或高剂量CoQ 均能改善凋亡蛋白的表达,阻止细胞凋亡,见图2、3。
2.3 CoQ10可上调TBI后神经再生蛋白GAP43的表达CoQ10 处理组(LDG 和HDG)GAP43 mRNA及蛋白表达量较TBI 组显著增加(P<0.001),见图4。
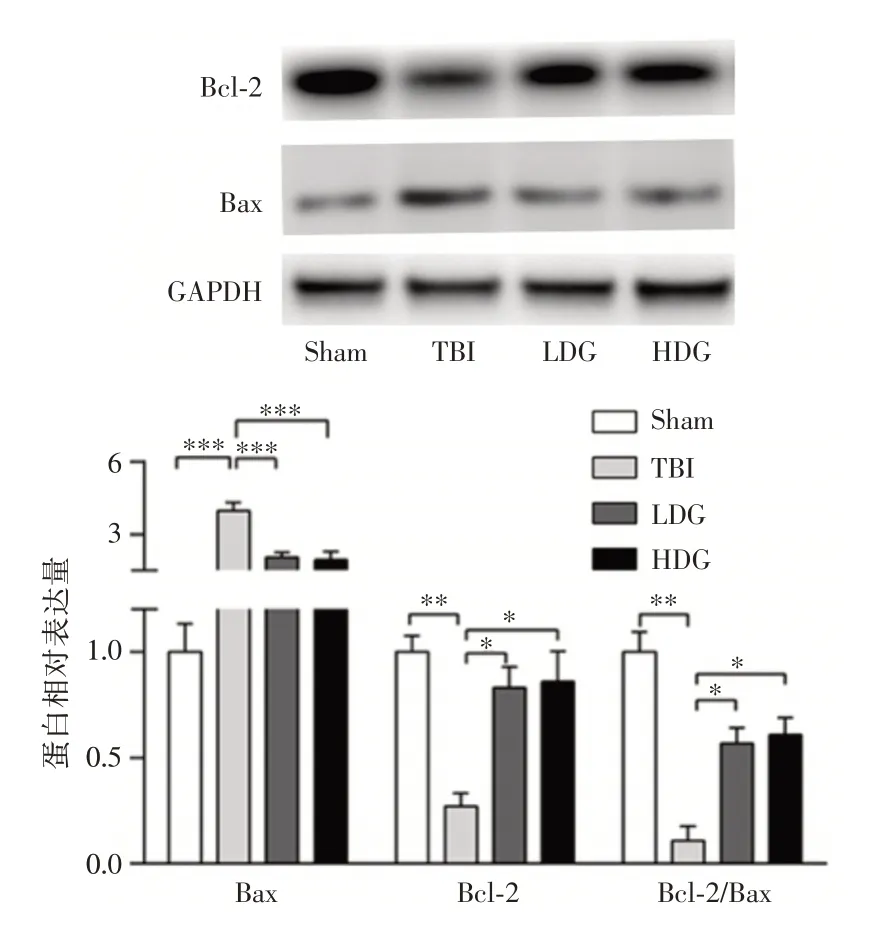
图2 Western blot 检测各组Bcl-2、Bax 蛋白表达水平Fig.2 Detecting the protein levels of Bcl-2 and Bax in different groups by Western blot
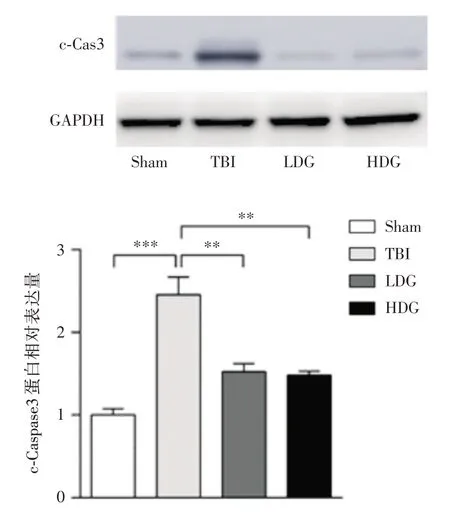
图3 Western Blot 检测各组c-Caspase3 蛋白表达水平Fig.3 Detecting c-Caspase3 protein level in different groups by Western blot
2.4 CoQ10 处理可部分改善TBI 后神经功能改良神经功能损伤评分(mNSS)结果显示:与TBI 组相比,CoQ10 治疗可以明显降低脑外伤CCI 造模后7 和14 d 的mNSS 评分数值,且随着时间的延长,效果逐渐明显;而且HDG 组小鼠mNSS 评分改善更加明显。转棒实验结果发现,TBI 后CoQ10 处理组小鼠在转棒上停留的时间相对TBI 小鼠延长(P<0.001),见图5。
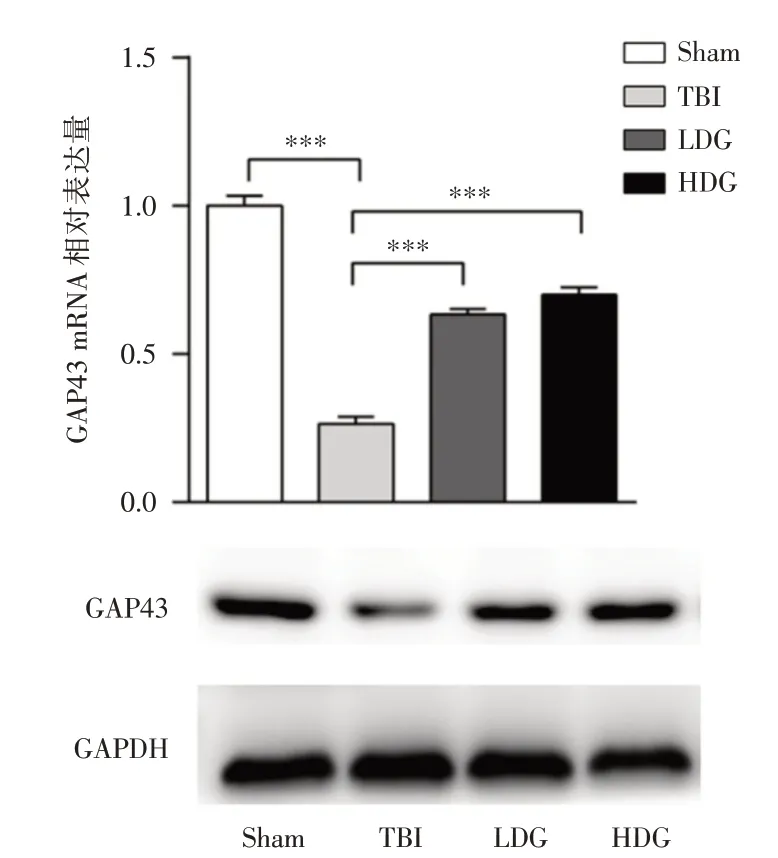
图4 Real-time PCR 及Western Blot 检测各组GAP43 蛋白表达水平Fig.4 The mRNA and protein levels of GAP43 in different groups were detected by Real-time PCR and Western Blot
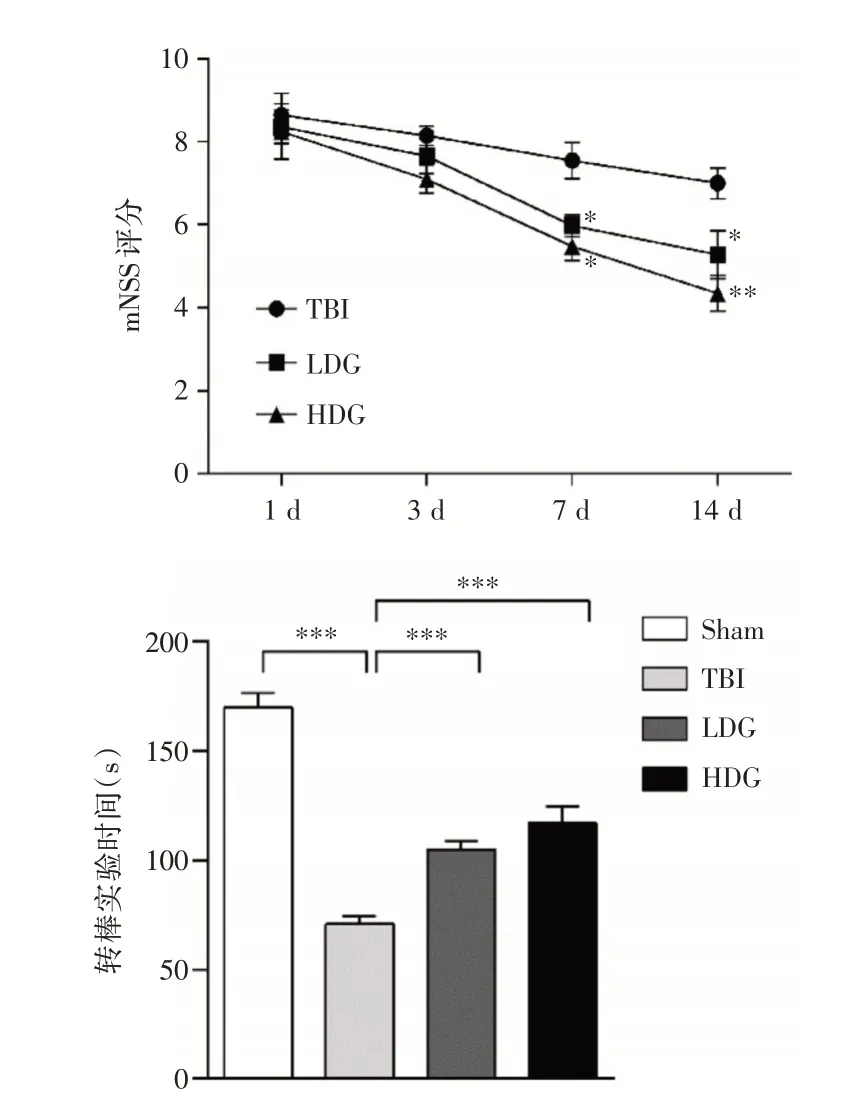
图5 CoQ10 可降低TBI 后mNSS 评分、增加TBI 小鼠的转棒实验时间Fig.5 Treatment with CoQ10 can reduce the mNSS score and increase the time in Rota-Rod test
3 讨论
在TBI 损伤后的脑组织存在复杂的变化,其主要受到氧化应激反应、线粒体功能障碍、细胞凋亡及炎症损伤、钙超载、自由基增多和脂质过氧化等多种作用机制的调控[3-8]。由于脑组织中的不饱和脂肪酸含量相对丰富,导致其极易发生脂质过氧化反应,并且脑组织中的抗氧化酶含量少,加重了其损伤的程度[3-8]。大量证据[3-4,7-8]表明,神经炎症是TBI 后继发性脑损伤的重要因素,TBI 后出现的一系列炎症反应:如单核细胞增多、中性粒细胞浸润及淋巴细胞减少,在继发性脑损伤过程中起重要作用[3,7]。此外,脑组织中炎症细胞的聚集,进而诱发炎症因子的释放,更进一步的加重了脑损伤[3,7,17]。相关性分析结果显示,TNF-α 和白细胞介素(主要IL-6、IL-8、IL-1β等)是与脑损伤相关的炎性因子[3,7,17]。TNF-α主要由神经胶质细胞在应激性过程中产生[3,7,17],其在脑损伤加重的过程中起重要作用。有研究表明,CoQ10 可以通过降低脑组织的TNF-α的水平,进而保护神经胶质细胞[18]。本研究结果显示,CoQ10 不仅显著降低脑组织中TNF-α ,而且降低IL-1β、IL-6 的表达,表明CoQ10 可减少炎症细胞释放炎症因子,进而对神经细胞起保护作用。
TBI 后,过度的氧化应激反应及炎症损伤可诱发神经细胞的凋亡,最终导致神经功能障碍的发生[18]。在此过程中,Bax 基因作为促进凋亡的核心基因,其表达主要通过促使细胞色素C 穿越线粒体内膜,激活caspase 的级联放大反应,实现神经细胞凋亡的促进作用[19-20];而Bcl-2 基因则是抑制凋亡的核心基因,其表达主要通过与Bax 基因结合形成异源性二聚体,实现对Bax 基因的抑制作用,进而抑制进一步的级联反应,抑制Bax 基因的促凋亡活性[19-21]。实际情况下,Bax 基因与Bcl-2 基因的表达比例实现细胞在接受信号刺激后的结局为生存/死亡的精准调控。此外,Caspase-3 基因在上述神经细胞凋亡的极联反应通路中位居核心,其表达与激活决定了凋亡的信号通路的传导[20,22]。本实验结果显示,TBI 后脑组织中Bcl-2/Bax 基因比率下调,呈现损伤后凋亡激活,而给予CoQ10后,Bcl-2基因表达明显升高、Bax 及c-Caspase3 基因表达显著降低,Bcl-2/Bax 比率显著升高,这表明CoQ10 可抑制凋亡信号,具有神经保护作用。
过度的炎症激活不仅可导致细胞的凋亡,也能阻碍神经可塑性,不利于轴突生长[4,8,23]。而神经细胞的存活及神经再生是神经功能康复的基础。本研究发现CoQ10 可上调神经再生标记物GAP43,表明CoQ10 可改善神经再生能力。一方面可能是残存的神经元增多所致;一方面可能是抑制炎症损伤后,改善神经损伤后的微环境有利于神经再生所致。通过行为学评估TBI 小鼠的神经功能情况,发现CoQ10 可部分改善TBI 后的神经功能障碍,这一结果可能是因为其对炎症损伤的抑制及细胞凋亡的保护作用。
综上所述,TBI 后CoQ10 处理可减少TBI 后脑组织中炎症因子的表达,进而减低细胞凋亡,促进神经细胞再生及部分神经功能康复,对防治TBI后的继发性脑损伤可能具有良好的应用前景,但此类作用的定量机制及关联效应有待更进一步研究,总之,这一理论依据为临床TBI 治疗策略的优化提供了新契机。

