超极化激活环核苷酸门控离子通道2在内脏高敏感性大鼠视上核的表达及作用
毛广通 苗蓓 王德广,3
徐州医科大学1基础医学院人体解剖学教研室,3影像学院(江苏徐州221004);2徐州医科大学附属医院消化科(江苏徐州221006)
肠易激综合征(irritable bowel syndrome,IBS)是常见的功能性胃肠道综合征,严重影响患者的心身健康和生活质量[1]。慢性内脏高敏感性(chronic visceral hypersensitivity,CVH)是IBS 的主要病理生理改变之一,表现为慢性腹痛、大便性状和排便频率改变等[2-3]。IBS 存在明显的脑-肠相互作用,神经系统功能异常可导致黏膜免疫功能改变、胃肠动力紊乱、肠道菌群改变和内脏高敏感性等体征,但机制尚未明确[4-6]。因此研究IBS 疾病的脑-肠机制将加深对IBS 慢性内脏高敏感性形成的理解。
视上核(supraoptic nucleus,SON)是内脏活动调节核团之一,可通过视上垂体束的分泌活动参与调控下丘脑-垂体-肾上腺皮质轴(hypothalamic-pituitary-adrenocortical axis,HPA axis)的功能,间接参与IBS 的病理生理过程。视上核可通过分泌催产素发挥阵痛作用,且研究发现慢性疼痛模型中视上核催产素分泌增加,提示视上核的中枢敏化可能参与慢性疼痛的缓解[7-9]。但IBS 的病理生理改变中是否发生视上核中枢敏化却鲜有报道。
超极化激活的环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide gated 2,HCN2)是hcn2 基因编码的电压门控钠-钾离子通道,其独特的电生理特性(膜电位超级化激活,且与cAMP 结合后电活动增强)使HCN2 与神经中枢的敏化关系密切[10-12],并可通过与其他离子通道的相互作用,影响神经元兴奋性、神经递质释放以及神经环路的功能状态。因此,研究内脏高敏感性大鼠视上核HCN2 的表达及功能改变有助于阐释视上核在IBS 病理生理过程中发挥作用的机制,有利于寻找潜在的IBS 治疗靶点。
1 材料与方法
1.1 实验动物新生雄性Sprague-Dawley大鼠38只(亲代大鼠由徐州医科大学实验动物中心提供),随机分为假手术(Sham)、结直肠扩张(CRD)、溶剂(Vehicle)、ZD7288 1 ng、ZD7288 10 ng 和ZD7288 100 ng 组,6 只/组,立体定位矫正补充2 只。母乳喂养,21日龄断奶分笼,每4 只幼鼠1 笼,室温、昼夜节律,自由摄食饮水。本实验遵从国际疼痛研究联合会(international association for the study of pain,IASP)相关指南,以尽量减少实验动物数目及对实验动物伤害为原则,并经徐州医科大学实验动物伦理委员会批准。
1.2 主要试剂小鼠抗c-Fos 单克隆抗体、山羊抗小鼠红色标记荧光二抗、山羊抗兔绿色标记荧光二抗购自上海艾博抗贸易有限公司;兔抗HCN2 多克隆抗体购自北京博奥森生物技术有限公司;免疫组织化学(二步法)试剂盒购自北京中杉金桥生物工程有限公司。
1.3 主要仪器脑立体定位仪购自深圳市瑞沃德生命科技有限公司;BL-420E+多道生理记录仪购自成都泰盟软件有限公司;CK50-F200 倒置显微镜购自日本Olympus 公司。
1.4 新生大鼠CRD参照并微调AL-CHAER 等[13]的报道,采用新生大鼠CRD 法制备慢性内脏高敏感性模型。大鼠分别于8、10、12日龄接受CRD:将涂有液体石蜡的长10 mm、直径3 mm 经皮冠状动脉腔内成形术(PTCA)球囊通过幼鼠肛门置入末段结肠,以60 mmHg 压力持续扩张1 min(2 次/d,间隔30~60 min),然后撤压、移除球囊并清洁肛门,将幼鼠送归母鼠笼喂养。Sham 组幼鼠仅作球囊置入,不扩张。
1.5 CRD 刺激球囊置入参考文献制作成年大鼠CRD 刺激球囊[13]。大鼠8 周龄时检测其内脏敏感性,检测前禁食不禁水约18 h。2%异氟烷麻醉后,经大鼠肛门将液体石蜡润滑的球囊置入结肠(约4 cm),妥善固定于大鼠尾根部后将大鼠转移至透明观察箱(12 cm × 20 cm × 9 cm)内,待其复苏并适应30 min 后依次进行腹壁撤退反射(AWR)、内脏痛阈和腹外科肌放电肌电图(EMG)实验。
1.6 病理检测
1.6.1 AWR双盲法记录大鼠AWR评分。球囊经三通与血压计相连,注空法使球囊压力分别达到20、40、60 和80 mmHg,每次持续10 s,间隔4 min,每个压力重复3 次,所得数据取均值录入。AWR评分标准:0 分,大鼠无显著行为改变;1 分,大鼠自由活动停止伴/不伴头部运动;2 分,大鼠腹部变平,尚未显著抬离桌面;3 分,大鼠腹部显著抬离桌面;4 分,大鼠腹、背躬起,伴骨盆抬起。
1.6.2 内脏痛阈的检测双盲法观察大鼠内脏痛阈。经三通将球囊与注射器和血压计相连,待大鼠完全苏醒并适应环境30 min 后注入空气,初始压力10 mmHg,若大鼠无AWR 评分3 分的行为表现,则间隔4 min,增加10 mmHg 压力,直至出现AWR 评分3 分或压力达到80 mmHg,记录压力值并结束本次痛阈检测。痛阈检测共进行3 次,取均值后录入。
1.6.3 EMG检测提前3天将电极埋置于腹外斜肌内(髂棘水平,距腹中线约1~1.5 cm),参照AWR评分的检测方法进行CRD,并用BL-420E 信号采集系统采集EMG 数据(参数设置:灵敏度500 μV,高频滤波2 kHz,采样频率50 Hz,时间常数0.001 s,走纸速度500 ms/div)。每次CRD 前先记录10 s 基础放电,再记录10 s CRD 诱导的腹外斜肌放电,导出EMG 波形的曲线下面积(AUC),记录腹外斜肌放电与基础放电的差值。每个压力测量3 次,所得AUC 取均值后录入。实验结束2 h 后,对Sham组和CRD 组大鼠进行4%甲醛灌注(或断首处死)取脑及结肠(结肠左曲至骨盆入口段),用于形态学研究检测或Western blot 分析。
1.7 视上核立体定位注射提前1 周将立体定位注射套管植入大鼠双侧视上核(Vehicle 组和各浓度ZD7288 组;坐标:前囟点后0.90 mm;双侧旁开2.00 mm;颅表以下9.20 mm),牙科水泥包埋。大鼠8 周龄时,置入CRD 刺激球囊(操作同前述)。经套管向双侧视上核各注入0.5 μL 预先配制好的溶液,计量参照文献[14]和预实验结果确定:Vehicle组注射生理盐水;ZD7288 组注射HCN2 通道抑制剂ZD7288,总剂量分别为1、10、100 ng/只(浓度分别为1、10、100 ng/μL)。2 h 后开始AWR、痛阈和EMG 检测,检测结束2 h 后处死取脑(同前述)。
1.8 结肠组织HE 染色将固定好的结肠取出,双蒸水反复冲洗后脱水、透明、石蜡包埋、切片(5 μm),HE 染色后脱水、透明、封片,光镜下摄片,图像分析。
1.9 中性红染色将完成沉糖的鼠脑取出,冠状位冰冻切片(厚度30 μm),中性红染色、封片后光镜下摄片、分析视上核立体定位是否准确。
1.10 免疫组织化学染色(二步法)鼠脑切片清洗后,兔二步法试剂盒试剂I 灭活内源性过氧化物酶,随后依次0.1% Triton X-100 孵育10 min、4%山羊血清室温孵育2 h,兔抗HCN2(1∶200)或小鼠抗c-Fos 单克隆抗体(1∶1 000),4 ℃过夜;依次室温孵化试剂Ⅱ和试剂Ⅲ,各20 min,DAB 显色5 min,梯度酒精脱水、二甲苯透明、中性树脂封片,Olympus光学显微镜摄片。根据Paxinos 和Watson 大鼠脑图谱[15],低倍镜下辨析视上核形态,每组取相同部位的6 张照片,高倍镜下辨析阳性染色,应用Imagepro Plus 6.0 软件进行阳性细胞计数,统一添加比例尺(Bar=100 μm)。
1.11 免疫荧光染色鼠脑切片清洗后,依次0.1%Triton X-100 孵育10 min、4%山羊血清室温孵育,兔抗HCN2 多克隆抗体(1∶200)小鼠抗c-Fos 单克隆抗体(1∶1 000)混合一抗4 ℃过夜;1∶500 混合荧光二抗室温2 h,DAPA 复染5 min,50%甘油封片,Olympus 荧光显微镜摄片。图片分析同前述。
1.12 Western blot应用Western blot 法检测视上核目的蛋白表达,步骤如下,将鼠脑腹面朝上置于冰面,沿视神经剥离视交叉至视神经潜入脑实质段的浅层、狭长丘脑组织,提取蛋白、制样、配胶、上样、电泳、转膜、封闭,1∶500 兔抗HCN2 抗体、1∶2 000 小鼠抗c-Fos 抗体或1∶1 000 小鼠抗β-actin 孵育4 ℃过夜,二抗室温孵育2 h,发光法显色,摄片,ImageJ 8.0 软件分析灰度值。
1.13 统计学方法使用SPSS 16.0软件统计分析,Graphpad prism 8.3.0 软件作图,计量资料以均数±标准差表示,满足正态分布时采用t检验,不满足时采取Welch′st检验;多组比较,参数满足方差齐性时采方差分析,组间对比采用独立样本t检验,不满足方差齐性时采用Brown-Forsythe and Welch方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 慢性内脏高敏感大鼠模型的建立与Sham组相比,20、40、60 mmHg 压力下8 周龄CRD 组大鼠AWR 评分显著升高(P<0.05,图1A);40、60、80 mmHg 压力下AUC 显著升高(P<0.05,图1B);痛阈明显降低(P<0.05,图1C)。HE 染色显示,与Sham 组相比,CRD 组大鼠结肠肠壁各层结构完整,间质无明显水肿,无中性粒细胞、单核细胞等炎性细胞浸润,无显著纤维结缔组织增生(图1D)。以上结果表明CRD 组大鼠成年后内脏敏感性显著增强,未见明显结肠病理性改变,符合IBS 的病理生理特征,CVH 大鼠模型建立成功。
2.2 大鼠视上核HCN2 通道上调参与对CVH 的调控行为学检测2 h 后,免疫组织化学染色和Western blot 显示,CRD 组大鼠视上核HCN2 表达较Sham 组明显上调(P<0.05,图2);免疫组织化学染色显示,Sham 组大鼠视上核偶见c-Fos 阳性细胞,CRD 组大鼠c-Fos 阳性细胞显著增加(P<0.05,图3);荧光双标染色显示,CRD 组大鼠视上核HCN2(绿色)和c-Fos(红色)共标细胞较Sham 组显著增多(P<0.05,图4)。c-fos 基因是早期表达的原癌基因,正常情况下低水平表达于大部分细胞中,其转录翻译产物c-Fos 蛋白的上调可作为细胞活化的标志[16-17]。以上结果表明,大鼠视上核HCN2 表达上调参与对CVH 的调控。
2.3 抑制视上核HCN2通道对模型大鼠的CVH样行为起加重作用参照Paxinos 和Watson 大鼠脑图谱对立体定位的准确性进行组织学鉴定(中性红染色法,图5A)。最初接受立体定位的模型大鼠24 只,经鉴定,定位偏斜2 只,补充注射对应分组的模型大鼠2 只,定位准确并纳入统计的大鼠共24 只。ZD7288 立体定位注射2 h 后,与Vehicle 组相比,40 mmHg 压力下AWR 评分(P<0.05,图5B)和AUC(P<0.05,图5C)呈剂量依赖性升高,痛阈呈剂量依赖性降低(P<0.05,图5D);Western blot结果显示,与Vehicle 组相比,100 ng ZD7288可显著降低c-Fos 和HCN2 的表达(P<0.05,图5E、F)。以上结果表明,抑制视上核HCN2 通道对模型大鼠的CVH 样行为起加重作用。

图1 CVH 模型大鼠病理检测和结肠组织HE 染色Fig.1 Pathologicl detection and HE staining of colon tissue in CVH rats
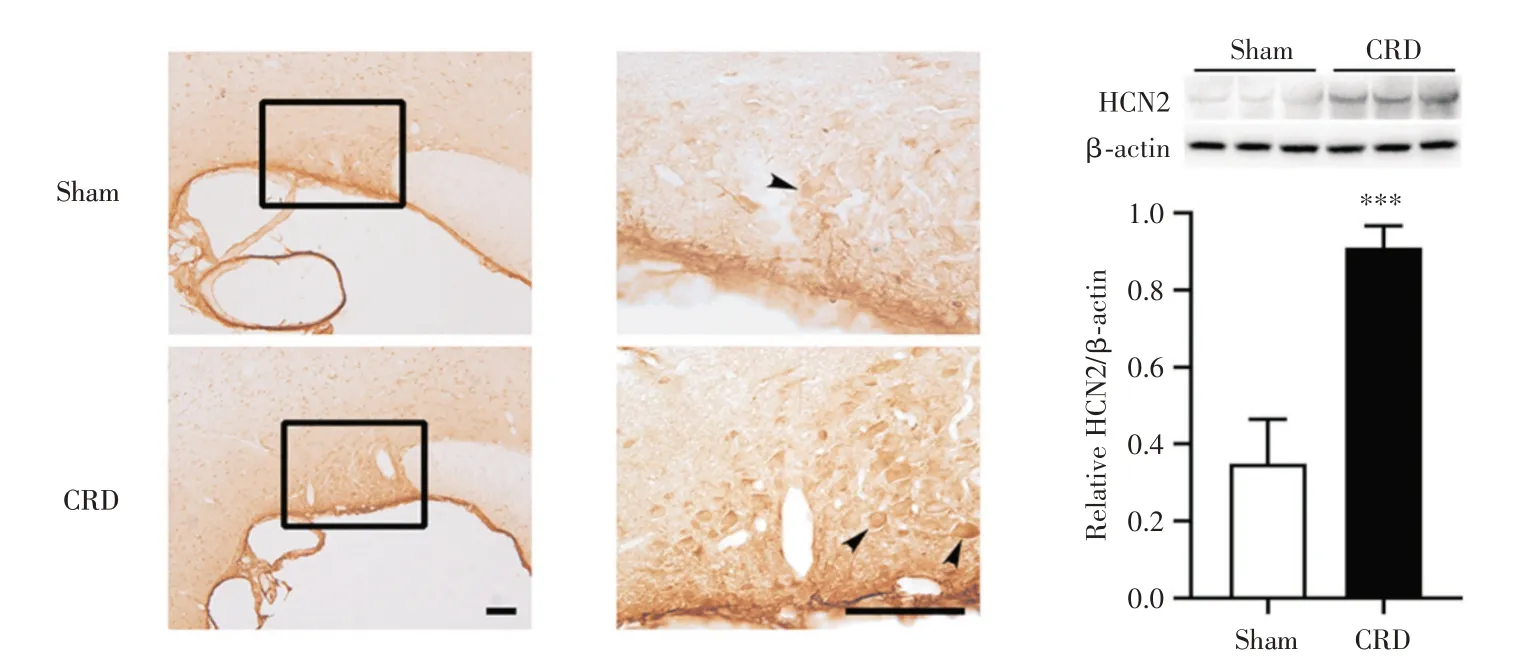
图2 CVH 大鼠视上核HCN2 表达Fig.2 The expression of supraoptic HCN2 in CVH rats

图3 CVH 大鼠视上核c-Fos 表达Fig.3 The expression of supraoptic c-Fos in CVH rats

图4 CVH 大鼠视上核HCN2 和c-Fos 双标阳性细胞Fig.4 HCN2+/c-Fos+cells in SON of CVH rats
3 讨论
内脏高敏感性是肠易激综合征的特征性表现,表现为肠道对各种内外环境刺激(肠气、粪便、结直肠扩张等)的过度反应,可伴有中枢神经系统下行抑制的弱化和痛觉的中枢敏化[18-21]。既往研究发现,IBS患者和CVH动物具有诸多相似的表现,如HPA 轴活动性增强,循环CRF 水平升高[22-24];来自IBS 患者或CVH 动物的粪便移植,均可导致正常鼠内脏敏感性升高[25-26];核磁共振下观察CRD 诱导的中枢活动,发现IBS 患者和CVH 动物存在相似的脑区活动[27-29]。AL-CHAER 等[13]和LIN 等[30]研究发现,对新生期大鼠进行多次CRD 刺激可导致大鼠成年后内脏敏感性升高。此后,新生期CRD诱导成年大鼠CVH 模型成为被广泛采纳的IBS 动物模型,是研究IBS 中枢机制的理想平台之一。
视上核是下丘脑调节内脏活动的核团之一,除了参与调控垂体的分泌活动外,还参与内脏感觉的调节[31-33]。本研究以新生期CRD 诱导成年大鼠CVH 模型为研究平台,发现与对照大鼠相比,CVH 模型大鼠对结直肠刺激的敏感性升高,且结直肠刺激可诱导视上核c-Fos 的表达上调。c-Fos基因是早期表达的原癌基因,正常情况下低水平表达于大部分细胞中,其转录翻译产物c-Fos 蛋白的上调可作为细胞活化的标志[16-17]。因此,c-Fos的表达上调提示CVH 模型大鼠视上核发生中枢敏化,表明视上核参与对CVH 的调控。
HCN2 是一种超极化电位激活的环核苷酸门控阳离子通道,可产生内向电流,增强神经元的放电倾向[10,34-35]。本研究发现CVH 模型大鼠视上核c-Fos 阳性细胞的HCN2 表达上调,提示HCN2 表达上调参与视上核的中枢敏化。HCN2 通道抑制实验表明,ZD7288(HCN 通道特异性抑制剂)立体定位注射可剂量依赖性地下调视上核HCN2 和c-Fos的表达并加重大鼠的CVH 样行为,表明抑制HCN2可使CVH 模型大鼠视上核脱敏并提高大鼠的内脏敏感性,提示视上核HCN2 表达上调可能抑制CVH模型大鼠内脏敏感性的升高。既往研究表明,视上核可通过分泌催产素发挥阵痛作用;由于视上核存在显著的“兴奋-分泌偶连”现象,且ZD7288可显著降低大鼠视上核神经元的放电频率,故CVH模型大鼠视上核HCN2 的上调,可增加视上核的激素分泌活动[36-38]。结合本研究的结果,证明CVH模型大鼠视上核HCN2 表达上调对大鼠内脏高敏感性起抑制性作用。
值得注意的是,HCN2 在脊髓和外周痛觉神经元上也有分布,鞘内注射ZD7288 抑制HCN2 通道可以缓解CVH 大鼠的腹部症状[39]。由于目前HCN通道抑制剂均无法通过血脑屏障,故HCN 通道抑制类药物有可能从阻断外周的痛觉传导和非抑制视上核的阵痛作用两个方面发挥控制IBS 症状的作用,但该假设有待临床研究考证。
综上所述,下丘脑视上核通过上调HCN2 通道蛋白参与抑制大鼠的内脏高敏感性。

图5 ZD7288 对CVH 大鼠的内脏敏感性以及视上核c-Fos 和HCN2 表达的影响Fig.5 Effects of ZD7288 on the visceral sensation and the expression of c-Fos and HCN2 in supraoptic nucleus of CVH rats

