蒲公英根际微生物分离及生化初步鉴定
郭晓农,张 妍,董江陵,姬冰茹
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心生物工程与技术国家民委重点实验室,甘肃 兰州 730030;3.西北民族大学 生物医学研究中心中国-马来西亚国家联合实验室,甘肃 兰州 730030)
植物根际是植物与土壤进行能量交换最活跃部位,绝大部分物质、能量与信息交换在这一小部分区域内进行[1].随着现代农业的发展,化肥、农药等化学品的过度使用,以及人们中长期连作影响,使得土壤结构被破坏,土地荒漠化、盐碱化加重,进而导致作物质量下降[2-3],因此,人们开始关注具有环保、安全等特点的根际微生物[4].根际微生物根据其对植物的作用可以分为有益微生物、中性微生物和有害微生物三类[5],而人们常用的是有益微生物,比如植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR,简称促生菌).植物根际促生菌(PGPR)的生存和对环境的适应能力较强,不同的植物根际有不同的菌群,对植物起着直接或者间接的作用,影响植物的生长发育.PGPR可以分泌多种植物激素来促进植株的生长,比如细胞分裂素、赤霉素、生长素等[6].可以通过分泌嗜铁素或产生氰化物等防治植物病害,提高植株的抗逆性[7],还可以促进矿质营养吸收利用和植物生长,抑制有害微生物[8].王艳霞[9]、郑娜[10]、王琦琦[11]等人通过分离盐碱化土壤中的菌株筛选出耐盐胁迫的根际促生菌,发现PGPR是通过诱导植物产生耐受机制,以确保植物能在盐碱化环境中生长[12].
蒲公英(TaraxacummongolicumHand.-Mazz.),为多年生草本植物,种类繁多[13-14],属于药食两用的材料[15-16],常被作为药物使用.在《唐本草》、《本草纲目》、《中国药典》等典籍中都有记载[17],被称为“天然抗生素”.蒲公英形态优美,耐寒耐旱[18-19],其化学成分较为复杂,从中分离出的化合物多达50种,有多糖类、芬酸类、黄酮类、香豆素、甾醇类等[20-21],其广泛应用于现代药理学中.目前的研究多集中于蒲公英的生物活性物质,但对于蒲公英根际微生物的研究却鲜有报道.
蒲公英具有较强的环境适应能力,为了研究蒲公英根际微生物的多样性,本实验以西北民族大学榆中校区蒲公英根际土壤为材料,开展蒲公英根际微生物初步研究.
1 材料与方法
1.1 材料
1.1.1 供试植株
蒲公英,样品采集于西北民族大学榆中校区(104°9′E,35°56'N),采集生长良好的蒲公英作为根际微生物分离材料.
1.1.2 培养基及试剂
牛肉高蛋白胨固体培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,琼脂粉15 g,pH调至7.4.
吲哚试剂:对二甲氨基苯甲醛1 g,于95 ml 95%乙醇中溶解,之后缓慢加入20 ml浓盐酸.
1.2 试验方法
选取肉眼观察后形态不同的菌落进行四区划线,对菌种进行分离、纯化,最终得到单菌落后做生化鉴定.首先从平板观察培养菌落形态,并拍照记录,然后通过生理生化实验对照《伯杰细菌鉴定手册》确定菌种类别.其中生化鉴定包括:形态观察、革兰氏染色、触酶实验、吲哚实验等.
1.2.1 菌种分离纯化
将所采样取根部至于牛肉膏蛋白胨液体培养基中,放入恒温震荡箱中180 r/min 30℃震荡12 h,然后取出进行梯度稀释,吸取菌液涂布均匀后培养[22-23].挑取形态不同的菌落采用四区划线法于培养皿中划线稀释,直到出现单菌落后测定菌株的生理生化指标.
1.2.2 革兰氏染色法
在载玻片中央滴加一滴0.9%生理盐水,用灭菌接种环挑取菌落放入盐水中,均匀涂片,风干后,用结晶紫染液染色1~2min,水洗,用碘液覆盖1min,水洗,吸干水分后滴加95%乙醇脱色,水洗,吸干水分,番红复染2min,水洗后晾干镜检[24-26].
1.2.3 吲哚实验
于蛋白胨水培养基中接种菌株,37 ℃下培养72 h,沿管壁缓慢加入5~10滴吲哚试剂,观察实验结果,同时做空白试验.若乙醚层呈现玫瑰红色,则说明可产生吲哚,此为吲哚实验阳性反应,用“+”表示,否则为阴性反应,用“-”表示.
1.2.4 过氧化氢酶实验
用灭菌接种环挑取实验菌株于干净的载玻片上,之后滴加3~4滴5%过氧化氢溶液,观察结果.若0.5 min内产生气泡,则为阳性,反之则为阴性.
2 结果
2.1 菌株的分离纯化
通过平板划线法进行分离、纯化,得到单菌,进行革兰氏染色等生化鉴定试验.通过实验,观察菌落涂布可以发现,当选取浓度较高的菌液进行涂布时,培养皿上生长的菌落过于密集,所以涂布时选取的菌液浓度要适当.
2.2 形态观察
在分离纯化得到的微生物菌株中,对其进行形态特征的观察,并拍照记录单菌落的形态特征,作为鉴定菌株的依据,图1为分离纯化后的菌株在牛肉膏蛋白胨培养基平板上的菌落特征.
由图 1可知,1号菌株的菌落为白色,形态较大,呈圆形,中部隆起;2号菌株的菌落为白色,此菌株在培养相同时间内能够产生代谢物,形态较小,为圆形;3号菌株的菌落为黄色,形态较小,边缘较为平整,呈圆形;4号菌株的菌落呈黄色,形态较大,中间隆起,呈圆形.
2.3 革兰氏染色
革兰氏阳性菌(G+菌)细胞壁中肽聚糖含量高,细胞壁厚.肽聚糖网状结构可以保留碘-结晶紫络合物,因此革兰氏阳性菌经复染剂染色后仍然是蓝色;革兰氏阴性菌(G-菌)细胞壁中肽聚糖含量低,细胞壁薄.用乙醇或丙酮脱色后,细菌变成无色,染色剂重新染色后,变为复染剂颜色.因此革兰氏阳性菌染色后为蓝紫色,革兰氏阴性菌染色后为红色.

A:1号菌株;B:2号菌株;C:3号菌株;D:4号菌株 A:1号菌株;B:2号菌株;C:3号菌株;D:4号菌株
由图 2可以看出,1号菌株,形态呈杆状,部分弯曲,经革兰氏染色后呈现红色,为革兰氏阴性菌;2号菌株,形态呈球形,经革兰氏染色后呈紫色,为革兰氏阳性菌;3号菌株,形态呈球形,多粘连在一起为链状,经革兰氏染色后呈紫色,为革兰氏阳性菌;4号菌株,形态呈直杆状,经染色后呈紫色,为革兰氏阳性菌.
2.4 吲哚实验
由吲哚实验发现,1号、2号、3号、4号菌株的乙醚层均未呈现玫瑰红色,说明这四种菌株都不能够产生吲哚.
2.5 过氧化氢酶实验

表1 过氧化氢酶实验结果
由表1可知:1号菌株为厌氧菌,2号、3号、4号菌株均为好氧菌.
2.6 菌株鉴定结果
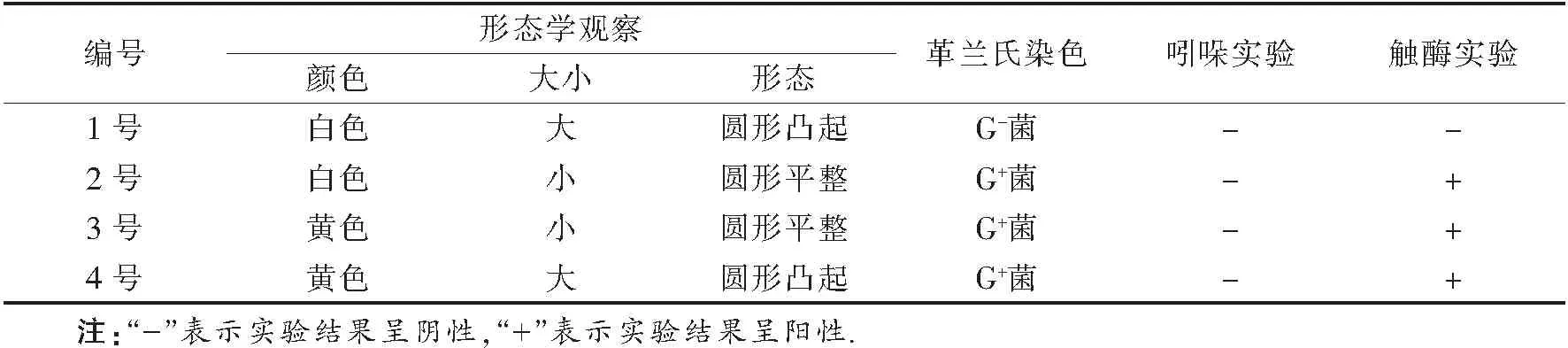
表2 菌株鉴定结果
通过对分离、纯化后的菌株进行形态观察、生理生化等试验,查阅《伯杰细菌鉴定手册》进行对照后发现,1号菌种属于假单胞菌属(Pseudomonas),2号菌种属于微球菌属(Micrococcus),3号菌种属于链球菌属(Streptococcus),4号菌种属于芽孢杆菌属(Bacillus),分离菌株均为土壤中常见菌属,体现了蒲公英根际微生物的多样性[27].
3 讨论
通过革兰氏染色等生理生化试验发现,分离得到的4株单菌分别为假单胞菌属、微球菌属、链球菌属、芽孢杆菌属,其中假单胞菌属为变形菌门,芽孢杆菌属、链球菌属为厚壁菌门,由此推测,蒲公英根际微生物的优势菌门可能是厚壁菌门.对比其他植物根际微生物的研究,钱兰华等[28]对江苏南通海边滩涂的土壤样品中筛选出5株耐盐菌株,发现其中具有耐盐促生能力的是巨大芽孢杆菌(Bacillusmegaterium);汪娅婷等[29]对云南玉米根际微生物进行研究发现,在所研究的样地中,变形菌门在细菌群落分布中的相对丰度最高,拟杆菌门、变形菌门和放线菌门是共同具有的优势菌门.说明,不同土壤当中根际微生物的组成和结构不同,但厚壁菌门、变形菌门、放线菌门等为共有的优势菌门.
根际促生菌在土壤中长期生存,形成了许多优良特性,比如PGPR能够通过促进植物对于养分的吸收或者产生激素类物质来促进植物的生长发育,这样既可以提高植物次级代谢产物的积累,又可以诱导植物体内的抗病性或抗逆性,使植物对病害或逆境及时发出响应,以增强植物的抗逆性[30-31].基于这几种优良特性,PGPR 被用作植物生物制剂或生物防治制剂,而PGPR 生物制剂可以部分或完全代替化学肥料、杀虫剂等微生物制剂[32-33].因此,利用土壤有益微生物开发菌肥、菌剂等产品具有广阔的应用前景[34].
4 结论
本次实验以蒲公英根际土壤为实验材料,共分离得到4种菌株,分别为假单胞菌属、微球菌属、链球菌属、芽孢杆菌属.其中,假单胞菌属、芽孢杆菌属对植物生长有促进作用,属于根际有益微生物,即根际促生菌[35].假单胞菌和芽孢杆菌是土壤中常见的根际促生菌株.

