虫瘿篮状菌和伪子座篮状菌-篮状菌属紫篮状菌组的两个我国新记录种
王 龙,阮永明,金世宇
(1.中国科学院 微生物研究所真菌学国家重点实验,北京100101;2.浙江师范大学 化学与生命科学学院,浙江 金华321004;3.北京市京西林场,北京 102300)
0 引言
蓝状菌属(TalaromycesC.R. Benj.)物种是土壤植物残体的主要分解者,有些种类分解能力非常强大,如嗜松蓝状菌(T.pinophilus(Hedgc.) Samson, N. Yilmaz,Frisvad & Seifert)和小疣蓝状菌(T.verruculosus(Peyronel) Samson,N. Yilmaz,Frisvad & Seifert)分泌强大的纤维素酶从而有效分解木质纤维素[1, 2]。还有些种类,如T.pinophilus和产紫蓝状菌(T.purpurogenusSamson,N. Yilmaz,Houbraken,Spierenb,Seifert,Peterson,Varga & Frisvad)分泌有机酸和磷酸酯酶,溶解无机磷酸钙及磷酸酯从而促进植物对磷元素的吸收[3, 4]。另外,沃特曼蓝状菌(T.wortmanni(Klöcker) C.R. Benj.)在植物根际分泌挥发性有机物 (volatile organic compounds,VOCs) 从而促进植物生长及增强对病原菌的抗性[5]。该属的大多数物种通常产生红色、粉色、黄色和橙色的菌丝体、渗出液和可溶性色素. 这些色素属于聚酮类嗜氮酮次级代谢产物(polyketide azaphilone secondary metabolites),如丝红素(mitorubrins)和红曲红色素(Monascusred pigments),有些色素有望开发为食品添加剂,如暗玫瑰蓝状菌(T.atroroseusN. Yilmaz, Frisvad,Houbraken & Samson)产生的色素[6]。蓝状菌许多物种及特性有待发现和开发利用,而物种调查、分离、鉴定和保藏是这些工作的重要基础。
蓝状菌属绝大多数种的无性阶段产生对称双轮生帚状枝和披针形瓶梗,若存在有性阶段,则产生裸囊壳(gymnothecia)型子囊果,其内不规则着生不定数目的子囊,每个子囊内生有8个不规则分布的子囊孢子。子囊孢子通常呈椭球形,壁带刺。Pitt[7]根据双命名系统(dual naming system)将蓝状菌物种分别划归在蓝状菌属和青霉属的双轮亚属(PenicilliumLink subgenusBiverticillium)中。后来的分子种系发生学(phylogenetics,Gr. phyle=tribe,genesis=birth)显示蓝状菌属和青霉属的双轮亚属的物种应属于同一个单系类群,从而支持取消双重命名系统而采用“一个真菌一个名称(one fungus,one name)”的命名系统[8-11],最终确定Talaromyces作为这类物种的合法属。2014年,Yilmaz et al.承认了Talaromyces的88 个种,并将Talaromyces分成7个组(sections),即蓝状菌组(sectionTalaromyces)、螺旋蓝状菌组(sectionHeliciYilmaz,Frisvad & Samson)、紫蓝状菌组(sectionPurpureiStolk & Samson)、糙孢蓝状菌组(sectionTrachyspermiYaguchi & Udagawa)、杆孢蓝状菌组(sectionBacillisporiYimaz,Frisvad & Samson)、近膨蓝状菌组(sectionSubinflatiYilmaz,Frisvad & Samson)和岛蓝状菌组(sectionIslandici(Pitt) Yilmaz,Frisvad & Samson),其中TalaromycessectionPurpurei只有10个种[12]。紫蓝状菌组的种类通常在培养较长时间后会产生菌丝束(synnemata或coremia),具有该特征的物种曾经被Pitt划归于双轮亚属产束组(sectionCoremigenum(Biourge) Pitt)的树状系(seriesDendriticaPitt)和杜克劳系(seriesDuclauxiiRaper & Thom)[7]。
紫蓝状菌组的物种属于稀有种(rare species),自从2014年以后,该组没有新的物种报道. 我国2007年的《中国真菌志第35卷·青霉属及其相关有性型属》专著中该组无记录种[13],直到本文投稿时我国也尚未报道过该组的物种。蓝状菌物种鉴定工作比较困难,主要因为其物种间的显微结构特征差别较小,因此除了一些特征明显的物种外,如绳状篮状菌(T.funiculosus(Thom) Samson)、马尔尼菲蓝状菌(T.marneffei(Segretain,Capponi & Sureau) Samson,N. Yilmaz,Frisvad & Seifert),其准确鉴定主要依据分子种系学方法。国际上虽然选定了rDNA ITS1-5.8S-ITS2(ITS)作为真菌的分子遗传标记码(genetic barcode),但 ITS 不能区分Talaromyces的近缘种,如艾米斯托克篮状菌(T.amestolkiaeN. Yilmaz,Houbraken, Frisvad & Samson)和斯托尔篮状菌(T.stolliiN. Yilmaz,Houbraken, Frisvad & Samson)。因此必须选择蛋白质基因作为候选遗传标记,如钙调蛋白基因(calmodulin gene)和β-微管蛋白基因(β-tubulin gene,BenA),β-微管蛋白基因几乎可以区分Talaromyces的各个物种[12]。在本研究中,我们依据形态学和基于BenA和ITS序列的分子种系学,鉴定出了TalaromycessectionPurpurei的2个物种, 即虫瘿蓝状菌T.cecidicola(Seifert,Hoekstra & Frisvad) Samson,N. Yilmaz,Frisvad & Seifert和伪子座蓝状菌T.pseudostromaticus(Hodges,G.M. Warner & Rogerson) Samson,N. Yilmaz, Frisvad & Seifert,其中T.cecidicola菌株WH6-2=AS3.16006分离自河南卫辉农田土壤,T.pseudostromaticus菌株EJ2-12=AS3.16005分离自内蒙古额济纳旗土壤。
1 材料与方法
1.1 菌株分离
土壤样品采自我国河南卫辉和内蒙古额济纳旗,样品约25 g置于无菌的塑料袋中封好。样品分离采用改进的Malloch[14]的倍比稀释倾倒平皿法,即采用灭菌的 0.1% 羧甲基纤维素钠(CMC-Na,carboxymethyl cellulose sodium salt)或琼脂水溶液(agar water solution)代替无菌水制作样品悬浊液[15],采用该分离方法分离效果很好,得到很多株蓝状菌。其中两株菌,即WH6-2 和EJ2-12 经鉴定属于TalaromycessectionPurpurei并保存于中国普通微生物菌种保藏中心(China General Microbiological Culture Collection Center,CGMCC),保藏号分别为 AS3.16006和AS3.16005。
1.2 形态学研究
培养基及培养条件为查氏酵母精琼脂(CYA)25 ℃、37 ℃和5 ℃,麦芽精琼脂(MEA)25 ℃,均培养7 d后观察和描述[16],菌落颜色的描述参照Ridgway的色谱[17]。显微结构挑取在MEA 25 ℃ 7 d时的产分生孢子结构做光学显微镜载片观察和描述。
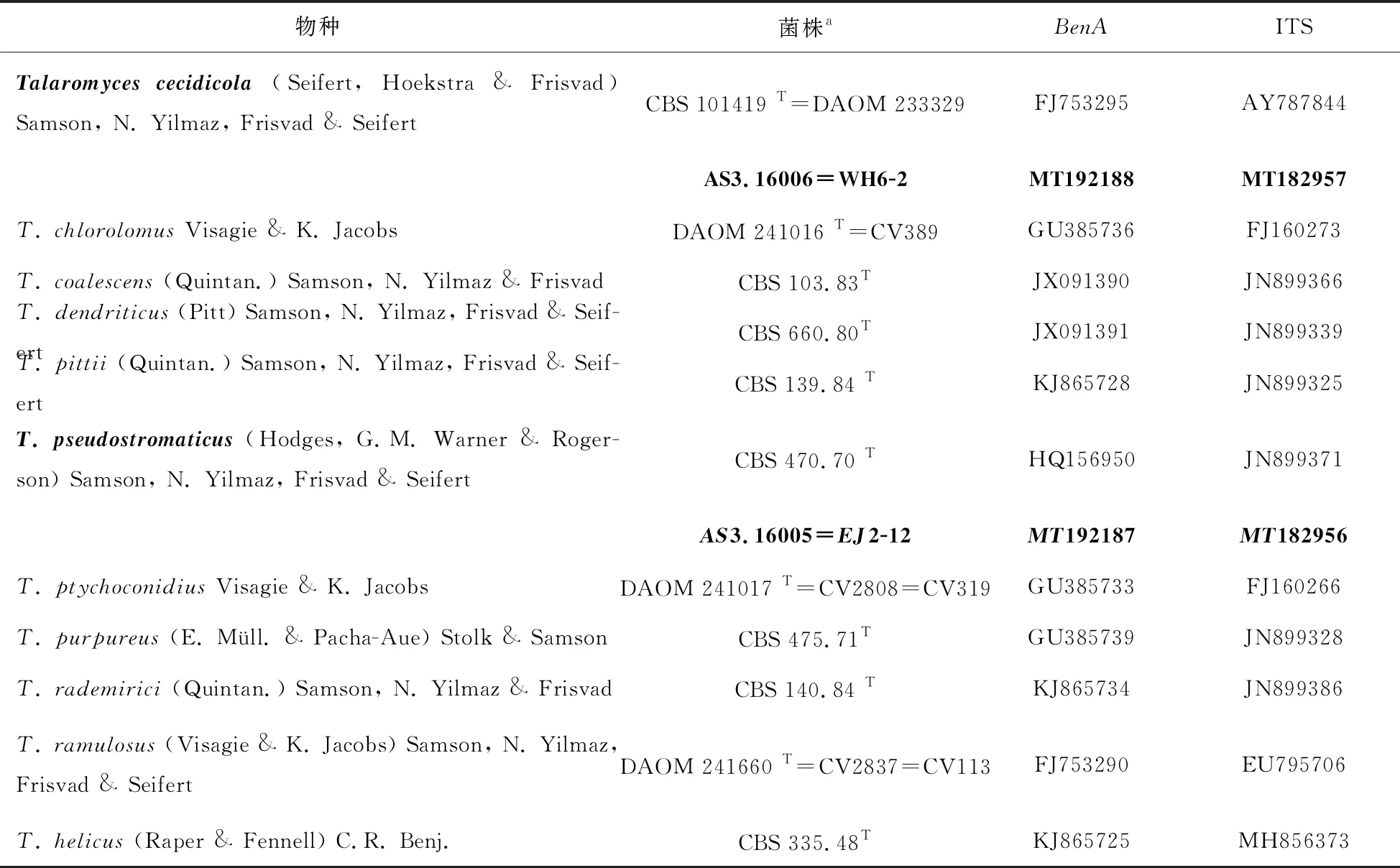
表1 用于分子种系学分析的Talaromyces Sect. Purpurei的10种12株菌及外群T. helices CBS 335.48T
1.3 分子种系学研究
DNA的提取参考Wang and Zhuang[18]。扩增BenA的引物为bt2a和bt2b[19];扩增ITS引物选择ITS5和ITS4[20]。PCR扩增反应在无菌的0.2 mL薄壁平盖Eppendorf管中进行,20 μL反应体系含有基因组DNA 1.0 μL,正向和反向引物(10 μM)各0.5 μL,双蒸水8 μL,2×PCR扩增缓冲液(0.05 u/μL Taq polymerase,4 mM MgCl2,0.4 mM dNTPs)10 μL. PCR扩增反应程序为94 ℃ 加热3 min;然后共进行30个循环:94 ℃ 变性30 s,50 ℃ 退火30 s,72 ℃ 延伸30 s;最后在72 ℃ 延伸5 min。PCR产物各取5 μL与5 μL的100 bp DNA ladder用2.0%的琼脂糖凝胶(agarose gel)在80 V电压下电泳15 min,再用0.5 g/mL的溴乙锭(EB,ehidium bromide)染色10 min后在波长365和254 nm的紫外灯下观察。显示单一、明亮扩增区段长度条带的PCR扩增产物(BenA约400 bp,ITS约600 bp)由生物技术有限公司用ABI3730(Applied Biosystems,Drive Foster City,CA,USA)进行双向直通测序。原始序列用软件Bioedit 7.0.9[21]进行人工校对、编辑,得到准确无误的全区段序列并提交到GenBank。紫篮状菌组的10个物种的模式菌株和本研究的2个菌株及外群螺旋蓝状菌(T.helicus(Raper & Fennell) C.R. Benj)模式菌株CBS 335.48的BenA和ITS序列(Table 1),以及BenA-ITS的组合序列分别用MEGA 5[22]进行对位排列(alignment)后,修剪掉序列不对齐的位点做成3个序列矩阵,然后采用最大可能法(Maximum Likelihood,ML)分析,并用自展法(bootstrap)进行1000次重复评估各分支的可靠性,其中空格(gaps)选择“partial deletion[23]”。另外,这3个序列矩阵还采用贝叶斯法推断(Bayes Inference,BI)计算各分支的后验概率(posterior probability)[24]。
2 结果
2.1 新纪录种的形态学描述
虫瘿篮状菌Talaromyces cecidicola(Seifert, Hoekstra & Frisvad) Samson,N. Yilmaz,Frisvad & Seifert,Stud. Mycol. 71: 175. 2011(图1)。
≡PenicilliumcecidicolaSeifert,Hoekstra & Frisvad,Stud. Mycol. 50: 520. 2004[25]。

注:(a, b) 在CYA和MEA上25 ℃7 d;(c, d) 分生孢子梗;(e,f) 分生孢子,标尺:10 μm。
在查氏酵母膏琼脂(CYA)上25 ℃7 d,菌落直径27-29 mm,较薄,平坦,中央稍带短絮,边缘于培养基内,流苏状;质地绒状兼短束状;分生孢子结构大量,暗绿色,近于俄罗斯绿色至镍绿色(Russian Green to Nickel Green,R. Pl. XLII,XXXIII);菌体白色;无色小滴渗出液少量;无可溶性色素;背面中央呈暗红色,近于栗色(Maroon,R. Pl. I),边缘变浅至暖皮黄色(Warm Buff,R. Pl. XV)。
在麦芽精琼脂(MEA )上25 ℃7 d,菌落直径31-33 mm,较薄,表面平坦,中部稍厚,边缘于培养基内,流苏状;质地绒状兼短束状;分生孢子结构大量,中部呈浅蓝绿色,近于尼亚加拉绿色至深瓷绿色(Niagara Green to Dark Porcelain Green,R. Pl. XXXIII );菌丝体呈白色;淡黄小滴渗出液少量;可溶性色素无;背面中部呈褐红色,近于维多利亚色(Victoria Lake,R. Pl. I),外围变浅至浅褐黄色。
在CYA上37 ℃ 7 d,形成2 mm的菌落,在CYA上5 ℃ 7 d,未生长。分生孢子梗发生于表面菌丝和菌丝束,菌丝束300-1000 μm,孢梗茎60-200 μm×3-3.5 μm,壁光滑;帚状枝双轮生、三轮生和四轮生或更复杂,排列不紧密;梗基每轮4-8个,10-15 μm×2.5-3 μm;瓶梗披针形,每轮4-6个,10-15 μm×2.5-3 μm,梗颈较短较细;分生孢子椭球形至柠檬形,3-4 μm×2-3 μm,壁光滑。
主要特征:生长较快,在37 ℃生长局限,产生菌丝束但不明显,分生孢子暗蓝绿色;显微镜载片带绿色,帚状枝双轮生、三轮生和四轮生或更复杂,排列不紧密;瓶梗披针形,分生孢子椭球形至柠檬形,3-4 μm×2-3 μm,壁光滑. 该种产生次级代谢产物apiculide A及其它未定产物[25]。
分布和基物:河南卫辉市庞寨乡柳卫村农田土壤AS3.16006=WH6-2,35° 26′ 31.2″N 114° 18′ 10.8″E,70 m。
伪子座篮状菌Talaromyces pseudostromaticus(Hodges,G.M. Warner & Rogerson) Samson,N. Yilmaz,Frisvad & Seifert,Stud. Mycol. 70: 176. 2011(图 2) 。
≡Penicillium pseudostromaticumHodges,G.M. Warner & Rogerson, Mycologia 62: 1106. 1970[26]。

注:(a, b)在CYA和MEA上25 ℃7 d;(c) 在MEA上25 ℃14 d,可见向光性菌丝束;(d) 菌丝束结构;(e) 分生孢子;(f-h) 分生孢子梗,标尺:10 μm。
在查氏酵母膏琼脂(CYA)上25 ℃7 d,菌落直径21-23 mm,较薄,平坦,边缘于培养基内,无规则;质地绒状;分生孢子结构大量,暗灰绿色,近于(Andover Green,R. Pl. XLVII);菌体白色;无渗出液;无可溶性色素;背面呈暗红色,近于牛血红色(Ox-Blood Red,R. Pl. XXXII)。
在麦芽精琼脂(MEA )上25 ℃7 d,菌落直径36-38 mm,较薄,表面平坦,边缘于培养基内,流苏状;质地绒状,14 d后产生长约5-8 mm的菌丝束,具有向光性;分生孢子结构大量,暗灰绿色,近于(Andover Green to Pea Green,R. Pl. XLVII);菌丝体呈白色;渗出液无;可溶性色素无;背面呈红木色(Mahogany Red,R. Pl. II)。
在CYA上37 ℃7 d,未生长,在CYA上5 ℃7 d,未生长。
分生孢子梗发生于表面菌丝和菌丝束,14 d后菌丝束长达5-8 mm,孢梗茎50-150 μm×3-5 μm,壁光滑;帚状枝双轮生,偶见三轮生和不规则生,排列紧密;副枝2-4个,排列紧,密, 15-25 μm×3-4 μm;梗基每轮4-6个,排列紧密,10-15 μm×2.5-4 μm;瓶梗披针形,每轮4-6个,排列紧密,10-15 μm×2.5-3 μm;分生孢子近球形至椭球形,3-4 μm×2-3μm,壁光滑。
主要特征:生长适度,在MEA上14 d后产生具有向光性的菌丝束;帚状枝双轮生,偶见三轮生和不规则生,排列紧密;瓶梗披针形,分生孢子近球形至椭球形,壁光滑。该种产生多种次级代谢产物,如mitorubrinic acid,secalonic acid D 和Monascusred pigment (azaphilone)[12]。
分布和基物:内蒙古额济纳旗胡杨林(Populuseuphraticaforest)土壤AS3.16005=EJ2-12,42° 0′ 36.0″ N 101° 13′ 26.4″ E,1300 m。
2.2 新纪录种的分子种系学证据
PCR扩增BenA和ITS分别得到长约400 bp和600 bp序列的扩增子(amplicon), 经与Sect.Purpurei的10种模式菌株和外群模式菌株(Table 1)进行对位排列并修剪后分别得447(BenA)个位点和522(ITS)个位点的矩阵,BenA-ITS链接矩阵共 969 位点。
基于BenA、ITS和BenA- ITS这三个序列矩阵得到的系统发育树均显示菌株AS3.16006与T.cecidicola模式菌株CBS 101419同在一个分支,bootstrap支持率分别为100%、95%、99%,后验概率分别为 1.00、0.98、1.00;菌株AS3.16005与T.pseudostromaticus模式菌株CBS 470.70同在一个分支,bootstrap支持率分别为99%、99%、90%,后验概率分别为1.00、1.00、1.00。但在ITS的系统树中,T.pseudostromaticus和T.pittii(Quintan.) Samson,N. Yilmaz,Frisvad & Seifert 无法区分。BenA和BenA-ITS 均支持菌株AS3.16006鉴定为T.cecidicola,AS3.16005鉴定为T.pseudostromaticus. 单独ITS系统树分辨率较低,无法确定菌株AS3.16005的鉴定(图 3-5)。

图3 基于BenA的ML系统发育树。菌株AS3.16006与T. cecidicola的模式菌株CBS 101419同在一个分支,bootstrap支持率为100%,BI后验概率为1;菌株AS3.16005与T. pseudostromaticus的模式菌株CBS 470.70同在一个分支,bootstrap支持率为99%,BI后验概率为1,标尺=0.05每核苷酸替代率

图4 基于ITS1-5.8S-ITS2的ML系统发育树。菌株AS3.16006与T. cecidicola的模式菌株CBS 101419同在一个分支,bootstrap支持率为95%,BI后验概率为0.98;菌株AS3.16005与T. pseudostromaticus的模式菌株CBS 470.70同在一个分支,bootstrap支持率为99%,BI后验概率为1,标尺=0.02每核苷酸替代率

图5 基于BenA-ITS的ML系统发育树。菌株AS3.16006与T. cecidicola的模式菌株CBS 101419同在一个分支,bootstrap支持率为99%,BI后验概率为1;菌株AS3.16005与T. pseudostromaticus的模式菌株CBS 470.70同在一个分支,bootstrap支持率为90%,BI后验概率为1,标尺=0.02每核苷酸替代率
3 讨论
我国的T.cecidicola菌株AS3.16006比模式菌株CBS 101419生长稍慢 (CYA: 27-29 vs. 33-34,MEA: 31-33 vs. 37-38 mm),而且其在CYA和MEA上产生绒状兼稍微颗粒状菌落,模式菌株则产生絮状兼绳状菌落。但在其它菌落形态上二者非常相似,比如它们均产生大量蓝绿色分生孢子,菌落背面呈棕红色,在37 ℃生长局限。在显微形态上,我国菌株AS3.16006产生一些比模式菌株相对复杂的分生孢子梗,但在其它方面则几乎完全相同,比如它们均产生大型的三轮生帚状枝,分生孢子呈椭球形至柠檬型,壁光滑[12, 26]。在分子特征上,我国菌株AS3.16006与模式菌株的BenA和ITS序列完全相同, 因此可以确定菌株AS3.16006鉴定为T.cecidicola(图3-5)。
Talaromycespseudostromaticus是一个特征比较明显的种,比如其在培养时间较长时会产生向光性的菌丝束,产生双轮生和三轮生及不规则帚状枝和壁光滑的分生孢子。我国菌株AS3.16005均具有上述特征,而且其BenA和ITS序列与模式菌株CBS 470.70完全相同. 虽然T.pseudostromaticus和T.pittii的ITS序列完全一样,但他们在形态上比较容易区分,例如T.pittii产生浸润状菌落且产生稀疏的分生孢子或几乎不产生分生孢子,而T.pseudostromaticus则产生绒状菌落和大量分生孢子。虽然T.pittii也产生菌丝束,但其长度要比T.pseudostromaticus的小得多(≤1 mm vs. 5-8 mm)。还有,T.pittii产生比较简单的双轮生和单轮生帚状枝,而T.pseudostromaticus则产生比较复杂的帚状枝,如双轮生、三轮生和不规则生[12, 26]。根据以上这些形态区别,菌株AS3.16005不会被错误鉴定为T.pittii,而且依据BenA序列则可以可靠地区分它们(图3)。

