甜叶菊苷M 的毒理学安全性评价
武新月,赵悦,施伟庆,陆罗定,陈耿,吴俊,俞萍
(江苏省疾病预防控制中心,江苏南京 210009)
甜叶菊(Stevia rebaudianaBertoni)俗称甜菊、甜草[1],原产于巴西南部和巴拉圭北部之间的阿曼拜山脉,是一种多年生的菊科草本植物[2]。已有的研究表明,甜叶菊具有显著的抗炎、抗氧化、抗菌、抗糖尿病以及抗肿瘤等作用[3-7]。目前从甜叶菊中分离得到的成分主要有甜菊糖苷、三萜类、黄酮类、植物甾醇、挥发油和香豆素类等[8],甜菊糖苷作为低热量、无毒的天然甜味剂,甜度高出蔗糖300 倍,因此成为非热糖替代品应用于食品、饮料、酿酒等生产工艺中[1,9]。甜菊糖苷是一类由多种甜味成分组成的四环二萜类化合物,包括甜菊苷、莱鲍迪苷A(rebaudioside A,reb A)、莱鲍迪苷B(rebaudioside B,reb B)、莱鲍迪苷C(rebaudioside C,reb C)、莱鲍迪苷E(rebaudioside E,reb E)、莱鲍迪苷F(rebaudioside F,reb F)、莱鲍迪苷M(rebaudioside M,reb M)、甜茶苷、杜克苷和甜菊双糖苷等[10]。其中甜菊苷和reb A 作为甜菊糖苷的主要甜味成分,含量最高(约占85%),但其味道带有强烈的苦涩,一定程度上限制了甜菊糖苷的应用[11]。相比之下,reb M 则甜度高,口感干净,苦味大大降低,风味更加令人愉悦,但在甜菊糖苷中的含量极低(约占0.06%),因此作为甜味剂的开发和利用受到很大挑战[12-14]。为了解决这一难题,研究者通过发酵和生物转化的方法,使用基因工程改造的酵母菌将甜菊糖苷转化成reb M,从而有效地提高reb M 的产量[15,16]。以甜菊糖苷为原料,在麦芽糖淀粉酶和葡萄糖淀粉酶以及毕赤酵母提取液的作用下充分反应,分离反应混合物,去除蛋白残渣得到上层清液。然后将上层清液加入大孔树脂进行吸附,接着用水冲洗树脂柱,再用乙醇洗提数次,经浓缩、结晶、干燥后可得到reb M 及其同分异构体的混合物,称为甜叶菊苷M(stevioside M)。目前对甜叶菊苷M 有限的研究中,主要是从化学结构、甜度和理化性质等方面进行的[17,18],而对甜叶菊苷M 的毒理学安全性评价则尚未有报道。本研究按照国家卫生和计划生育委员会发布的《食品安全性毒理学评价程序与方法》[19],采用小鼠急性经口毒性试验、Ames 试验、小鼠骨髓红细胞微核试验、小鼠精母细胞染色体畸变试验和28 d 经口毒性试验对甜叶菊苷M 的毒理学安全性进行评价,为甜叶菊苷M 的进一步开发应用提供科学依据。
1 材料和方法
1.1 材料
1.1.1 样品
甜叶菊苷M:由无锡新和源生物制造有限公司提供。
1.1.2 主要试剂
鼠伤寒沙门氏菌突变型菌株TA97a、TA98、TA100、TA102 和TA1535,美国Moltox 公司;S9,齐氏生物科技有限公司;敌克松,AccuStandard 公司;叠氮钠,浙江东阳市天宇化工有限公司;2-氨基芴,Fluka AG 公司;1,8-二羟基蒽醌,SIGMA-ALDRICH 公司;环磷酰胺,Sigma 公司;丝裂霉素,浙江海正药业股份有限公司;秋水仙素,国药集团化学试剂有限公司。
1.1.3 试验动物
SPF 级健康ICR 雌、雄小鼠,由北京维通利华实验动物技术有限公司南京分公司提供,生产许可证号:SCXK(苏)2016-0003 号;SPF 级健康SD 雌、雄大鼠,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0006 号。
1.1.4 仪器与设备
电子天平:PL203 型,梅特勒托利多仪器(上海)有限公司;生化培养箱:LRH-400 型,韶关市泰宏医疗器械有限公司;生物显微镜:OLYMPUS CX41RF型,日本日立公司;生化分析仪:OLYMPUS AU640型,日本日立公司;电解质分析仪:PSD-15b 型,南京攀事达电子仪器有限公司;血细胞分析仪:ADVIA 2120 型,德国西门子公司;全自动血凝仪:Coatron 1800 型,德国TECO 公司;尿分析仪:Scan 500 型,德国科宝公司;半自动石蜡切片机:RM 2245 型,德国莱卡公司。
1.2 方法
1.2.1 小鼠急性经口毒性试验(限量法)
选取SPF 级健康ICR 小鼠20 只,雌雄各半,体重为18.5~21.3 g。给样前禁食6 h。准确称取样品10000 mg 加纯净水至30 mL 搅拌成均匀的糊状物,采取一次灌胃给予,灌胃容量为30 mL/kg·bw,剂量为10000 mg/ kg·bw。灌胃后连续观察14 d,记录中毒表现及死亡情况。
1.2.2 Ames 试验
平板掺入法。使用菌株鉴定符合要求的鼠伤寒沙门氏菌突变型菌株TA97a、TA98、TA100、TA102 和TA1535。采用β-萘黄酮和苯巴比妥联合诱导的大鼠肝S9作为体外代谢活化系统。准确称取样品1000 mg,加入DMSO 溶解定容至20 mL,经121 ℃,20 min 高压灭菌。试验设5 个剂量组,分别为5000、1000、200、40 和8 μg/皿,同时设自发回变组,溶剂对照组和阳性对照组。每个测试点做3 个平行皿,同样实验条件下测试两次。
1.2.3 小鼠骨髓红细胞微核试验
SPF 级健康ICR 小鼠50 只,雌雄各半,随机分为5 组,分别为6670、3330、1670 mg/kg·bw 三个剂量组,溶剂对照组(纯净水)和阳性对照组(环磷酰胺40 mg/kg·bw)。采用30 h 两次灌胃法,每次灌胃容量为20 mL/kg·bw。于末次给药后6 h 颈椎脱臼处死动物,取股骨骨髓于小牛血清中涂片、固定、染色。显微镜下,每只动物计数1000 个嗜多染红细胞(PCE),记录含微核的细胞数,并计算含微核细胞率;每只动物计数200 个嗜多染红细胞,同时计数正染红细胞(NCE),计算PCE 在总红细胞中的比例。
1.2.4 小鼠精母细胞染色体畸变试验
SPF 级健康雄性ICR 小鼠25 只,随机分为5 组,分别为6670、3330、1670 mg/kg·bw 三个剂量组,溶剂对照组和阳性对照组。样品各剂量组和溶剂对照组的灌胃容量为20 mL/kg·bw,每日灌胃1 次,连续5 d;阳性对照组仅于实验第1 d 腹腔注射一次,注射量为10 mL/kg·bw。试验第14 d 处死动物,取双侧附睾精子滤液制片镜检。显微镜下,每只动物计数500 个精母细胞,记录染色体畸变细胞数,并计算畸变细胞率。
1.2.5 28 d 经口毒性试验
SPF 级健康SD 大鼠,雌雄各40 只,随机分为4组,分别为2000、1000、500 mg/kg·bw 三个样品剂量组和基础饲料对照组。采用逐步稀释的方法将样品掺入基础饲料中,以每日约100 g/kg·bw 的摄食量给予大鼠自由食用,连续喂养28 d。每日观察动物的一般表现,记录中毒体征和死亡情况。每周称量体重和进食量,计算食物利用率。试验结束时采血进行血液学检查、血清生化和电解质检查。血液学检查指标包括白细胞(WBC)、红细胞(RBC)、血小板(PLT)计数、血红蛋白(HGB)浓度、红细胞压积(HCT),中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)、嗜酸性粒细胞(EO)、嗜碱性粒细胞(BA)分类,凝血酶原时间(PT)、活化部分凝血活酶时间(APTT);血清生化检查指标包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、尿素氮(BUN)、肌酐(CRE)、总胆固醇(CHO)、甘油三酯(TG);尿液检测指标包括相对密度(SG)、pH 值、尿蛋白(PRO)、尿糖(GLU)和潜血(ERY)。采血后进行大体解剖检查,并称量心脏、胸腺、肾上腺、肝、肾、脾、睾丸、脑的绝对重量,计算脏/体比值;固定保存各组动物的脏器,先对高剂量组和对照组动物的脑、甲状腺、胸腺、心脏、肝、肾、脾、肾上腺、胃、十二指肠、结肠、胰、肠系膜淋巴结、睾丸、卵巢、膀胱进行组织病理学检查,若发现病变再对较低剂量组相应脏器及组织进行检查。
1.3 数据分析
试验所得数据以平均值±标准差表示,采用SPSS 18.0 统计软件对数据进行统计分析。用泊松分布U 检验法对骨髓红细胞微核试验结果进行分析;用卡方检验对小鼠精母细胞染色体畸变试验结果进行分析。
表1 甜叶菊苷M 对小鼠体重的影响Table 1 Effects of stevioside M on body weight in mice (±s)

表1 甜叶菊苷M 对小鼠体重的影响Table 1 Effects of stevioside M on body weight in mice (±s)
性别 动物数/只 剂量/(mg/kg·bw) 初始体重/g 第1 周体重/g 第2 周体重/g 死亡数/只 MTD/(mg/kg)雌 10 10000 19.91±0.77 23.38±1.21 27.00±1.64 0 >10000雄 10 10000 20.03±0.91 26.87±1.10 30.55±1.84 0 >10000
表2 Ames 试验结果Table 2 Results of Ames test (n=3,±s)

表2 Ames 试验结果Table 2 Results of Ames test (n=3,±s)
注:**表示超过溶剂对照2 倍以上。
测试次数 组别 TA97a TA98 TA100 TA102 TA1535+S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9自发回变 122±9 115±8 33±4 32±3 120±6 144±7 295±7 287±24 14±4 13±5第1 次测试8 μg/皿 107±4 113±3 30±1 31±3 119±4 120±6 315±15 289±7 16±6 17±4 40 μg/皿 105±7 109±4 30±2 30±2 108±6 130±5 307±17 284±8 15±1 17±2 200 μg/皿 109±5 104±8 33±3 32±3 113±4 139±3 300±14 280±16 19±4 18±3 1000 μg/皿 106±11 106±3 33±3 32±3 110±4 139±4 314±9 286±8 16±4 15±4 5000 μg/皿 107±8 105±7 30±2 31±2 115±3 141±5 315±7 284±7 15±5 21±2溶剂对照 114±10 112±7 41±2 34±3 127±5 134±6 310±22 297±8 11±4 15±2阳性对照 1052±69** 1142±96** 896±35**769±99** 905±8** 922±107** 830±82** 888±40** 200±11** 418±32**第2 次测试自发回变 115±10 120±8 34±2 32±3 116±13 135±7 289±5 283±16 17±3 12±3 8 μg/皿 108±6 109±10 34±2 34±2 116±13 135±9 307±12 279±12 19±3 11±3 40 μg/皿 119±10 110±7 35±5 34±3 112±7 139±6 324±9 295±8 20±1 13±6 200 μg/皿 108±17 111±3 36±3 34±2 116±6 142±8 31320± 286±12 19±2 12±2 1000 μg/皿 117±3 110±8 38±2 35±3 117±3 146±6 314±11 283±16 17±1 13±4 5000 μg/皿 118±4 104±8 36±4 34±4 119±16 157±9 308±3 289±5 18±5 13±3溶剂对照 124±8 113±11 34±2 28±3 114±10 141±5 300±2 276±10 17±3 10±1阳性对照 940±65** 1143±110** 921±65**761±73** 910±24** 911±69** 892±92** 818±76** 250±76**533±62**
2 结果与分析
2.1 小鼠急性经口毒性试验
小鼠灌胃后未见明显中毒表现,观察期内无动物死亡。观察期结束后,大体解剖未见明显异常。由表1 可见,甜叶菊苷M 对动物体重无明显影响;本次试验中样品对雌雄小鼠急性经口MTD 值均大于10000 mg/kg b·wt(相当于估计最大摄入量的1312 倍),根据小鼠急性经口毒性分级标准,该样品属于实际无毒级。
2.2 Ames 试验
剂量达5000 μg/皿各平板背景菌苔均生长良好。由表2 可见,在加与不加S9的情况下,两次测试,样品各剂量组五种菌株的回变菌落数均未达到空白对照组的2 倍,且无剂量-反应关系,而阳性对照组均表现出强烈的诱变作用。在本试验条件下,甜叶菊苷M 对标准测试菌株TA97a、TA98、TA100、TA102 和TA1535不具有致突变作用,Ames 试验结果为阴性。这一结果与文献报道的rebA 的Ames 阴性[20]结果一致。
2.3 小鼠骨髓红细胞微核试验
由表3 可见,与溶剂对照组相比,样品各剂量组含微核细胞率差异均无统计学意义(p>0.05),也无剂量-反应关系;阳性对照组含微核细胞率与溶剂对照组相比差异具有统计学意义(p<0.01);样品各剂量组动物PCE 占红细胞总数的比例均高于对照组的20%。表明甜叶菊苷M 小鼠骨髓红细胞微核试验结果为阴性。
2.4 小鼠精母细胞染色体畸变试验
由表4 可见,样品各剂量组小鼠初级精母细胞染色体畸变细胞率与溶剂对照组相比,差异均无统计学意义(p>0.05),也无剂量-反应关系;阳性对照组与溶剂对照组的染色体畸变细胞率、性染色体和常染色体单价体、断裂和裂隙差异均具有统计学意义(p<0.01,p<0.05)。提示甜叶菊苷M 对小鼠初级精母细胞染色体无致畸变作用,试验结果为阴性。
表3 小鼠骨髓红细胞微核试验结果Table 3 Results of micronucleus test in mice bone marrow (±s)

表3 小鼠骨髓红细胞微核试验结果Table 3 Results of micronucleus test in mice bone marrow (±s)
性别 组别 动物数/只 观察细胞数/个 含微核细胞数/个 含微核细胞率 PCE 比例/%‰ p 值溶剂对照 5 10000 20 2.00±0.79 50.72 ±2.18雌性雄性1670 mg/kg 5 10000 18 1.80±0.76 >0.05 51.10±0.79 3330 mg/kg 5 10000 20 2.00±0.61 >0.05 51.24±1.35 6670 mg/kg 5 10000 21 2.10±1.24 >0.05 50.88±1.59阳性对照 5 10000 254 25.40±7.76 <0.01 49.36±2.35溶剂对照 5 10000 22 2.20±0.76 51.10±1.93 1670 mg/kg 5 10000 23 2.30±0.97 >0.05 50.82±2.15 3330 mg/kg 5 10000 20 2.00±0.79 >0.05 50.78±0.53 6670 mg/kg 5 10000 26 2.60±0.89 >0.05 50.45±1.80阳性对照 5 10000 274 27.40±5.52 <0.01 49.03±1.68
表4 小鼠精母细胞染色体畸变试验结果Table 4 Results of chromosome aberration test in mice spermatocyte (±s)

表4 小鼠精母细胞染色体畸变试验结果Table 4 Results of chromosome aberration test in mice spermatocyte (±s)
注:与阴性对照组相比,* p<0.05;** p<0.01。
组别 动物数/只观察细胞数/个裂隙/个性染色体单价体/%常染色体单价体/%染色体畸变类型 畸变细胞数/个 畸变细胞率断片/个 异位/个 微小体/个阴性对照 5 500 0 3.40±1.06 2.0±1.61 3 0 0 3 0.60±0.89 1670 mg/kg 5 500 0 3.20±1.26 1.80±1.26 4 0 0 4 0.80±0.84 3330 mg/kg 5 500 0 3.00±1.55 2.20±0.75 2 0 0 2 0.40±0.55 6670 mg/kg 5 500 0 3.20±1.09 2.00±1.15 4 0 0 4 0.80±0.84阳性对照 5 500 6* 8.20±1.26** 6.60±1.48** 42 4 0 46** 9.20±1.92**
表5 甜叶菊苷M 对大鼠体重的影响Table 5 Effects of stevioside M on body weight in rats (±s)

表5 甜叶菊苷M 对大鼠体重的影响Table 5 Effects of stevioside M on body weight in rats (±s)
性别 组别 动物数/只 初始体重/g 第1 周体重/g 第2 周体重/g 第3 周体重/g 第4 周体重/g 增重/g对照 10 76.20±4.34 125.60±4.17 167.40±13.23 195.40±15.86 220.30±18.53 144.10±16.29雌雄低剂量 10 76.10±3.60 123.90±6.85 162.10±7.39 189.00±12.26 213.60±17.40 138.00±15.84中剂量 10 75.70±2.83 126.80±3.91 170.30±11.91 198.30±15.28 224.60±16.30 149.08±15.41高剂量 10 76.10±3.25 125.50±4.93 168.60±8.04 194.40±8.57 221.70±11.24 146.36±11.01对照 10 86.30±4.69 150.00±8.57 212.20±14.23 271.00±19.44 325.10±28.23 238.80±28.83低剂量 10 86.30±6.67 149.00±7.56 216.60±15.82 277.50±19.82 339.40±24.64 253.10±19.40中剂量 10 86.70±5.72 149.30±6.06 213.80±13.87 272.30±18.07 328.70±21.43 242.00±18.41高剂量 10 87.10±5.28 150.60±9.85 215.00±11.16 274.80±13.54 333.90±17.10 246.80±15.35
表6 甜叶菊苷M 对大鼠每周摄食量及总摄食量的影响Table 6 Effects of stevioside M on weekly and total food intake in rats (±s)

表6 甜叶菊苷M 对大鼠每周摄食量及总摄食量的影响Table 6 Effects of stevioside M on weekly and total food intake in rats (±s)
性别 组别 动物数/只 第1 周摄食量/g 第2 周摄食量/g 第3 周摄食量/g 第4 周摄食量/g 总摄食量/g对照 10 113.50±7.44 146.00±9.96 149.20±8.40 171.20±16.09 579.90±33.73雌雄低剂量 10 114.60±6.19 137.40±7.29 144.40±10.37 163.10±17.82 559.60.±33.66中剂量 10 111.40±6.57 144.30±12.47 154.00±13.74 172.20±17.32 581.90±40.80高剂量 10 112.40±4.86 145.00±10.09 151.30±8.92 175.7±10.67 584.40±20.62对照 10 131.20±6.55 175.10±13.74 192.00±13.58 193.20±18.20 691.50±45.77低剂量 10 129.00±7.16 174.50±13.09 191.6±15.09 204.60±12.98 699.70±41.27中剂量 10 132.50±6.77 179.60±14.43 198.30±14.27 201.70±19.13 712.10±46.80高剂量 10 136.00±4.78 181.70±11.18 198.40±11.66 204.00±12.52 720.10±31.44
表7 甜叶菊苷M 对大鼠食物利用率的影响Table 7 Effects of stevioside M on food utilization rate in rats (±s)

表7 甜叶菊苷M 对大鼠食物利用率的影响Table 7 Effects of stevioside M on food utilization rate in rats (±s)
性别 组别 动物数/只 第1 周食物利用率/%第2 周食物利用率/%第3 周食物利用率/%第4 周食物利用率/%总食物利用率/%对照 10 43.72±3.76 28.42±5.54 18.81±2.95 14.47±2.78 24.83±2.06雌低剂量 10 41.75±3.88 27.89±3.50 18.60±4.39 14.87±2.75 24.55±2.26中剂量 10 45.88±2.27 29.84±5.44 18.10±3.04 15.27±2.10 25.55±1.35高剂量 10 43.91±2.67 29.72±2.50 17.16±2.45 15.44±3.62 24.91±1.64雄对照 10 48.96±4.84 35.30±4.33 30.59±3.00 27.86±2.97 34.48±2.98低剂量 10 48.67±1.97 38.63±3.05 31.81±2.48 30.29±2.71 36.16±1.53中剂量 10 47.34±2.90 35.93±4.58 29.50±1.63 28.08±3.01 34.02±2.04高剂量 10 46.70±4.70 35.41±2.79 30.17±2.82 29.01±3.46 34.29±1.88
2.5 28 d 经口毒性试验
2.5.1 一般临床观察
试验期间,各组动物的外观、排便、进食及活动等均未见明显异常,未见明显中毒体征和死亡。这一研究与Nikiforov 等人进行的reb D 的28 d 喂养试验结果一致[21]。
2.5.2 动物的体重及摄食情况
由表5~7 可见,与对照组相比,样品各剂量组动物多个观察点的体重、摄食量、食物利用率以及总的摄食量和食物利用率均无显著性差异(p>0.05)。
2.5.3 甜叶菊苷M 对大鼠血液学指标的影响
由表8 可见,与对照组相比,雌性大鼠低剂量组WBC 计数值偏高,NE 值偏低,差异有统计学意义(p<0.05),但两项指标值均在本实验室历史正常值范围内,且无剂量-效应关系;雌性低、中剂量组和雄性低、中、高剂量组大鼠PT 值以及雄性低剂量组APTT值差异有统计学意义(p<0.01,p<0.05),但两项指标变化均无剂量-效应关系,且雌雄动物变化趋势不同,结合其他指标综合分析认为,上述变化不具有生物学意义和毒理学意义;其余各剂量组的多项血常规指标与对照组相比无显著性差异(p>0.05)。
表8 甜叶菊苷M 对大鼠血液学指标的影响Table 8 Effects of stevioside M on hematological indexes in rats (±s)

表8 甜叶菊苷M 对大鼠血液学指标的影响Table 8 Effects of stevioside M on hematological indexes in rats (±s)
注:与对照组相比,* p<0.05;** p<0.01。
性别 组别 动物数/只 WBC/(109/L) RBC/(1012/L) HGB/(g/L) HCT/% PLT/(109/L) NE/%雌对照 10 6.37±1.08 6.66±0.31 120.30±5.27 37.15±1.49 1076.00±115.77 11.30±2.75低剂量 10 7.90±1.62* 6.65±0.36 121.30±6.53 36.94±2.22 1086.20±132.86 7.22±1.94*中剂量 10 7.51±1.65 6.76±0.30 122.10±7.25 37.19±2.14 1006.40±103.04 8.67±3.50高剂量 10 6.29±1.06 6.63±0.33 119.00±6.85 36.54±2.44 1164.20±119.77 9.15±3.52对照 10 7.12±1.26 6.73±0.35 127±8.51 38.99±3.02 1013.90± 99.16 10.25±1.84低剂量 10 8.55±1.57 7.00±0.27 124.60±5.60 40.05±1.54 1156.60±147.40 8.88±2.08中剂量 10 7.58±0.93 6.66±0.30 123.00±5.58 38.07±1.90 1094.40± 86.93 9.31±3.23高剂量 10 6.55±1.41 6.86±0.42 123.40±7.85 38.25±2.27 995.00±202.00 13.21±5.89性别 组别 动物数/只 LY/% MO/% EO/% BA/% PT/s APTT/s雄对照 10 84.19±3.55 2.77±1.13 1.15±0.49 0.13±0.07 21.90±1.62 11.67±1.49雌低剂量 10 88.89±2.69 2.17±0.67 0.96±0.43 0.18±0.08 17.90±0.73** 11.25±1.21中剂量 10 86.75±4.26 2.57±1.02 1.13±0.50 0.15±0.05 18.35±0.55** 11.93±1.63高剂量 10 86.85±4.03 2.29±0.63 0.91±0.30 0.15±0.10 23.15±1.65 11.82±1.30雄对照 10 85.42±2.33 2.75±0.76 1.20±0.72 0.16±0.05 22.08±1.42 10.63±2.21低剂量 10 88.23±2.64 1.97±0.68 0.59±0.20 0.16±0.05 25.85±3.04** 12.39±1.15*中剂量 10 87.30±4.09 2.14±0.98 0.84±0.66 0.15±0.07 24.40±1.31** 10.68±0.94高剂量 10 82.92±6.39 2.39±0.91 1.00±0.65 0.14±0.07 24.02±1.03** 10.74±0.82
表9 甜叶菊苷M 对大鼠血清生化指标的影响Table 9 Effects of stevioside M on serum biochemical indexs in rats (±s)

表9 甜叶菊苷M 对大鼠血清生化指标的影响Table 9 Effects of stevioside M on serum biochemical indexs in rats (±s)
注:与对照组相比,** p<0.01。
性别 组别 动物数/只 ALT/(U/L) AST/(U/L) ALP/(U/L) GGT/(U/L) TP/(g/L) ALB/(g/L)对照 10 39.34±4.13 175.26±14.97 124.39±24.72 0.69±0.46 69.27±3.62 37.10±1.94雌低剂量 10 34.65±6.14 161.68±22.57 111.62±35.17 0.65±0.26 69.04±6.56 37.59±3.75中剂量 10 36.98±5.52 169.86±21.86 107.72±38.52 0.55±0.10 68.37±5.20 37.15±2.69高剂量 10 38.87±5.27 171.86±16.15 131.51±38.93 0.52±0.22 68.28±3.42 36.31±1.93对照 10 47.30±6.37 181.18±17.73 239.87±58.95 0.47±0.16 61.85±2.87 31.77±1.12低剂量 10 44.55±6.63 162.37±23.66 253.03±50.81 0.47±0.17 59.74±2.94 30.83±1.21中剂量 10 46.23±5.60 171.30±25.04 226.86±25.70 0.38±0.08 59.10±3.03 30.67±1.53高剂量 10 45.37±7.09 172.49±25.16 248.45±49.29 0.39±0.18 60.90±1.36 31.29±1.38性别 组别 动物数/只 GLU/(mmol/L) TG/(mmol/L) CHO/(mmol/L) BUN/(mmol/L) CRE/(mmol/L)雄对照 10 5.01±0.36 0.82±0.37 1.94±0.26 5.44±0.60 39.12±7.71雌雄低剂量 10 4.93±0.39 0.68±0.18 1.86±0.24 5.00±0.81 31.26±2.32**中剂量 10 5.18±0.35 0.64±0.14 1.87±0.51 5.41±0.65 35.73±4.07高剂量 10 4.90±0.53 0.77±0.30 1.93±0.44 5.12±0.40 38.52±4.30对照 10 5.03±0.82 1.09±0.43 1.87±0.20 5.19±0.52 29.71±3.20低剂量 10 5.47±0.45 0.83±0.26 1.63±0.32 4.52±0.89 27.08±2.90中剂量 10 4.96±0.53 0.76±0.19 1.59±0.19 4.59±0.73 28.56±3.15高剂量 10 5.01±0.44 0.82±0.21 1.70±0.30 4.20±0.49** 28.59±2.07
2.5.4 甜叶菊苷M 对大鼠血清生化指标和电解质浓度的影响
由表9~10 可见,与对照组相比,雌性大鼠低剂量组CRE 值偏低,雄性高剂组BUN 值偏低,差异均有统计学意义(p<0.01),但这些指标值均在本实验室历史正常值范围内,也无剂量-效应关系,其降低没有毒理学意义;其余各项生化指标和电解质浓度值组间 差异均无统计学意义(p>0.05)。
表10 甜叶菊苷M 对大鼠血清电解质浓度的影响Table 10 Effects of stevioside M on serum electrolyte concentration in rats (±s)

表10 甜叶菊苷M 对大鼠血清电解质浓度的影响Table 10 Effects of stevioside M on serum electrolyte concentration in rats (±s)
性别 组别 动物数/只 Na+/(mmol/L) K+/(mmol/L) Cl-/(mmol/L)对照 10 137.00±2.71 6.67±0.64 103.30±1.57雌雄低剂量 10 134.50±3.31 6.59±0.60 102.80±0.92中剂量 10 134.50±2.72 6.44±0.51 102.10±1.60高剂量 10 137.70±3.68 6.74±1.04 103.20±2.44对照 10 137.90±3.03 6.85±0.59 102.20±1.14低剂量 10 135.00±5.29 6.64±0.55 101.50±2.42中剂量 10 135.30±3.95 6.51±0.39 100.40±2.22高剂量 10 135.50±3.69 6.64±0.46 101.40±2.84
表11 甜叶菊苷M 对大鼠尿液指标的影响Table 11 Effects of stevioside M on urine indexs in rats (±s)

表11 甜叶菊苷M 对大鼠尿液指标的影响Table 11 Effects of stevioside M on urine indexs in rats (±s)
性别 组别 动物数/只 SG pH ERY/(P/N) PRO/(g/L) GLU/(P/N)对照 10 1.02±0.01 6.20±0.42 0/10 0.14±0.15 0/10雌低剂量 10 1.02±0.01 5.90±0.74 0/10 0.22±0.30 0/10中剂量 10 1.02±0.01 5.90±0.99 0/10 0.17±0.13 0/10高剂量 10 1.02±0.01 5.90±0.32 0/10 0.08±0.13 0/10雄对照 10 1.02±0.01 6.40±0.84 0/10 0.38±0.35 0/10低剂量 10 1.02±0.01 6.30±0.67 0/10 0.26±0.40 0/10中剂量 10 1.02±0.01 6.40±0.52 0/10 0.17±0.13 0/10高剂量 10 1.02±0.01 6.20±0.42 0/10 0.18±0.12 0/10
表12 甜叶菊苷M 对大鼠脏体比的影响Table 12 Effects of stevioside M on the organ-to body weight of rats (±s)
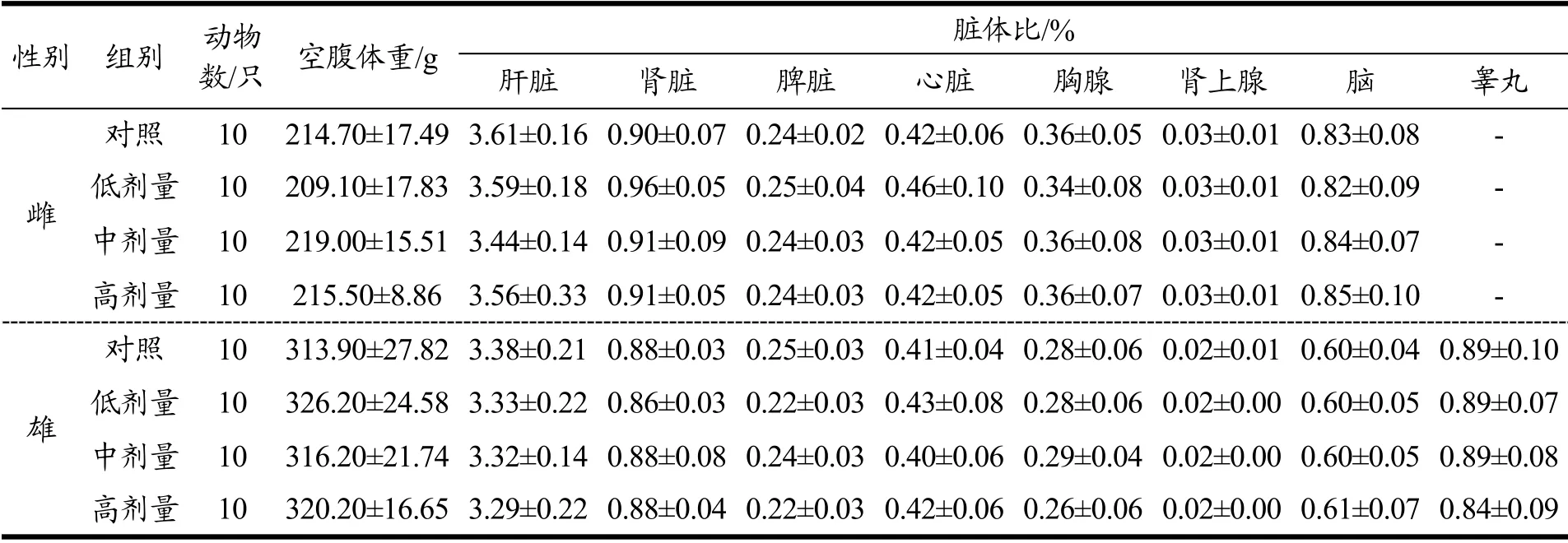
表12 甜叶菊苷M 对大鼠脏体比的影响Table 12 Effects of stevioside M on the organ-to body weight of rats (±s)
性别 组别 动物数/只 空腹体重/g 脏体比/%肝脏 肾脏 脾脏 心脏 胸腺 肾上腺 脑 睾丸对照 10 214.70±17.49 3.61±0.16 0.90±0.07 0.24±0.02 0.42±0.06 0.36±0.05 0.03±0.01 0.83±0.08 -雌雄低剂量 10 209.10±17.83 3.59±0.18 0.96±0.05 0.25±0.04 0.46±0.10 0.34±0.08 0.03±0.01 0.82±0.09 -中剂量 10 219.00±15.51 3.44±0.14 0.91±0.09 0.24±0.03 0.42±0.05 0.36±0.08 0.03±0.01 0.84±0.07 -高剂量 10 215.50±8.86 3.56±0.33 0.91±0.05 0.24±0.03 0.42±0.05 0.36±0.07 0.03±0.01 0.85±0.10 -对照 10 313.90±27.82 3.38±0.21 0.88±0.03 0.25±0.03 0.41±0.04 0.28±0.06 0.02±0.01 0.60±0.04 0.89±0.10低剂量 10 326.20±24.58 3.33±0.22 0.86±0.03 0.22±0.03 0.43±0.08 0.28±0.06 0.02±0.00 0.60±0.05 0.89±0.07中剂量 10 316.20±21.74 3.32±0.14 0.88±0.08 0.24±0.03 0.40±0.06 0.29±0.04 0.02±0.00 0.60±0.05 0.89±0.08高剂量 10 320.20±16.65 3.29±0.22 0.88±0.04 0.22±0.03 0.42±0.06 0.26±0.06 0.02±0.00 0.61±0.07 0.84±0.09
2.5.5 甜叶菊苷M 对大鼠尿液分析指标的影响
各剂量组大鼠尿液外观无明显异常。由表11 可见,各组雌雄大鼠尿液检测指标与对照组相比,无统计学差异(p>0.05)。
2.5.6 甜叶菊苷M 对大鼠脏体比的影响
与对照组相比,各剂量组大鼠肝、肾、脾、心脏、胸腺等脏器的脏体比均无统计学差异(p>0.05),数据见表12。Nikiforov 等人的reb D 喂养大鼠的实验中,测定器官重量与对照组无显著差异[21],与本试验结果一致。由此说明甜叶菊苷M 对大鼠脏体比没有明显影响。
2.5.7 组织病理学检查
对所有动物进行大体解剖检查,均未发现明显异常。因此,先选择高剂量组和对照组动物的脑、甲状腺、胸腺、心脏、肝、肾、脾、肾上腺、胃、十二指肠、结肠、胰、肠系膜淋巴结、睾丸、卵巢、膀胱进行组织病理学检查。与对照组相比,高剂量组大鼠各受检脏器均未出现与甜叶菊苷M 明显有关的特异性组织病理学改变,故未进行其他剂量组动物脏器的组织病理学检查。
3 结论
基于甜菊糖苷现有的研究结果,欧洲食品安全局(European Food Safety Authority,EFSA)和粮农组织/世卫组织食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)建立了甜菊糖苷的每日允许摄入量(acceptable daily intake,ADI),即4 mg/kg·bw 甜菊醇当量[22,23]。由于各种甜菊糖苷具有相同的代谢产物甜菊醇,因此ADI 值适用于所有的甜菊糖苷[24]。按照文献报道的方法,假设由reb M 构成整个甜味剂市场(这一估计非常保守),那么对于一般健康成人人群,reb M 估计最大摄入量为5.19 mg/kg·bw,相当于1.28mg/kg·bw 甜菊醇当量;健康儿童的估计最大摄入量为7.62 mg/ kg·bw,相当于1.88 mg/kg·bw 甜菊醇当量[25]。若以甜菊醇当量表示,则reb M 的估计最大摄入量远低于EFSA 和JECFA 建立的ADI 值。在本次试验中,甜叶菊苷M 对雌雄小鼠急性经口MTD 值均大于10000 mg/kg·bw,相当于估计最大摄入量的1312倍,因此属于实际无毒级。Ames 试验、小鼠骨髓红细胞微核试验和小鼠精母细胞染色体畸变试验均为阴性,表明样品无遗传毒性。28 d 经口毒性试验发现,剂量达到2000 mg/kg·bw 时,样品对大鼠的体重、摄食量、食物利用率、血液学、血生化和组织病理学等均未产生明显影响,提示样品不具有短期毒性。在本试验设定的条件下,根据高剂量组动物实际摄入样品的剂量计算,该样品对雌、雄大鼠28 d 经口毒性NOAEL 值分别为2650 和2421 mg/kg·bw。本次试验初步评价了甜叶菊苷M 的安全性,并为下一步较长期毒性和慢性毒性试验剂量、观察指标、毒性终点的选择提供依据。由于动物和人存在物种差异,试验结果外推到人有一定的局限性,但可为初步估计人群允许接触水平提供有价值的信息。

