浅谈离子电迁移速率对溶液导电性的影响
李祥培 杜钦芝
([1]西南大学附属中学校 重庆 400700;[2]重庆市第八中学校 重庆 400030)
在讲解高中化学的电解质知识时,要求学生掌握对溶液导电性强弱进行比较的基本规律,从而加深对强、弱电解质概念的理解,为后续的“离子反应”和“电解质溶液”的教学奠定基础。判断溶液导电性强弱一般规律为:离子浓度越高,离子所带电荷数越多,溶液导电性就越强。该规律适合于中学阶段大部分电解质溶液导电性强弱的判断,但也有部分判断结论与实验结果不相符合,本论文针对此进行探讨。
1 不同电解质溶液电导率的测试及分析
1.1 实验仪器与测试方法
电导率传感器(朗威@DISLab LW-C802)、温度传感器(朗威@DISLab LW-T801)和数据采集器(朗威@DISLab LWD801)均系山东远大朗威教育科技股份有限公司产品。
配制一定物质的量浓度的电解质溶液,盛于烧杯中,将电导率和温度传感器插入待测溶液中,打开磁力搅拌和加热器,采集温度和电导率的实时数据,装置如图1所示。

图1:数字化传感仪的装置示意图
1.2 不同电解质溶液的电导率
运用电导率数字化传感器检测了不同电解质溶液在303K时的电导率,包括 0.10 mol/L 的 NaCl,KCl,RbCl,CsCl,HCl,NaOH和CuSO4,结果示于表1中。
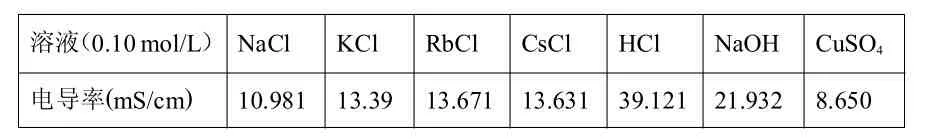
表1:303 K时0.10 mol/L的不同电解质溶液的电导率
表1中,溶液电导率越大,溶液导电性越强。分析表1中的数据,不难发现,浓度相同、离子所带电荷也相同的不同离子,其导电性却不同,有些离子之间导电性相差还比较大。同时,我们还广泛查阅了相关文献,获得了H+、Li+、Na+、K+、NH4+、Ag+、Mg2+、Ca2+、Sr2+、Ba2+、OH-、Cl-、Br-、I-和 SO42-的无限稀释摩尔电导率、晶体离子半径和水合离子半径的数据,结果示于表2中。表2中,离子的无限稀释摩尔电导率越大,离子的导电性越强。表2的数据也同样表明:浓度相同、离子所带电荷也相同的不同离子,其导电性可能存在较大差异。这是因为影响离子导电性的因素除了离子浓度和离子所带电荷,还有离子的电迁移速率。

表2:298K时,不同离子的无限稀释摩尔电导率、晶体离子半径和水合离子半径
2 离子电迁移速率的影响因素
离子电迁移速率是指单位电位梯度(1 V/m)时离子的运动速率,除与离子的本性(包括水合离子半径、所带电荷等)、迁移原理、温度有关外,还受溶剂的性质如粘度等各种复杂因素影响,下面主要讨论水合离子半径、迁移原理及温度对离子电迁移速率的影响。
2.1 水合离子半径的影响
分析表2发现,在Ⅰ A、Ⅱ A的元素里,同族带相同电荷的阳离子,随着核电荷数的增加,其无限稀释摩尔电导率呈增大趋势,导电性也随之增大;而Ⅶ A阴离子的无限稀释摩尔电导率非常接近。结合水合离子半径变化规律,可以得出:等温等浓度时,带相同电荷的离子,其水合离子半径越小,电导率越大。这是因为在水中的离子都以水合离子形式存在,在同主族离子中,随着原子序数增加,离子半径逐渐增大,通常会使其吸附水分子的能力逐渐减弱,导致其水合离子的半径逐渐减小,在外加电场的水溶液中迁移时,受阻碍越小,电导率就会越大。Ⅶ A阴离子的水合离子的半径非常接近,故电导率也很接近。带相同电荷数的阴阳离子之间的导电性强弱,也主要决定于水合离子半径大小,例如:卤素阴离子的水合离子半径与K+和NH4+的水合离子半径非常接近,其无限稀释摩尔电导率也很接近。
分析表1发现,等浓度的KCl溶液导电性强于CuSO4溶液。如果按照高中教学经验的总结,CuSO4的阳阴离子的所带电荷是Cl-和K+的两倍,等浓度的CuSO4溶液的导电性应该强于KCl溶液,但事实恰好相反。有人提出可能是铜离子水解,导致Cu2+浓度降低造成。但根据水解方程式Cu2++2H2O Cu(OH)2+2H+,Cu2+虽然少量转化为Cu(OH)2,但却生成了导电性更强的H+,所以并不是水解的原因导致导电性偏小。结合表2中数据分析,主要是Cu2+的水合离子半径大于K+水合离子半径,导致Cu2+迁移速率小于K+所致。
关于水合离子半径对离子电迁移速率影响的规律可概括为:相同温度和浓度时,带相同电荷的阴阳离子(H+和OH-除外),其水合离子的半径越小,离子电迁移速率越大,溶液导电性越强。
2.2 H+和OH-特殊的迁移原理对其电迁移速率的影响
表1中数据表明:等浓度的HCl溶液导电性远强于KCl和NaCl溶液,等浓度的NaOH溶液导电性也远强于NaCl溶液。表2中显示,H+和OH-的无限稀释摩尔电导率远高于其它离子。关于H+和OH-为何会在水溶液中表现出如此特殊的电迁移速率,而在其它常见有机溶剂中则没有该特殊现象,有人提出假设,除了离子正常移动之外,H3O+和OH-主要是通过一种质子传递机理(Grotthuss机理)传导电流,而不是本身从溶液的一端迁向另一端。H3O+的质子传递机理如图2所示。在外加电场作用下,H3O+的H+可以跳跃到临近的水分子,质子是从一个水分子传递给另一个水分子,电流就很快沿着氢键传导,然后分子的排列形式从图 2(a)变到图 2(b),以(b)排列方式的分子必须翻转,恢复到(a)的排列状态再接受(或释放)质子。

图2:H3O+在电场作用下的迁移原理示意图
OH-的质子传递机理如图3所示,其传导机理与H3O+相似,只是质子从水分子传递给OH-,这个过程相当于OH-在反方向迁移。传递电流时,分子的排列形式从图3(a)到图3(b),以(b)排列方式的分子必须翻转,回复到(a)的排列状态再接受(或释放)质子。

图3:OH-在电场作用下的迁移原理示意图
关于H+和OH-的电迁移速率的影响规律可概括为:H3O+和OH-在水中迁移的本质都是质子在迁移,其特殊的迁移原理使其电迁移速率大,溶液导电性强,其导电性强于等浓度的其它阳离子和阴离子。
2.3 温度的影响
强电解质在水中完全电离,加热时,溶液中离子浓度不变,认为溶液导电性也不变。实验证明,该观点是错误的,强电解质溶液在加热时导电性会显著增强。用电导率传感器检测了蒸馏水和0.10 mol/L KCl及0.10 mol/L CuSO4溶液的电导率随温度的变化情况,结果如图4所示。
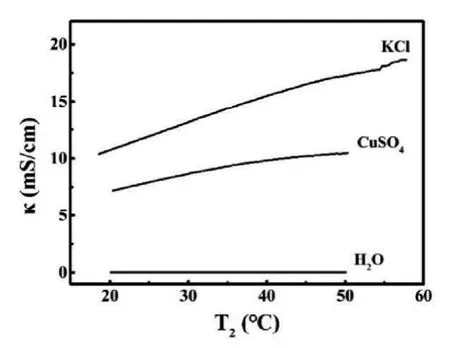
图4:蒸馏水、0.10 mol/L KCl和CuSO4溶液的电导率随温度的变化
可见,加热蒸馏水时,其电导率随温度变化很小。而CuSO4和KCl溶液的电导率随温度升高而显著增大。由此可见升高温度,溶剂水的电离程度增大对电导率的影响可以忽略。CuSO4和KCl溶液的电导率随温度升高而显著增大,其可能的原因为:温度升高,溶液的黏度降低,离子运动速度加快,水溶液中离子作用减弱,水合离子半径减小,导致溶质离子的电迁移速率加快,导电性增强。KCl溶液导电率随温度升高的幅度比CuSO4相对更大,其可能的原因为:K+和Cl-离子所带电荷较小,结合水分子的能力相对弱,升温使其水合离子半径明显减小,电迁移速率更快,导电性增强更明显。
温度对离子电迁移速率的影响规律可概括为:温度越高,离子电迁移速率越大,溶液导电性增强;一般来说,温度每升高10℃,电导率会增大10%~20%。
综上,我们在比较溶液导电性强弱时,除了要考虑离子浓度和离子所带电荷之外,离子的电迁移速率也是一个很重要的影响因素。在高中化学教学中,如果要求学生掌握离子电迁移速率的影响因素及其对溶液导电性的影响规律,这一教学要求的确过高。但作为教师,在化学教学或命制各种题目时,要尽量考虑离子电迁移速率对离子导电性影响的客观事实,避免发生科学性错误。

