儿童颞叶节细胞胶质瘤的临床和MRI表现
马慧静,王永姣,翟爱国,杨豪,朱小虎,邵剑波
节细胞胶质瘤(ganglioglioma,GG)为颅内少见惰性肿瘤,2016年WHO中枢神经系统肿瘤分类中归类于神经元和混合型神经元-胶质肿瘤,由胶质细胞和神经元细胞组成,良性程度高,预后好,WHO分级为Ⅰ级,约占中枢神经系统的0.4%~0.9%,GG可发生于任何年龄,从新生儿至80岁,但多见于儿童和30岁以下成人,GG占儿童颅内肿瘤的1%~4%。GG最常见的发生部位是颞叶,其次是额叶、顶叶和枕叶;松果体区、视神经、三叉神经、脑室、小脑、脑干、丘脑、鞍区或桥小脑角也有报道[1]。
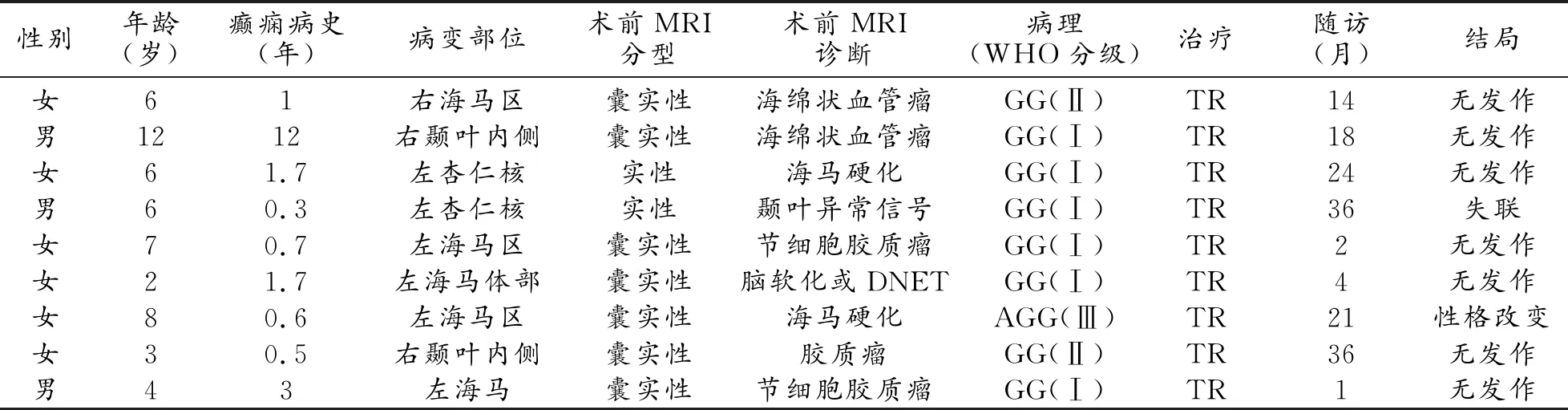
表1 9例GG患儿临床影像资料
儿童颞叶GG临床症状多表现为顽固性癫痫发作(特别是复杂的部分发作),也是儿童颞叶癫痫的常见原因之一,手术是主要的治疗手段,且术后预后良好[2]。但由于颞叶GG影像表现多样化且无明显特异性,常常引起影像科医师的误诊以及漏诊,从而导致患儿得不到正确的治疗。本文回顾性分析在本院经手术切除病理证实的9例儿童颞叶GG多模态影像表现,旨在提高对该病的诊断符合率。
材料与方法
1.一般资料
搜集2017年1月-2020年12月期间9例经病理证实为GG的患儿临床及影像资料,男3例,女6例,年龄2~12岁,中位年龄6岁,8例临床表现为癫痫,1例表现为呕吐合并癫痫,癫痫病史4个月~12年,其中5例病史超过1年者经服用抗癫痫药物治疗,效果欠佳。
2.检查方法
采用GE750超导3.0T MR仪 , 9 例均行常规T1WI、T2WI、FLAIR及增强扫描,T1加扫Bravo薄层序列,9例行DWI检查,6例行磁共振波谱(magnetic resonance spectroscopy,MRS)检查,6例行三维动脉自旋标记(three dimensional arterial spin labeling,3D ASL)检查,3例行CT平扫检查。扫描参数:T1WI(TR 1750 ms,TE 24 ms,层厚6 mm,层间距2 mm,激励次数(NEX) 1,矩阵320×192),T2WI(TR 3500 ms,TE 102 ms,层厚6 mm,层间距2 mm,NEX 2,矩阵256×256),FLAIR序列(TR 8000 ms,TE 120 ms,层厚6 mm,层间距2 mm,NEX 1,矩阵288×224),Bravo序列(TR 8.4 ms,TE 3.3 ms,Prep Time 450 ms,层厚1.2 mm,NEX 1,矩阵256×256,翻转角12°),DWI(EPI序列,TR 3000 ms,TE minimum,b值为1000 s/mm2);增强扫描采用对比剂Gd-DTPA,0.1 mmol/kg,MRS采用多体素PRESS序列(TE 144 ms),3D ASL灌注成像(TR 4613 ms,TE 10.6 ms,标记后延迟时间1525 ms)。
3.图像观察和分析
由两名高年资主治以上MRI诊断医生共同阅片,重点观察病变部位、大小、形态、信号特点(钙化、囊性、实性等)及强化方式、 程度[二个等级:轻中度、重度,评判标准:选取病灶最大强化区域作为兴趣区(region of interest,ROI)进行测量,增强后信号强度减去增强前信号强度,按照计算值≤300为轻中度强化、>300为重度强化],是否有瘤周水肿(三个等级:无、平均直径<10 mm为轻度、10~20 mm为中度)及占位效应[三个等级:无、轻中度、重度,评判标准:轻度 (临近脑沟变浅,不影响形态)、中度(引起正常结构的变形,压迫邻近结构或中线结构偏移不超过1 cm)、重度(明显变形及中线偏移超过1 cm)]。采用Functool软件包对DWI、MRS、ASL等数据进行处理和分析。ADC值测量肿瘤实性部位,避开钙化、囊性区域,测量对侧正常脑实质的ADC值,测量3次取其平均值。MRS的ROI主要包括病灶实性部分及对侧正常实质区。3D ASL的ROI主要测量脑血流量灌注伪彩图上病灶最大脑血流量值(maximum cerebral blood flow,CBFmax)及对侧镜面区正常脑实质血流量(cerebral blood flow,CBF),计算相对血流量(reletive cerebral blood flow,rCBF),rCBF =CBFmax/CBF,测量三次取其平均值。
结 果
1.临床表现
9例GG患儿临床表现见表1。
2.病理

表2 9例GG多模态MRI表现
镜下见肿瘤组织由相对成熟、肿瘤性胶质细胞和神经节细胞组成,CD34、Syn、NeuN、GFAP阳性染色。
3.MRI多模态表现
9例GG多模态MRI表现见表2及图1~4。
9例病变均位于颞叶内侧,皮层均见受累,3例累及深部白质,邻近骨质均未见压迫侵蚀性改变。4例缺乏正常肿瘤形态,无法准确测量大小(图1)。囊实性7例,实性2例,3例肿块行CT检查内见高密度钙化影(图2c),MRI表现为短T1短T2信号,实性部分表现为等T1稍长T2信号,FLAIR信号稍高,囊性表现为长T1长T2信号,增强方式多样(图3c、4b)。
肿块最小ADC值为(0.86~1.2)×10-3mm2/s,平均(0.97±0.11)×10-3mm2/s,对侧正常脑实质最小ADC值为(0.75~1.16)×10-3mm2/s,平均(0.89±0.11)×10-3mm2/s。
6例行3D ASL检查,1例WHO Ⅱ级呈高灌注,5例WHOⅠ级,其中3例呈等或低灌注(图3d),2例呈高灌注(图1f)。肿瘤CBFmax 32~126 mL/(min·100g),平均79±35 mL/(min·100g),对侧正常脑实质区CBF 35~75 mL/(min·100g),平均55±14 mL/(min·100g),rCBF 0.80~2.29,平均1.42±0.58。
MRS:NAA峰降低(图3e),Cho/Cr、Cho/NAA和NAA/Cr比值均值分别为1.45、1.95和0.75,对侧正常区比值均值分别为1.39、0.84、1.16。与对侧正常区相比,GG的NAA/Cr比值降低,Cho/Cr和Cho/NAA比值增加。
讨 论
GG通常在诊断前有一个良性的临床过程,症状持续时间长,本组中患儿癫痫病史从4个月到12年,其中5例患儿癫痫病史超过1年,经服用抗癫痫药物治疗,效果欠佳。早期认识对治疗和患者咨询具有重要意义。本组仅2例患儿术前考虑GG后神经外科立即进行了颅内肿瘤全切术,余7例患儿中,术前均未能准确诊断,可见误诊率较高。
1.GG的常规MRI特征
GG根据囊内成分一般可分为三种:囊性、囊实性和实性,囊性指肿瘤无实性成分,囊实性指肿瘤内囊实性成分;实性指肿瘤中无囊性成分,以囊实性多见。
肿块部位是GG较有特征性征象,多位于颞叶内侧较表浅部位,皮层或皮层下,以海马和杏仁核区多见。灶周水肿以轻度为主;术前多次检查病变范围无明显变化,这都是呈良性肿瘤表现[3]。
囊状影是GG最常见征象[4],发生机制可能与肿瘤的缺血坏死或肿瘤细胞自身分泌囊液有关,多表现为单个,呈小圆形或类圆形,大小不一,部分病例厚层显示小囊状影较困难,仅在薄层序列上显示,本组病例全部加扫薄层以显示肿瘤内部细微结构。
局限性钙化是第二常见征象[5],呈片状、圆形或砂砾状,MRI上呈短T1短T2信号,经CT平扫验证为钙化,非出血、脂肪、其他顺磁性物质等。
本研究GG病例未见瘤内出血征象,文献亦报道GG罕见出血[6]。
实性GG多表现为皮层增厚,周围脑沟轻度受压。实性成分多呈等T1稍长T2信号,FLAIR呈稍高信号,与周围脑实质分界欠清。
必须强调的是,GG的诊断不能仅通过CT或MRI阴性检查来排除。文献[7-9]也有报告说,在CT或MRI图像上,没有一个可识别的肿瘤,组织学上证实了神经节细胞瘤的存在。本组有2例患儿家长诉早期癫痫时行CT或MRI平扫未见异常征象。
与文献报道不一致的主要表现为以下三个方面:①强化方式:文献报道[10-12]GG强化多样,可呈无强化、片絮状强化、条纹状强化、环形强化、明显不均匀强化以及明显壁结节样强化,但以强化多见,本组病例以无强化为主,仅1例为典型的壁结节样强化。②边界:文献报道多较清,本组GG边界多不清,术中也证实肿块多与周围组织分界不清。③对于无明确肿瘤形态者仅表现为小片状T2WI、FLAIR序列稍高信号影很少见文献提及,但此类表现在GG中并不少见,术前较易误诊为海马软化灶或硬化,此时建议多平面薄层扫描及增加功能序列观察病变形态及征象以帮助鉴别。

图1 女,2岁,癫痫病史1年7个月,GG(Ⅰ级)。a)横轴面T1WI示左海马体部小片状长T1信号影;b)T2WI呈稍高信号;c)FLAIR序列呈稍高信号(箭),附近脑沟变浅不明显;d)矢状面薄层FLAIR见海马体部小圆形囊状影(箭);e)增强病变未见强化;f)ASL序列示左海马体部较对侧灌注高。 图2 女,6岁,癫痫1年7个月余,左杏仁核实性病灶,GG(Ⅰ级)。a)横轴面T1WI示左杏仁核皮层增厚,体积变大,呈等T1信号,临近脑沟变浅,颞角受压;b)T2WI示左杏仁核内侧条形短T2信号;c)CT显示杏仁核高密度钙化;d)DWI呈等信号;e)ADC图显示较右侧杏仁核信号稍高,较对侧高。
2.多模态MRI表现
DWI:肿瘤实性成分DWI呈等信号,ADC图像上为等或稍高信号,平均最小ADC值为(0.97±0.11)×10-3mm2/s,呈等或略高于对侧颞叶正常脑实质ADC值,显示水分子扩散无受限状态,可能与GG的病理基础有关,GG的肿瘤间质内液体含量丰富、神经元呈漂浮状表现及束状神经轴束附着到少突胶质样细胞,形成松散的黏液基质,导致肿瘤内未结合水分子运动空间增大、扩散明显;本组与文献报道[13]颅内GG的平均最小ADC值(1.45±0.20)×10-3mm2/s有所出入,可能与样本组年龄、病变部位不一样有关。
MRS:NAA峰减低,与对侧正常区相比,GG的NAA/Cr比值降低,Cho/Cr和Cho/NAA比值增加,与文献[14]报道一致,文献亦报道通过MRS可鉴别GG与胶质瘤,GG中Cho/Cr比值低于胶质瘤,NAA/Cr比值高于胶质瘤,证实GG具有肿瘤神经元成分。
3D ASL:作为无创伤灌注成像序列,能客观反映脑肿瘤的微循环灌注情况、肿瘤组织微血管的生成情况及侵袭程度等,在常见脑肿瘤的诊断及胶质瘤的分级中有很好的应用价值,已经在成人脑肿瘤及部分儿童肿瘤中加以应用,但在本组6例行ASL检查的患儿中,WHO分级为Ⅰ、Ⅱ级,灌注表现各异,高、等、低灌注均有表现,出现与文献报道用ASL判断肿瘤级别不一致的情况,也许肿瘤增强、血管再生与脑灌注之间存在一个复杂的关系或者与本研究样本量少有关[15],尚需进一步总结研究。
3.鉴别诊断
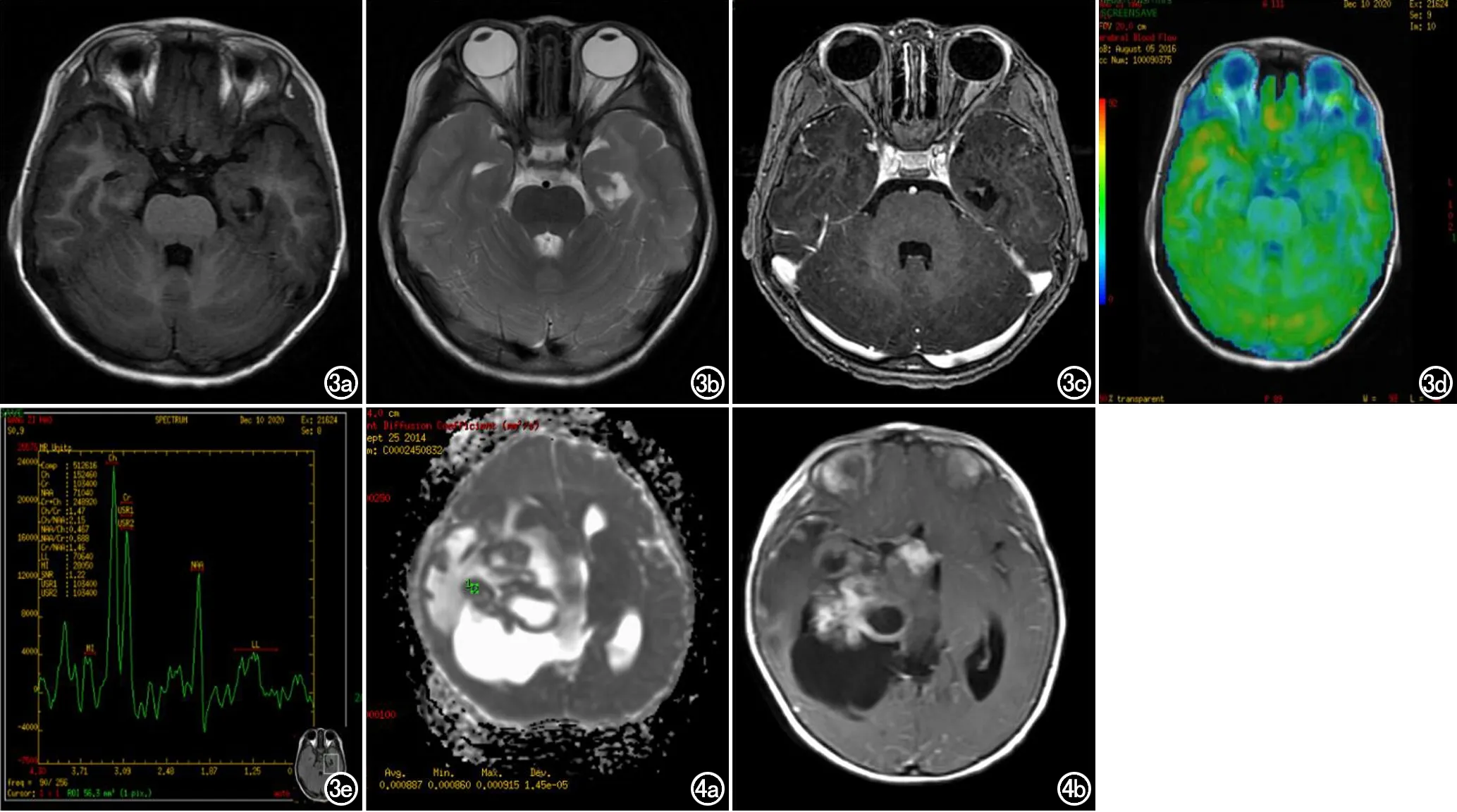
图3 男,4岁,癫痫病史3年,左颞叶囊实性病灶,GG(Ⅰ级)。a)横轴面T1WI示左海马头部囊实性病变,可见壁结节;b)T2WI示灶周轻度水肿;c)增强可见壁结节强化;d)ASL是病变呈等低灌注;e)MRS示病变实性成分区CHo升高,NAA峰下降。 图4 女,6岁,癫痫病史5个月余,GG(Ⅱ级)。a)右颞叶内侧较大囊实性肿瘤,多个囊,大小不一,中度水肿,轻中度占位,最小ADC值为0.86×10-3mm2/s; b) 增强可见实性呈环形或结节状明显强化。
①海绵状血管瘤:海绵状血管瘤T2WI序列上表现为典型的周边低信号“含铁血黄素环”,边缘稍模糊,病灶周围未见水肿、占位征象,由于病灶反复出血,MRI信号混杂,常见于额、颞叶深部髓质区、皮髓质交界区和基底节区,含钙化GG容易与血管瘤混淆,两者好发部位不同;②DNT:位于颞叶皮层内,呈长T1长T2囊性信号,FLAIR序列呈低信号,周围无水肿及占位表现,内部多见分隔,一般无强化,有时难以鉴别;③颞叶软化或海马硬化:部分GG呈小片状FLAIR稍高信号影,容易与软化灶混淆,导致病情延误,建议行薄层扫描,仔细观察病变有无占位效应来加以鉴别;④多形性黄色星形细胞瘤:常见于青少年,颞叶多见,常表现为囊变伴壁结节,增强示结节强化伴邻近脑膜增强-脑膜尾征;⑤胶质瘤:周围水肿和肿瘤分界不清的胶质瘤比GG更常见,MRI或MR灌注成像、MRS结合病变部位有助于鉴别GG和胶质瘤。
本研究不足之处:样本量小,儿童节细胞胶质瘤相对少见,且儿童在MRI检查工作中受镇静效果限制,难以长时间检查,故获取大样本病例数据及功能MRI较为困难,导致无法进一步行统计学分析。
总之,儿童患者,临床表现为癫痫,尤其是长期药物难治性癫痫,MRI表现为发生于颞叶内侧皮层区的异常征象,呈囊实性、实性、无水肿或轻度水肿、强化不明显或结节状强化,应考虑诊断本病的可能,尤其对于无明确肿瘤形态的颞叶内侧FLAIR序列异常征象,更应警惕注意甄别GG的发生,以达到早期诊断并选择合适的治疗方法的目的,从而减少儿童心理及家庭负担。但最终仍需依赖病理学确诊。