晚期前列腺癌患者全身磁共振成像多器官评估思路:MET-RADS-P解读及应用介绍
刘想,韩超,朱丽娜,王慧慧,高歌,吴静云,王鹤,张晓东,王霄英
随着晚期前列腺癌治疗方法的增多,针对晚期转移性前列腺癌的精准评估成为前列腺癌患者影像检查的重要任务之一。近年来多参数磁共振成像(multiparametric MRI,mpMRI)广泛应用于前列腺癌的诊断[1-2],其中DWI不仅可检出腺体内肿瘤[3],也可以检出淋巴结和骨转移病灶[4-5],更可进一步用于全身肿瘤负荷的评价;既可以基于DWI影像表现做定性诊断,也可在ADC图上进行定量测量[6-7]。应用68Ga标记Choline或前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)的PET/CT(68Ga-PSMA/Choline)及PET/MR是临床评估前列腺癌转移的重要成像技术[8-11]。PET/CT在转移病灶的检测中具有较高的敏感性和特异性,但有一定电离辐射,且空间分辨率稍低[12-13]。PET/MR具有辐射暴露少和软组织对比度高的优势,但费用高,尚未广泛临床应用[8,14]。多项研究证明,全身磁共振成像(whole body magnetic resonance imaging,WB-MRI)对晚期前列腺癌患者全身转移的诊断效能与PET/CT及PET/MR相当[11,15],不仅可用于疾病诊断,还可用于评价治疗后反应[16-18]。由于WB-MRI技术复杂,需要制定规范化的图像采集方案和报告标准,才能广泛推广应用。
近年来,泌尿外科、肿瘤学和影像学专家组对WB-MRI采集方案及标准化报告的最低要求提出了建议,即:前列腺癌转移报告和数据系统(metastasis reporting and data system for prostate cancer,MET-RADS-P)[19],并提供了结构化报告的推荐模板[20]。本文结合文献综述和自身应用体会对MET-RADS-P进行解读。
MET-RADS-P的目标
MET-RADS-P的目标是评价晚期转移性前列腺癌全身情况,评估临床治疗效果,也可用于临床试验报告。在治疗过程中,前列腺癌全身转移灶对治疗的反应常常不一致,这是前列腺癌全身转移的重要特点,也是影像学评估的难点[21]。在影像学评估时,既需要对各个局部区域的转移灶做出评价,也需要对全身总体情况做出评价,以利于临床医生做出治疗决策。特别是在开展多中心临床试验时,评价标准必需全面、可重复,在不同机构之间的评价标准要保持一致。
MET-RADS-P综合了多个相关领域的指南、共识和专家意见[22-24],它是WB-MRI扫描技术、读片方法和影像报告的基本规范,用于晚期转移性前列腺癌患者的基线检查和随访检查。报告内容包括定性诊断(局部和总体分类)和定量测量(病灶大小和ADC值)。当全身不同部位的转移灶治疗反应表现不一致时,还要评估继续治疗的获益。
MET-RADS-P检查规范
在1.5T或3.0T磁共振扫描仪上完成WB-MRI检查,采用的扫描序列包括T1WI、T2WI、DWI。在设备自带的工作站上生成ADC图。影像报告标准化的前提是标准的图像,因此各种指南都对影像检查方案有明确的定义[25-26]。MET-RADS-P的检查方案扫描范围包括:①脊柱;②头颈躯干部的骨骼、淋巴结、软组织和内脏;③盆腔局部的肿瘤(表1)。主要MR扫描序列为T1WI、T2WI和DWI。常规扫描方案用于骨和淋巴结转移的检测,大约可在30min内完成检查;可选扫描方案增加了针对软组织和内脏转移的检测,合计在45~50min内完成。
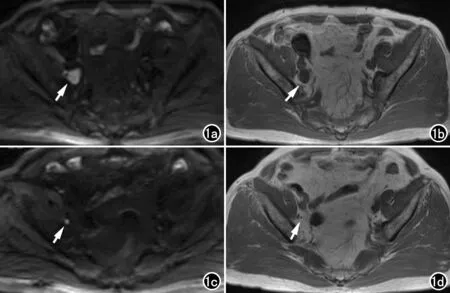
图1 淋巴结转移治疗反应评估(RECIST v1.1)。男,52岁,前列腺癌,盆腔肿大淋巴结治疗后部分缓解(PR)。a、b)2018年8月治疗前DWI(b=800s/mm2)及T1WI图像示右侧髂外肿大淋巴结(箭),长径为22.19mm。c、d)2019年10月前列腺癌治疗一年后,DWI及T1WI图像示原右侧髂外肿大淋巴结减小(箭),长径为6.33 mm。目标病灶的长径值减少15.86mm,超过30%,符合PR。
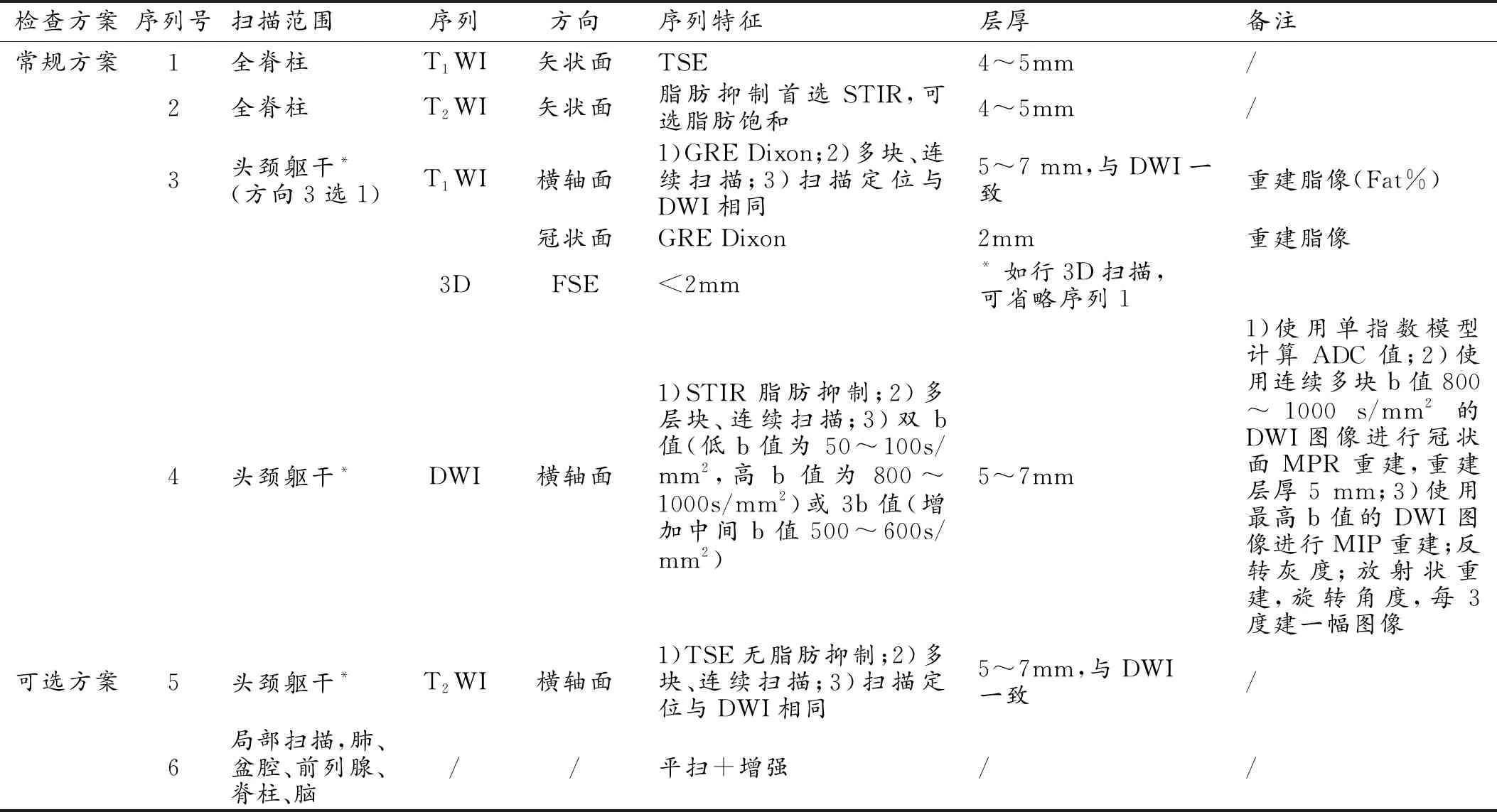
表1 MET-RADS-P的检查方案
MET-RADS-P诊断标准
MET-RADS-P采用了前列腺癌临床试验工作组(Prostate Cancer Working Group,PCWG 3)提出的标准,包括分类诊断和定量诊断[27]。
1.分类诊断的方法
将评估对象分为4组,包括:①淋巴结3个区域:盆腔淋巴结、腹膜后淋巴结和其他淋巴结;②脏器3个区域:肺、肝、其他软组织和脏器;③前列腺局部病灶1个区域:前列腺;④骨骼7个区域:颅骨、颈椎、胸椎、腰骶椎、胸廓(锁骨、胸骨、肩胛骨、肋骨)、肢体和骨盆。
如患者为初次检查,则报告各组有无转移灶,以及可测量的转移灶的大小(表2)。如患者为随访检查,则要对多次检查结果进行比较,根据分类诊断标准做出疾病进展及治疗反应的分类。前3组的治疗反应分类评价使用传统的疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1/PCWG 3(表2,图1),骨骼的治疗反应分类评价使用MET-RADS-P自定义标准(表3,图2~3)。
将上述4组对象的评估结果合并起来做出一个综合分类。按Likert 1-5给出一个反应评价分类(response assessment category,RAC):1,高度可能反应;2,可能反应;3,稳定;4,可能进展;5,高度可能进展(表3)。
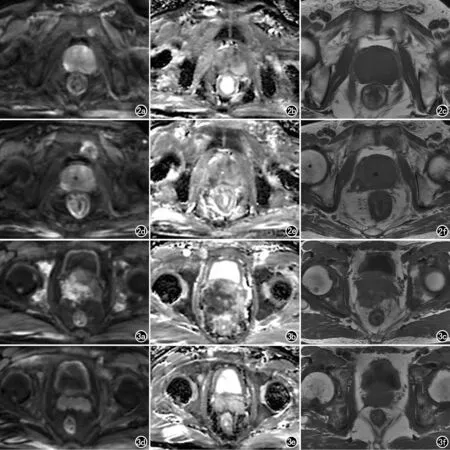
图2 骨转移治疗反应评估(MET-RADS-P标准)。男,65岁,前列腺癌,左侧耻骨骨转移病灶治疗后反应评估为高度可能进展(RAC-5)。a~c为治疗前(2019年7月),d~f为内分泌治疗1年后(2020年6月)。a)DWI(b=800s/mm2)示左侧耻骨高信号转移灶(箭);b)ADC上低信号病灶(箭);c)T1WI上低信号病灶(箭);d)骨转移病灶增大,DWI图上信号强度增强;e)ADC示增大低信号病灶区域;f)T1WI示增大低信号病灶区域。 图3 骨转移治疗反应评估(MET-RADS-P标准)。男,58岁,前列腺癌,双侧髋臼、股骨头内多发转移灶治疗后反应评估为高度可能反应(RAC-1)。a~c为治疗前(2019年2月),d~f为经内分泌治疗4个月后(2019年6月)。a)治疗前DWI(b=800s/mm2)示双侧髋臼、股骨头内多发高信号转移灶(箭);b)ADC示弥漫低信号区域(箭);c)T1WI示弥漫低信号区域(箭);d)DWI图像上病灶信号强度降低;e)ADC示低信号区域缩小;f)T1WI示低信号区域缩小。
将上述分类转换成临床医生熟悉的常见肿瘤反应分类写在报告中,具体如下(表3):无病灶(no disease)、完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。评价肿瘤治疗反应时,应与治疗前基线检查结果做比较,必要时也应与最近一次检查结果做比较。如有新发病灶,则将新发病灶与既往病灶体积增大者分别报告。
分类诊断时,常需要结合ADC值的定量测量结果(表3)。但应注意,对于RAC-1类或RAC-2类,常有DWI/ADC变化和形态学表现不一致的情况。如骨髓硬化、纤维化反应或骨髓脂肪重新出现时,都提示为治疗有反应,但ADC值不一定升高,仍应考虑为RAC-1类或RAC-2类。

表2 MET-RADS-P肿瘤治疗反应RECIST v1.1分类
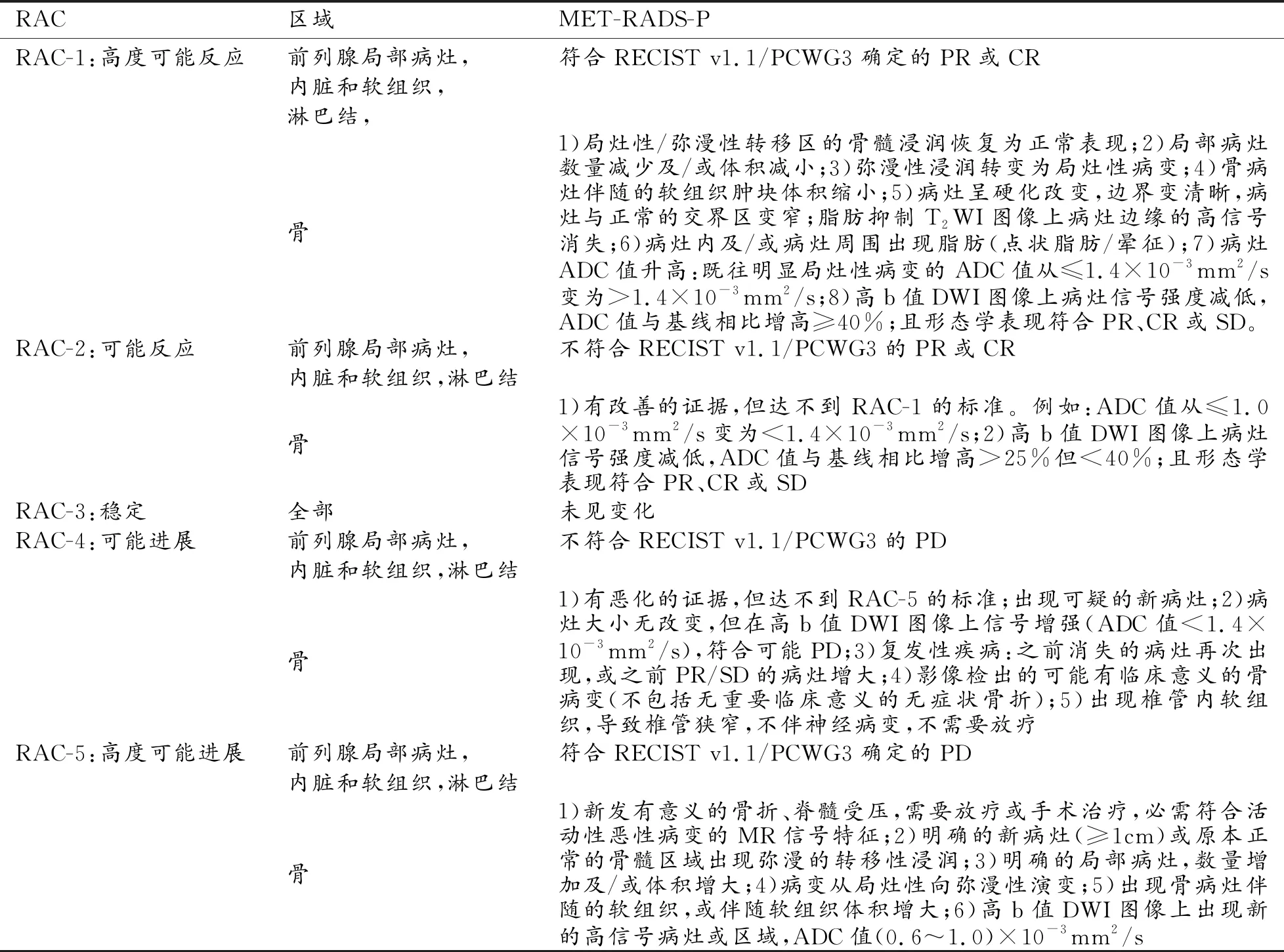
表3 MET-RADS-P肿瘤治疗反应评估分类
前列腺癌全身多发转移瘤常常对治疗反应不一致,造成评价困难。META-RADS-P规定当总体评估为SD或PR、但个别病变有进展时,可报告为“不一致反应”或“混合反应”。“不一致反应”可以描述为:“轻微进展”或“明显进展”,其出发点是影像科医生根据影像学表现认为当前的治疗效果不佳,建议使用替代的治疗方案。当单个区域内转移瘤病灶呈现不一致反应时,可以给出2个到3个RAC分类,如RAC 1st、RAC 2nd等(图4)。
2.定量诊断的方法
RECIST v1.1/PCWG3和RAC的分类中均使用了定量指标,包括病灶径线的测量和ADC值的测量,META-RADS-P对测量方法有明确规定。
病灶径线的测量:在T1WI图像上测量转移性病灶长径,无特殊说明时仅对长径>1.5 cm的转移灶进行测量。
ADC值的测量:FS T2WI、DWI上表现为高信号的含水量增多区域才需要通过测量ADC值来定性。骨转移灶在ADC图上的测量要求病灶在低、中b值的ADC图上均可见;ROI放置于低、中b值的ADC图上,且应尽可能包括病灶的全部。
定量测量值的比较:将当前软组织病灶的测量值与既往测量值做比较、判断RECIST分类时,有2个可能的参考值:基线值或治疗过程中的最低值,二者中选较小者用于比较。
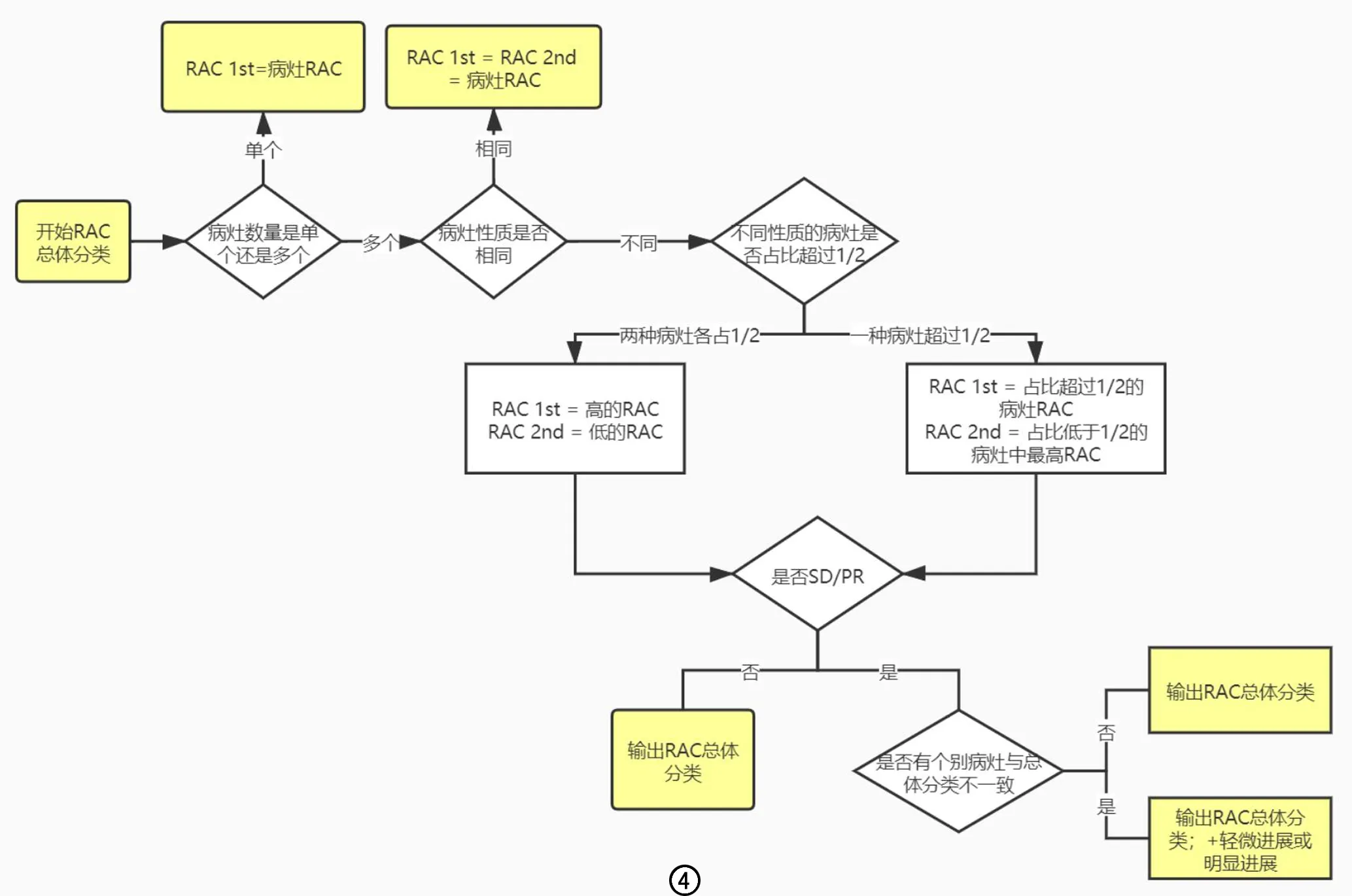
图4 RAC分类诊断流程。
基病灶识别、定位和测量:在基线检查时,所有明确的肿瘤病灶应定位在14个区域内:1个原发灶区域、3个淋巴结区域、3个内脏区域和7个骨骼区域。骨病灶的测量应在高质量的T1WI上进行。骨、淋巴结和软组织病灶每类最多测量5处(长径≥1.5 cm),即最多测量15个病灶。潜在的靶病灶应进行测量并记录。非靶病变应记录但不测量。短径≥1.0 cm但<1.5 cm的淋巴结被认为是病理性的但不测量。内脏病灶长径≥1.5 cm时认为是可测量病灶,内脏病灶<1.5 cm时认为是病理性的但不可测量。
随访反应评估:临床治疗患者的随访时间间隔通常为12~16周,发现可疑复发病灶时可缩短随访时间间隔。每次随访报告应对不同解剖区域病灶进行定性评价、定量测量和比较变化来进行反应评估。在基线检查时已经测量过的、确定的病灶应重复测量,并应用RAC评估和记录转移模式的变化。原发性疾病、淋巴结、内脏和骨骼病灶的总体反应评估及各个病灶出现的不一致/混合反应也应当记录。
MET-RADS-P的临床应用
1.应用现状目前国内外关于MET-RADS-P应用的报道较少。Yoshida等[28]在去势抵抗前列腺癌(castration-resistant prostate cancer,CRPC)患者的生存率分析研究中发现,骨转移的范围和是否存在内脏转移与CRPC的生存率密切相关,且MET-RADS-P评分可作为作为CRPC预后的影像学生物标志物。MET-RADS-P可对晚期前列腺癌(advanced prostate cancer,APC)患者的转移疾病反应进行可重复的评估。Paola等[29]比较了不同专业水平阅片者在应用MET-RADS-P进行转移评估时的一致性,他们发现,不同水平的阅片者在骨转移评估方面的一致性很好,但其他部位的转移评估一致性各有不同。考虑到骨转移评估在APC患者中的重要性[30],应用MET-RADS-P可满足临床精确监测前列腺癌转移的需求。
2.基于MET-RADS-P的结构化报告构建
结构式报告的使用有利于MET-RADS-P数据的系统性管理[31-32],我们根据MET-RADS-P的标准化要求,结合本单位实际临床工作经验,构建了前列腺WB-MRI的结构化报告模板,报告主要包括:扫描方案、临床评估、技术评估、影像所见和诊断印象五部分(图5,表4)。
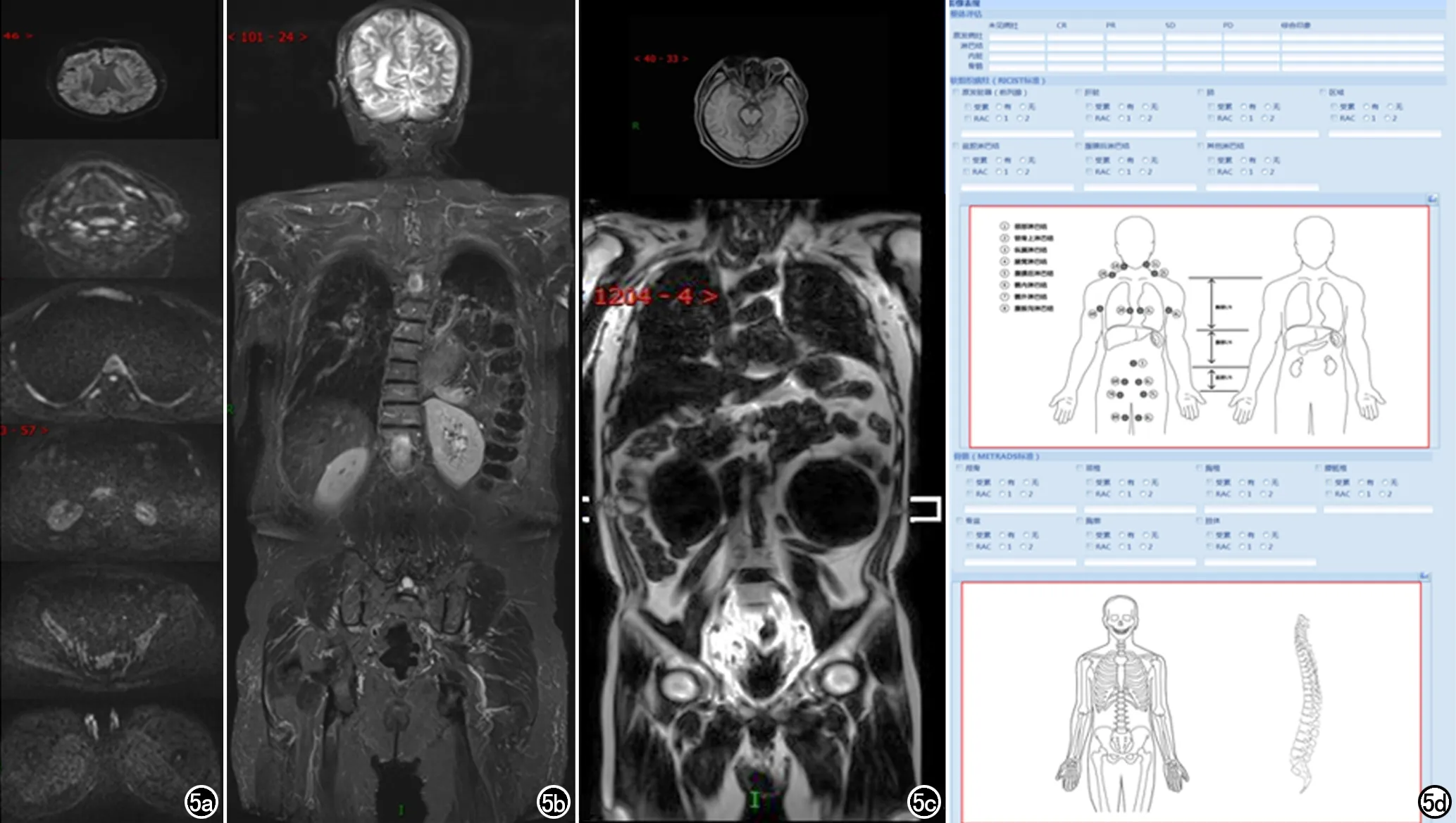
图5 META-RADS-P结构化报告。a)前列腺WB-DWI(头、颈、胸、腹、盆腔、大腿)图像;b)前列腺WB-MRI T2WI图像;c)前列腺WB-MRI T1WI 图像;d)META-RADS-P结构化报告,影像表现主要包括原位肿瘤、全身软组织和淋巴结、全身骨骼等,按照指南要求填写影像特征,自动生成META-RADS-P分类报告。

表4 META-RADS-P结构化报告要点
2.MET-RADS-P结构式报告的人工智能接入
在RIS系统中预设规则,检查项目为“WB-MRI前列腺癌全身评估”,在MR扫描仪完成WB-MRI检查后,DICOM图像经PACS发送到人工智能(artificial intelligence,AI)服务器,完成图像质量分类、解剖区域分割、转移病灶分割、转移病灶分类后,得到病灶的位置、大小、性质信息,发送到结构化报告服务器。医生打开结构化报告的病灶列表可见软件返回结果,经确认后自动填写在结构化报告中,影像特征存储在结构化报告数据库中(图6)。
局限性
MET-RADS-P是一份较为全面系统的报告指南,在实际应用中的操作性较为复杂,目前国内有关其具体的应用情况较少,有一定的局限性。首先是成像技术本身的局限性。WB-DWI对前列腺癌转移的评价是有局限性的,它不能显示正常大小淋巴结内的微转移[33-34],对小于1 cm的肺转移灶不敏感[35],无法在未使用对比剂的情况下明确排除脑转移瘤。其次是在实际临床工作中MET-RADS-P的宣传教育工作不到位,临床应用过程中的一致性不高,应加大对MET-RADS-P的宣传,强调规范化的应用,达到技术操作和诊断标准的一致,这是将MET-RADS-P实际应用于临床工作的前提。
结论及展望
MET-RADS-P系统为晚期转移性前列腺癌患者的WB-MRI基线和随访检查的图像采集、读片和报告提供了最低标准。利用区域和总体评估标准,MET-RADS-P可用于实际临床工作,也可用于临床研究中的患者分层。MET-RADS-P中创新性地提出了骨转移瘤治疗反应分类的新方法,有可能经过大量临床验证研究之后成为新的诊断标准,以实现骨转移瘤的精准评价。随着肿瘤精准治疗的进展,未来有可能将MET-RADS-P的标准化模式推广到其他肿瘤,如乳腺癌全身转移、淋巴瘤和血液病等。全身系统疾病评价的复杂性也为AI的引用提供了一个良好的契机。例如应用AI进行病灶的自动检测,应用影像组学对患者状态进行分析等都可有效缓解医生们的工作压力,优化临床的工作流程[36-39]。
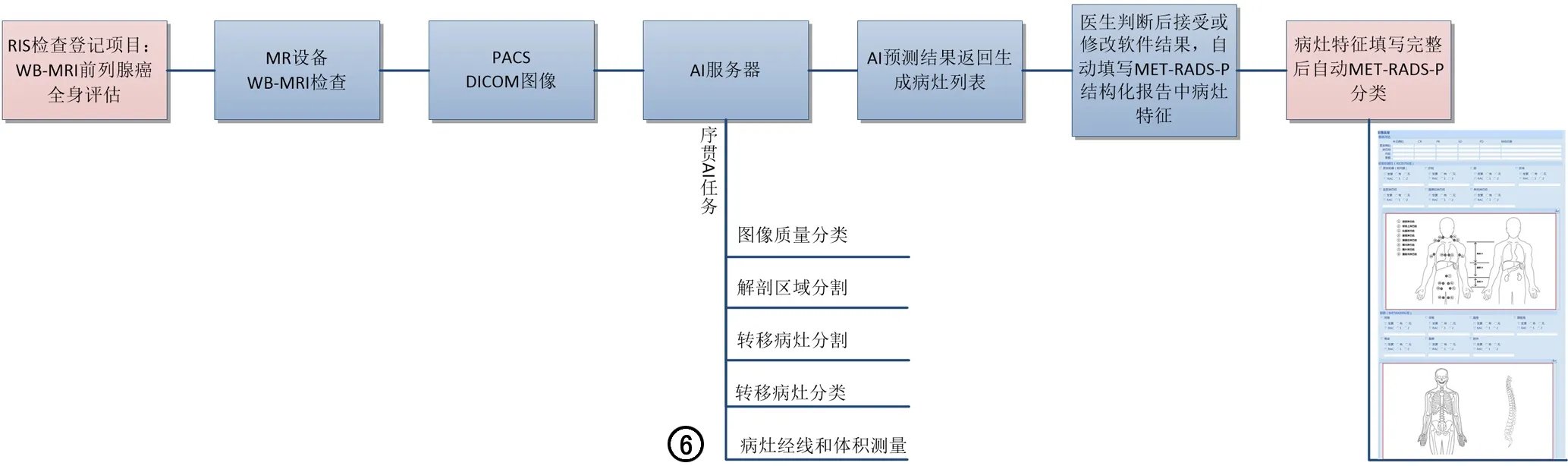
图6 前列腺癌全身转移AI接入结构化报告。
总之,META-RADS-P的提出是对晚期前列腺癌全身转移评估的有益尝试,随着使用经验的增多,这种疾病的影像诊断可能发生革命性的变化。既往影像学评价通常是给出一个整体概念,不能体现疾病进展和/或反应的异质性。而随着这种精准的、全身异质性的评价体系的使用,治疗方案的选择也将发生变化。随着META-RADS-P相关研究的进行,高水平研究证据的积累,未来借助信息化工具和智能化技术将影像信息和临床信息整合在一起[40],将能做出更好的临床决策,提升影像服务的临床价值。
志谢:感谢北京赛迈特锐医学科技有限公司张虽虽、赵治锋、吕磊、段博文在结构化报告构建的贡献,张靖远、王祥鹏、刘伟鹏参与AI工作的讨论。