亲水胶体对未漂洗革胡子鲶鱼鱼糜凝胶特性的影响
鲍佳彤,杨淇越,宁云霞,梁丽雅,李 玲,马俪珍
(天津农学院食品科学与生物工程学院,国家大宗淡水鱼加工技术研发分中心,天津市水产品加工及质量安全校企协同创新重点实验室,天津 300384)
革胡子鲶鱼不仅含有高蛋白和优质脂肪,还具备养殖密度高,成本低,无肌间骨,便于加工等特点。鱼肉加工成鱼糜制品时常需要漂洗工艺,但漂洗不仅会导致大约20%~30%的水溶性蛋白流失[1],还易造成水资源浪费和环境污染[2]。如果不经过漂洗工艺,直接采肉作为原料利用,这样不仅能减少营养成分流失,还能降低环保压力和设备投入,提高企业的经济效益。但由于革胡子鲶鱼属于淡水红肉鱼类,其凝胶形成能力比较低[3],如果不漂洗去除其中的色素、部分脂肪和无机盐以及水溶性蛋白等物质,会更影响其凝胶形成能力和白度。因此,如何提高未漂洗革胡子鲶鱼鱼糜凝胶特性是人们关注的焦点。
目前,提高鱼糜凝胶特性的常用方法是使用转谷氨酰胺酶(Transglutaminase,TGase)[4]、CaCl2[5]、非肌肉蛋白[6]、淀粉[7]和亲水胶体[8]等外源添加物。研究表明,在鱼糜制品加工过程中添加的某些亲水胶体能充分与水结合,形成黏稠的溶液或胶体,并与鱼糜蛋白的网络结构交织,进而提高鱼糜凝胶强度;同时在热诱导鱼糜凝胶的形成过程中,随着温度的上升,亲水胶体吸水膨胀,将水分子锁在网络结构中,进而增强凝胶持水性[8-9],但不同种类和添加量的亲水胶体对不同鱼糜原料的凝胶品质影响差异很大[10-11]。罗华彬等[12]研究得出,添加瓜尔胶(Guar Gum, GRG)、魔芋胶(Konjac,KC)和沙蒿胶均能提高带鱼鱼糜的凝胶强度和持水性。陈海华等[13]研究发现,可得然胶(Curdlan Gum, CDG)、罗望子胶、KC、卡拉胶(Carrageenans,CGN)、琼胶和羧甲基纤维素均能提高竹荚鱼鱼糜的凝胶强度,而添加GRG 和海藻酸钠则影响不显著。丁丽丽等[14]研究得出在白鲢鱼糜中添加0.1%~0.2%的CDG,不仅可以提高鱼糜制品的凝胶特性,也可适当降低成本。范选娇[15]研究发现,结冷胶(Gellan Gum,GNG)可以促进白鲢鱼糜中肌原纤维重链之间的交联,有利于控制鱼糜凝胶的劣化程度。然而,目前国内外关于亲水胶体对未漂洗革胡子鲶鱼鱼糜凝胶性能的研究鲜有报道。
本试验以未经漂洗处理的革胡子鲶鱼鱼糜为研究对象,在添加2.2%食盐、0.4% TGase、20 mmol/kg CaCl2、0.2%浓缩乳清蛋白(Whey Protein Concentrate,WPC)和6%木薯变性淀粉(Cassava Modified Starch,CMT)基础上,分别添加不同亲水胶体(0.2% GNG、0.2%CGN、0.2%CDG 和 0.2%GRG),研究其对革胡子鲶鱼鱼糜的凝胶特性、白度值、持水力、动态流变学性质和水分迁移变化规律等的影响,为生产新的高品质鱼糜制品提供数据支持。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
鲜活革胡子鲶鱼选购于天津市红旗农贸综合水产批发市场,体重1.5~1.6 kg/条,体长40~42 cm。购回后立即放入冰水(4~6 ℃)中保藏备用。
TGase(活力100 U/g),购于江苏一鸣生物股份有限公司;食盐、白糖,购于天津市红旗农贸市场;复合磷酸盐、山梨糖醇,购于江阴连盛化工有限公司;PA塑料肠衣,购于天津市汇润泽塑料包装制品有限公司;食品级氯化钙(CaCl2),购于天津市光复科技发展有限公司;WPC,购于 Arla Foods Ingredients;CMT、GNG、CGN、CDG、GRG(均为食品级),购于河南万邦实业有限公司。
1.1.2 仪器与设备
CM-14 型斩拌机,西班牙美卡公司;CM-5 型色差仪,日本 Konica Minolta 公司;TA-XT plus 型物性测定仪,英国Stable Micro System 公司;PQ-001 型核磁共振分析仪,上海纽迈电子科技有限公司;BZZT-IV-90 型蒸煮桶,嘉兴艾博实业有限公司;IMS-50 型制冰机,河南兄弟仪器设备有限公司;移液枪,德国Eppendorf 公司;BJRJ-82 型绞肉机,浙江嘉兴艾博实业有限公司;SDX-1 型全自动风冷速冻箱,天津市特斯达食品机械科技有限公司;CLC-B2V-M/CLC 111-TV 型恒温恒湿培养箱,艾力特国际贸易有限公司;LLJ-A10T1 型搅拌机,广东小熊电器有限公司;Physica MCR 301 型旋转型流变仪,奥地利安东帕有限公司。
1.2 方法
1.2.1 革胡子鲶鱼鱼糜的制备
参考鲍佳彤等[16]的方法制备革胡子鲶鱼鱼糜。
1.2.2 革胡子鲶鱼鱼糜凝胶的制备
参考鲍佳彤等[16]的方法制备革胡子鲶鱼鱼糜凝胶。
1.2.3 试验方案设计
按照“1.2.2”方法制备革胡子鲶鱼鱼糜凝胶,试验共设5 个处理组。其中空白对照组(CK 组)是在革胡子鲶冷冻鱼糜中加入2.2%食盐(以冷冻鱼糜计,下同)、0.4% TGase、20 mmol/kg CaCl2、0.2% WPC、6%CMT 和12.68%冰水;其余4 个试验组在CK 组的基础上分别加入 0.2% GNG、0.2% CGN、0.2% CDG 和0.2%GRG。
1.2.4 测定项目与方法
1.2.4.1 凝胶特性
参考鲍佳彤等[16]方法测定。
1.2.4.2 持水性
参考鲍佳彤等[16]方法测定。
1.2.4.3 白度值
参考鲍佳彤等[16]方法测定。
1.2.4.4 LF-NMR 弛豫时间T2和各个区间氢质子的相对含量P2
参考鲍佳彤等[16]方法测定。
1.2.4.5 动态流变学特性
参考鲍佳彤等[16]方法测定。
1.2.5 数据处理
运用Microsoft Excel 2003 软件对试验数据进行处理,使用Statistic 8.1 软件进行显著性分析,使用SigmaPlot 10.0 软件进行绘图。
2 结果与分析
2.1 亲水胶体对革胡子鲶鱼鱼糜凝胶特性的影响
由表1 可以看出,添加不同种类亲水胶体对革胡子鲶鱼鱼糜凝胶特性的影响不同。其中,添加0.2%CGN对革胡子鲶鱼鱼糜凝胶强度与CK 组之间差异不显著,这与叶丽红等[17]在鱼丸中添加0.2%Κ-CGN 的结果一致;添加0.2%CDG 的革胡子鲶鱼鱼糜凝胶强度为组内最大值,较CK 组提高了21.29%(P<0.05),这可能是因为CDG 多糖分子间或分子内形成的氢键和水合作用造成,在制备革胡子鲶鱼鱼糜凝胶的第2 段90 ℃高温加热条件下形成了具有较好弹性和硬度的热不可逆高强度凝胶[18],使革胡子鲶鱼鱼糜凝胶的破断力和破断距离较CK 组分别显著增加了11.22%和6.55%(P<0.05),提高了革胡子鲶鱼鱼糜凝胶强度。这一结果与王培森[19]研究的CDG 在肌球蛋白凝胶形成的过程中可提高其凝胶强度,并且效果优于CGN 的结果相一致。与CK 组相比,添加0.2%GNG 和0.2%GRG显著降低了革胡子鲶鱼鱼糜的凝胶强度(P<0.05),分析其原因是GNG 属于微生物分泌的阴离子型孢外多糖[20],对二价阳离子较敏感[21],在阳离子存在的条件下,GNG 形成的凝胶具有可逆性[15,22],并且有研究表明随着阳离子含量的增加,GNG 凝胶强度呈先上升后下降的趋势。而本试验中各组均添加了20 mmol/kg CaCl2,可能是由于Ca2+的加入阻碍了GNG 双螺旋结构的聚集凝结[15],从而使革胡子鲶鱼鱼糜凝胶具有可逆性;GRG 是一种中性非凝胶多糖,虽然具有很好的黏性,可吸附革胡子鲶鱼鱼糜中一部分水分,但会降低其破断距离,影响革胡子鲶鱼鱼糜凝胶强度的提高。

表1 亲水胶体对革胡子鲶鱼鱼糜凝胶特性的影响Table 1 Effect of hydrophilic colloid on gel properties of Catfish(Clarias gariepinus)surimi
2.2 亲水胶体对革胡子鲶鱼鱼糜凝胶持水性的影响
持水力的强弱受蛋白质-蛋白质及蛋白质-多糖分子间的静电作用、疏水相互作用及氢键作用等影响,一般保留在蛋白质网络基质中的水分子越多,持水性越强[23]。由图1 可以看出,添加不同种类的亲水胶体均可显著增强革胡子鲶鱼鱼糜凝胶的持水性(P<0.05),这与王聪[24]在白鲢鱼鱼糜中添加0.2%亲水胶体的结果相一致,添加4 种亲水胶体后的革胡子鲶鱼鱼糜凝胶持水性均在95%以上,说明这4 种亲水胶体均可结合革胡子鲶鱼鱼糜蛋白分子间的氢键,与凝胶体系中更多的游离水结合,使水分滞留在革胡子鲶鱼鱼糜凝胶网络结构中[24-25]。其中,添加0.2%CDG 的革胡子鲶鱼鱼糜凝胶持水性最高(95.77%),这与Hu 等[26]报道CDG 的添加能显著增加带鱼鱼糜凝胶的持水性的结论一致。结合革胡子鲶鱼鱼糜凝胶特性可知,CDG 能存在于革胡子鲶鱼肉的蛋白网络内,使革胡子鲶鱼鱼糜凝胶形成更致密的复合凝胶网络结构[27],增大革胡子鲶鱼鱼糜凝胶与水分的结合力,增强革胡子鲶鱼鱼糜凝胶的弹性和凝胶强度,从而锁住鱼糜凝胶中更多的水分。
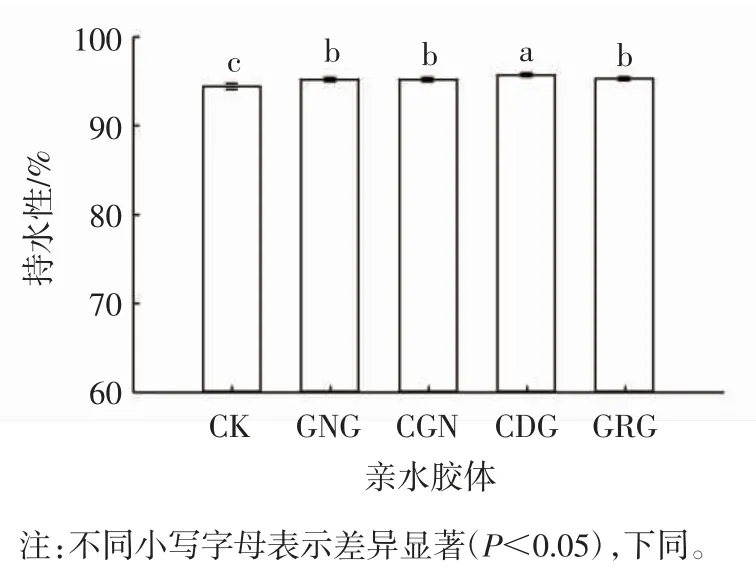
图1 亲水胶体对革胡子鲶鱼鱼糜持水性的影响Fig.1 Effect of hydrophilic colloid on water holding capacity of Catfish(Clarias gariepinus)surimi
2.3 亲水胶体对革胡子鲶鱼鱼糜凝胶白度值的影响
白度反映鱼糜的色泽和等级,一般色泽洁白的鱼糜制品更易受消费者喜爱。由图2 可以看出,添加亲水胶体能有效增强鱼糜凝胶的白度值,这与陈海华等[13]、张建友等[28]和范选娇等[29]的研究结果相符。但添加了亲水胶体的革胡子鲶鱼鱼糜凝胶的白度值(70.11~70.60)仍低于竹荚鱼鱼糜凝胶(75.84~87.84)[13]和白鲢鱼鱼糜凝胶(71.46~73.40)[29],这是因为鱼糜制品的白度值不仅与添加物本身的颜色有关[30],还与鱼肉本身的色泽有关。本试验是采用革胡子鲶鱼未经过漂洗工艺制成的鱼糜,且革胡子鲶鱼属于红肉鱼,故导致其白度值比较低。而竹荚鱼和白鲢鱼都是经过漂洗工艺,去除了鱼肉中的色素、脂肪、无机盐等物质,因此其白度值得到提高[2]。所以本试验革胡子鲶鱼鱼糜凝胶的白度值略低于竹荚鱼鱼糜凝胶和白鲢鱼鱼糜凝胶,但感官评价仍处于可接受范围内;而且在本试验亲水胶体的添加量(0.2%)范围内,4 种亲水胶体与水结合,在加热后溶解成透明溶液[29],增加了革胡子鲶鱼鱼糜的白度,并且较高的持水性也可提高革胡子鲶鱼鱼糜凝胶对光的折射性[24]。因此在本试验中,亲水胶体的添加可以提高革胡子鲶鱼鱼糜凝胶的白度值。

图2 亲水胶体对革胡子鲶鱼鱼糜凝胶白度值的影响Fig.2 Effect of hydrophilic colloid on whiteness of Catfish(Clarias gariepinus)surimi gel
2.4 亲水胶体对革胡子鲶鱼鱼糜凝胶横向弛豫时间(T2)和各个区间氢质子的相对含量(P2)的影响
低场核磁共振(LF-NMR)技术能够反映出热诱导的肌原纤维蛋白凝胶内部水分的流动性[31]。一般T2越短表明水与底物结合越紧密,反之则表明水分与底物结合越不紧密[32]。从图3 可以看出,革胡子鲶鱼鱼糜凝胶在T2弛豫时间分布出现了4 个峰,该结果与Møller 等[33]报道结果一致。T21-1(0.1~1 ms)代表能与蛋白质等大分子表面极性基团相结合的单层水;T21-2(1~10 ms)代表能够通过与蛋白质中的酰胺基、淀粉纤维中的羟基形成键能较小的氢键结合水,此部分水结合程度较T21-1低,并可与T21-1统称为结合水(T21);T22(10~300 ms)表示束缚在革胡子鲶鱼鱼糜中凝胶微观网络结构中的不易流动水,约占鱼糜总凝胶水分的80%以上,是最主要的水分;T23(300~1 000 ms)代表存在于革胡子鲶鱼鱼糜凝胶网络结构以外的可以任意流动的自由水[34]。
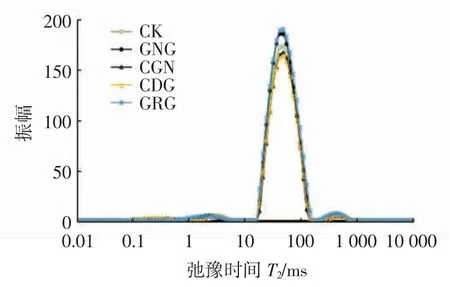
图3 亲水胶体对革胡子鲶鱼鱼糜凝胶横向弛豫时间(T2)的影响Fig.3 Effect of hydrophilic colloid on transversal relaxation time(T2)of Catfish(Clarias gariepinus)surimi gel
从表2 可以看出,添加了4 种亲水胶体的革胡子鲶鱼鱼糜凝胶样品的T2与CK 组之间差异均不显著,但T22有降低的趋势,说明添加亲水胶体可能使革胡子鲶鱼鱼糜凝胶中的不易流动水朝结合水方向迁移。

表2 亲水胶体对革胡子鲶鱼鱼糜凝胶T2 的影响Table 2 Effect of hydrophilic colloid on T2 of Catfish(Clarias gariepinus)surimi gel 单位:ms
T21、T22、T23的积分面积所占总积分面积的百分比分别用P21、P22和P23表示,代表各个区间氢质子的相对含量,即所代表的水分组分T21、T22、T23的相对含量(见表3)。由表3 可以得出,添加4 种亲水胶体均会使革胡子鲶鱼鱼糜凝胶P22降低,试验结果显示亲水胶体的添加可使鱼糜凝胶中水分发生了迁移变化,其中添加GNG、CGN 和CDG 后P21均显著增加(P<0.05),这说明水分向结合水方向迁移,自由度降低,其中CDG 组P21达到组内最大值(3.37%);添加GRG 则使 P23显著增加(P<0.05),说明水分向自由水方向迁移,自由度增加。分析上述变化的原因,GRG是一种中性非凝胶多糖,虽然能在水中形成黏稠的胶凝体,具有良好的持水性,但一般情况下GRG 不能形成凝胶,所以其形成凝胶和吸水溶胀的能力较其他亲水胶体差[35]。GNG、CGN 和CDG 的添加能增强革胡子鲶鱼鱼糜凝胶内部相邻蛋白质的疏水相互作用力,降低革胡子鲶鱼鱼糜体系中的熵值,促进蛋白质之间的聚集和交联,有助于革胡子鲶鱼鱼糜蛋白凝胶网络结构的形成[36],并且亲水胶体的加入能改变鱼糜蛋白的构象。有研究表明,添加一定浓度的CDG 和CGN 有助于α-螺旋向β-折叠与β-转角转变,提高革胡子鲶鱼鱼糜凝胶维持水分的能力[24,37],使革胡子鲶鱼鱼糜凝胶中的P21增加,利于革胡子鲶鱼鱼糜形成凝胶强度更强、持水性更高的鱼糜凝胶网络结构。本试验中,亲水胶体对革胡子鲶鱼鱼糜凝胶水分迁移变化的结果与其凝胶特性变化结果相一致。
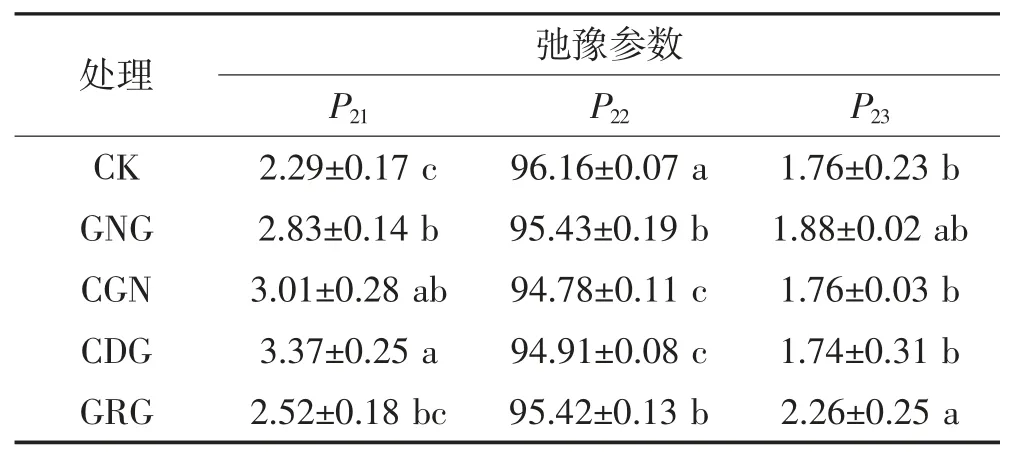
表3 亲水胶体对革胡子鲶鱼鱼糜凝胶P2 的影响Table 3 Effect of hydrophilic colloid on P2 of Catfish(Clarias gariepinus)surimi gel 单位:%
2.5 亲水胶体对革胡子鲶鱼鱼糜凝胶动态流变学特性的影响
储能模量(G′)也称弹性模量,它反映蛋白凝胶网络结构的形成情况,代表物质的弹性特征;损耗模量(G″)也称为黏性模量,它反映样品的黏性特征[38]。一般而言,样品G′越高,其动态流变学特性越好,凝胶性也越好。由图4 可以看出,4 种亲水胶体组和CK 组的G′均高于G″,说明添加或不添加亲水胶体,革胡子鲶鱼鱼糜中的肌原纤维蛋白或蛋白与亲水胶体混合样品的G″随温度变化的增速慢于G′[39],革胡子鲶鱼鱼糜凝胶样品更趋于弹性特性。进一步分析发现,在相同的升温区间内,4 种亲水胶体组与CK 组的革胡子鲶鱼鱼糜G′与G″的变化趋势基本一致,曲线均出现了3 种变化趋势。其中,30~47 ℃时,4 种亲水胶体组和CK 组的G′均有小幅度增加,G″均迅速升高,CK、CDG 和 GRG 组在 45.9 ℃达到最大值,GNG 和CGN 在48.3 ℃达到最大值,这可能是在氢键的作用下,革胡子鲶鱼鱼糜中的蛋白质分子间发生交联,形成较弱的凝胶网络结构[40],加入亲水胶体后,亲水胶体与革胡子鲶鱼鱼糜中的水结合,形成黏稠状的凝胶,能加固革胡子鲶鱼鱼糜刚形成的微弱的凝胶网络结构;47~55 ℃时,4 种亲水胶体组和 CK 组的 G′均出现小幅下降的趋势,G″均迅速下降,这说明该阶段内源蛋白水解酶活性较高,肌原纤维蛋白发生降解,已形成的蛋白凝胶网络结构遭到破坏,导致G′下降[41],但是添加了4 种亲水胶体的革胡子鲶鱼鱼糜下降幅度均小于CK 组,这可能是因为亲水胶体的加入减弱了革胡子鲶鱼鱼糜凝胶劣化的发生;在55~94 ℃时,4种亲水胶体组和CK 组的G′均迅速上升,G″均呈曲折上升的趋势,这主要是因为革胡子鲶鱼鱼糜中肌球蛋白重链和肌动球蛋白的变性伸展使其形成了不可逆的鱼糜凝胶网络结构[42],从而提高了G′。
由图4 可以看出,4 种亲水胶体组之间的G′和G″变化曲线在30~50 ℃期间几乎处于重叠状态,但可以明显看出均显著高于 CK 组(P<0.05),80~100 ℃时,4 种亲水胶体对G′的影响由大到小的顺序依次为:CGN>CDG>GNG>GRG>CK,对G″的影响由大到小的顺序依次为:GNG>CGN>CDG>GRG>CK,这一变化结果可能与4 种亲水胶体自身性质和革胡子鲶鱼鱼糜凝胶在加热和降温的形成过程有关。其中CDG 属于中性多糖,在加热温度达到90 ℃时,CDG本身在加热过程中形成了热不可逆的高强度凝胶结构[43],加固了肌球蛋白分子的网络结构;GNG 在溶于水加热后,通过革胡子鲶鱼鱼糜中分子间氢键的作用能形成较透明坚实的凝胶结构,增加了革胡子鲶鱼鱼糜的黏性[20],从而增加了G″值;CGN 具有冷凝胶的特点[42]。本试验是将革胡子鲶鱼鱼糜在90 ℃下加热制成革胡子鲶鱼鱼糜凝胶,再放入冰水中迅速降温以加固凝胶网络形成,所以添加了CGN 的革胡子鲶鱼鱼糜凝胶的G′值较高;而GRG 是一种中性非凝胶多糖,具有较高的黏性[12]。结合其他指标变化可知,GRG在革胡子鲶鱼鱼糜中仅作为一种添加剂,能结合革胡子鲶鱼鱼糜中的部分水分,以黏稠的糊状填充在革胡子鲶鱼鱼糜凝胶网络结构中。故在革胡子鲶鱼鱼糜中添加CDG 或CGN 为较适宜的亲水胶体。
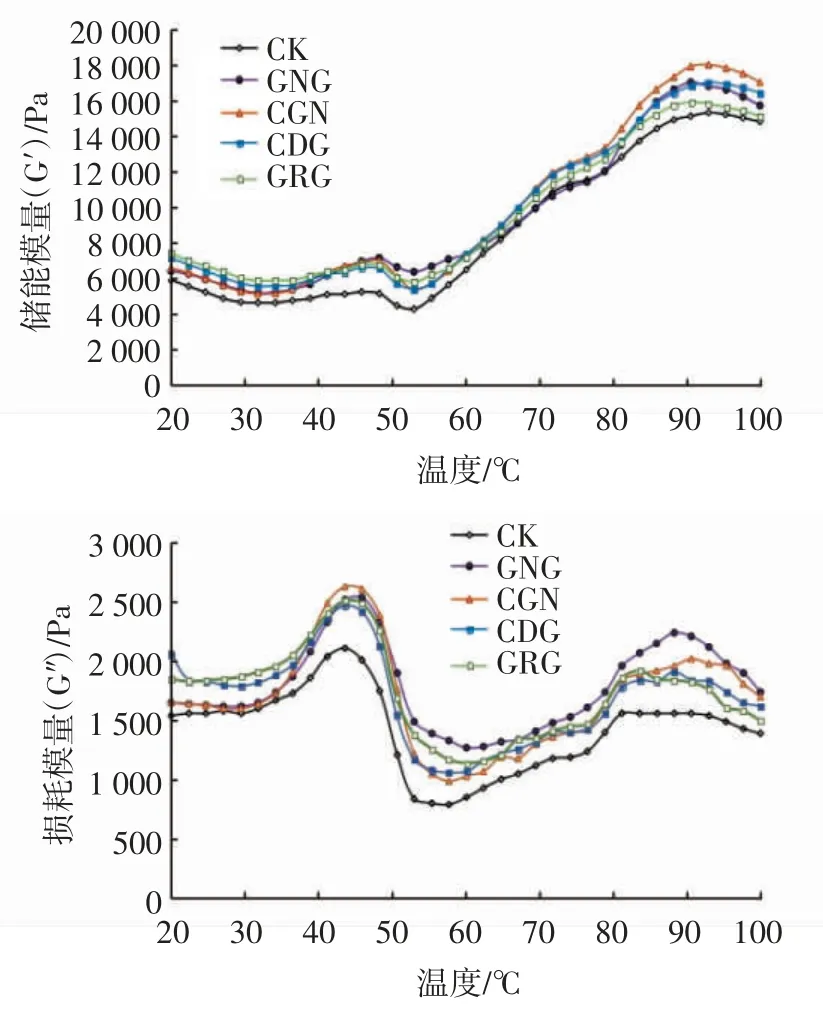
图4 亲水胶体对革胡子鲶鱼鱼糜凝胶储能模量(G′)和损耗模量(G″)的影响Fig.4 Effect of hydrophilic colloid on storage modulus(G′)and loss modulus(G″)of Catfish(Clarias gariepinus)surimi gel
3 结论
4 种亲水胶体的添加均可以不同程度地增加革胡子鲶鱼鱼糜凝胶的持水性和白度值,其中添加0.2%CDG 能显著增强革胡子鲶鱼鱼糜的凝胶特性(P<0.05),其持水性(95.77%)、破断力(500.80 g)、破断距离(8.46 mm)和凝胶强度(4 335.69 g·mm)均为各处理间最大值;而添加0.2%GNG 和0.2%GRG却会降低革胡子鲶鱼鱼糜的凝胶特性;0.2% GNG、0.2%CGN 和0.2%CDG 的添加均有利于促进革胡子鲶鱼鱼糜凝胶中T22向T21迁移(P21增加),使革胡子鲶鱼鱼糜中水的自由度降低;动态流变学结果表明,4种亲水胶体的添加均可以不同程度地增加革胡子鲶鱼鱼糜的G′和G″,在30~50℃温度变化期间,4 种亲水胶体组之间的G′和G″变化曲线几乎处于重叠状态,但明显高于 CK 组(P<0.05),在80~100 ℃时,4种亲水胶体对G′的影响由大到小的顺序依次为:CGN>CDG>GNG>GRG>CK,对G″的影响由大到小的顺序依次为:GNG>CGN>CDG>GRG>CK。综上所述,在革胡子鲶鱼鱼糜中添加0.2%CDG,可使革胡子鲶鱼鱼糜凝胶的持水性、白度、凝胶强度、P21、G′和G″等均处于相对较高的范围值,可显著改善革胡子鲶鱼鱼糜的凝胶特性,这一结果对于生产新的高品质鱼糜制品具有重要的意义。

