采后核黄素处理对苹果青霉病及活性氧和苯丙烷代谢的影响
蒋超男 ,李灿婴 ,李伊涵 ,寇程程 ,葛永红 ,*
(1.渤海大学食品科学与工程学院,辽宁 锦州 121013;2.生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
苹果(Malus domestica Borkh)属蔷薇科苹果属,是世界四大水果之一,在我国具有悠久的栽培历史,苹果种类繁多,富含多种抗氧化物质,营养价值很高[1]。随着我国苹果栽培面积和产量的大幅度增长,加上冷链系统的缺乏,采后腐烂损失也越来越大[2]。其中,由扩展青霉(Penicillium expansum)侵染引起的青霉病不仅严重影响果实的外观和品质,其次级代谢产物展青霉素还会对人体健康造成危害[3]。化学杀菌剂是控制果实采后病害的传统有效方法,但长期使用会诱导病原微生物产生抗药性,同时会造成环境污染及果实中的残留,从而使其应用逐渐受到限制[4]。因此,采用安全、有效、绿色的诱抗剂处理激发果实的自身抗性成为了新的控制技术之一[5]。
核黄素(Riboflavin)是一种水溶性B 族维生素(VB2),在人体内与多种蛋白质结合形成黄素蛋白,参与机体的能量代谢和多种生物氧化反应[6]。核黄素对热稳定,可促进作物生长和提高产量、增强作物抗逆能力以及诱导果实抗病性[7]。核黄素处理不仅能提高番茄[8]、烟草[9]、水稻[10]等植物的抗病性,还能够诱导厚皮甜瓜、葡萄、梨、杨梅等果实的采后抗病性[11-14]。采后核黄素处理可诱导厚皮甜瓜果实苯丙烷代谢途径增强,提高相关酶活性并促进抗性物质的积累,从而强化细胞壁结构抵抗病原物的侵染[12]。Boubakri等[13]研究发现,采后核黄素处理葡萄可诱导过氧化氢的产生。Li 等[14]研究发现,核黄素对梨黑斑病的抑制与其对病原菌的直接作用及对果实活性氧和苯丙烷代谢途径的诱导有关。但是有关采后核黄素处理对苹果侵染性病害控制及其机制的研究还鲜见报道。
本研究以苹果为试材,研究采后不同浓度核黄素处理对苹果果实青霉病的抑制效果,同时探讨其对果实活性氧及苯丙烷代谢关键酶活性和产物积累的影响,以期为核黄素在果蔬贮藏保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“金冠”苹果果实采自锦州市苹果园,选取大小、果色和成熟度一致、无病虫害、无机械损伤的果实,纸箱包装后运回实验室进行处理。P.expansum 分离自自然发病的苹果果实,分离纯化并鉴定后于马铃薯葡萄糖琼脂(PDA)培养基上保存于采后贮藏保鲜实验室。妙洁保鲜膜:材质为聚乙烯,厚度为0.02 mm。
核黄素,山东西亚化学工业有限公司产品;交联聚乙烯吡咯烷酮(PVPP),天津博迪化工股份有限公司产品;苯丙氨酸,天津市大茂化学试剂厂产品;β-巯基乙醇、愈创木酚,天津市科密欧化学试剂有限公司产品;聚乙二醇,天津市福晨化学试剂厂产品。乙二胺四乙酸(EDTA)、四氯化钛、二硫苏糖醇、抗坏血酸、氧化型谷胱甘肽、还原性辅酶Ⅱ(NADPH),索莱宝科技有限公司产品。
1.1.2 仪器与设备
Centrifuge 5424R 型冷冻离心机,德国艾本德公司;UV-1801 型紫外分光光度计,北京北分瑞利分析仪器(集团)有限公司;A 11 型研磨机,德国IKA 集团。
1.2 方法
1.2.1 处理方法
苹果用自来水清洗干净,挑选无机械伤、无病虫害,大小和果色一致的果实,然后将果实分别在核黄素溶液(0、0.5、1.0、1.5、2.0 mmol/L(含 0.01%吐温20))中浸泡处理10 min,晾干后在相对湿度(RH)55%±5%,温度(22±1)℃条件下贮藏待用,每处理用果实30 个。
1.2.2 孢子悬浮液的配制
参照邓惠文等[15]方法,调整P. expansum 孢子悬浮液使其终浓度为1×105个孢子/mL。
1.2.3 损伤接种
参照Bi 等[16]方法并修改。先用75%乙醇对处理后2 h 的果实表面进行消毒,然后在每个果实中部等距离刺4 mm×3 mm 孔4 个,晾干后接种10 μL P.expansum 孢子悬浮液。自然干燥后装入纸箱并覆盖聚乙烯薄膜在RH 55%±5%、(22±1)℃条件下贮藏,接种后第3 天观察果实发病率,准确测定病斑直径。根据果实接种病斑直径大小筛选出核黄素处理最佳浓度,用于后续试验。
1.2.4 取样
参照Bi 等[16]方法并修改。采用上述方法分别用0、1.0 mmol/L 的核黄素溶液浸泡处理苹果果实90个,在处理后 0、2、4、6、8、10、12 d 取苹果果肉组织(果实中部皮下3~8 mm 处),用液氮迅速冷冻,然后置于-80 ℃冰箱保存待用。
1.2.5 活性氧和苯丙烷代谢途径相关指标的测定
1.2.5.1 过氧化氢(H2O2)含量
参照Prochazkova 等[17]的方法并修改。准确称取冷冻果肉组织3.0 g,用液氮研磨成粉状后加入3.0 mL丙酮继续研磨成匀浆,然后转入5 mL 离心管低温离心15 min(9 000 r/min),收集上清液。取上清液2.0 mL,加入50 μL 浓氨水和40 μL 20%四氯化钛溶液,静置5 min,待充分反应后同等条件下再次离心10 min,用冷丙酮洗涤沉淀物3 次,再将沉淀物溶解于3.0 mL硫酸溶液(1.0 mol/L),在波长410 nm 处测定混合液的吸光值。采用同样的方法制作H2O2标准曲线,以nmol H2O2/g FW(鲜重)表示H2O2含量。
1.2.5.2 过氧化氢酶(CAT)活性
参照Wang 等[18]的方法并修改。准确称取2.0 g 冷冻苹果果肉组织,用液氮研磨成粉状后加入2.0 mL 0.1mol/L 磷酸缓冲液(pH7.5,15.0g/LPVPP 和 5.0mmol/L二硫苏糖醇)继续研成匀浆,转入5 mL 离心管然后在9 000 r/min 条件下(4 ℃)离心 20 min。反应体系包括3.0 mL H2O2(10 mmol/L)和0.1 mL 粗酶液,反应完成后测定240 nm 处吸光值。以每分钟吸光度变化0.01为1 U,用U/g FW 表示CAT 活性。
1.2.5.3 抗坏血酸过氧化物酶(APX)活性
参照Ren 等[19]的方法并修改。取冷冻苹果果肉组织3.0 g,冰浴条件下加入3.0 mL 含1.0 mmol/L 乙二胺四乙酸(EDTA)的磷酸缓冲液(0.1 mol/L,pH 7.5)研成匀浆,然后转入5 mL 离心管低温离心20 min(9 000 r/min),留上清液备用。取0.2 mL 粗酶液,加入0.5 mmol/L H2O20.5 mL、3.0 mmol/L 抗坏血酸 0.8 mL、0.1 mol/L 磷酸缓冲液2.0 mL。充分反应后测定混合液在290 nm 处的吸光值。用每分钟OD 值变化0.01为1 U,APX 活性表示为U/g FW。
1.2.5.4 谷胱甘肽还原酶(GR)活性
参照Ren 等[19]的方法并修改。冰浴下取0.1 mol/L pH 7.5 含1.0 mmol/L EDTA 预冷的磷酸缓冲液4.0 mL加入3.0 g 冷冻苹果果肉组织后充分研磨成匀浆,然后离心 20 min 得到上清液(9 000 r/min,4 ℃)。取0.2 mL 粗酶液,加入50 mmol/L 氧化型谷胱甘肽(GSSG)100 μL、pH 7.5 的 0.1 mol/L 磷酸缓冲液 3.0 mL、0.03 mol/L 还原性辅酶Ⅱ(NADPH)30 μL,反应 15 s后连续测定2 min 在340 nm 处的吸光度值。以每分钟OD 值变化0.01 为1 U,GR 活性表示为U/g FW。
1.2.5.5 苯丙氨酸解氨酶(PAL)活性
参考Assis 等[20]的方法并修改。冰浴条件下用3.0 mL、0.1 mol/L 硼酸缓冲液(pH 8.8,内含 10.0 g/L PVPP,50 mmol/L β-巯基乙醇和 1.0 mmol/L EDTA)充分研磨2.0g 冷冻果肉组织。离心匀浆12min(11000r/min,4 ℃)得上清液。取 500 μL 粗酶液,加入 3 mL 蒸馏水和0.5 mL 0.02 mol/L 苯丙氨酸充分反应后,测定290 nm 处吸光度值。同样反应体系于30 ℃水浴保温条件下反应30 min,然后再次测定290 nm 处吸光度值。PAL 活性表示为U/g FW,U 表示每小时吸光度变化0.01。
1.2.5.6 过氧化物酶(POD)活性
参考葛永红等[21]的方法测定。以每分钟OD 值变化0.01 为1 U,POD 的活性表示为U/g FW。
1.2.5.7 总酚、类黄酮和木质素含量
参考Ge 等[22]的方法测定。总酚和类黄酮含量分别用OD280/g FW 和OD325/g FW 表示,木质素含量用OD280/g FW 表示。
1.2.6 数据处理
所有指标测定进行3 次生物学重复,全部数据平均值及标准误差用Microsoft Excel 2007 计算并作图,采用SPSS 20.0 软件进行统计分析。
2 结果与分析
2.1 核黄素处理对损伤接种苹果果实病斑直径的影响
由图1 可知,接种P.expansum 后第3 天,对照和核黄素处理果实全部发病,且不同浓度核黄素处理均显著降低了果实病斑直径,但并未表现出浓度依赖性,其中以1.0 mmol/L 核黄素处理苹果果实的病斑直径最小。因此,选择1.0 mmol/L 核黄素处理果实用于后续生理生化指标分析。

图1 采后不同浓度核黄素处理对损伤接种P.expansum 苹果果实病斑直径的影响Fig.1 Effects of postharvest riboflavin treatments with different concentrations on lesion diameter of apple fruits inoculated with P.expansum
2.2 核黄素处理对苹果果实H2O2 含量的影响
H2O2含量增加可直接抵御病原物的侵染,也可作为信号分子触发果实防御反应,增强果实抗病性。由图2 可见,对照和核黄素处理苹果果实中H2O2含量贮藏0~12 d 呈先升高后下降的趋势,二者均在4 d和8 d 出现峰值,但对照果实H2O2含量在贮藏2~10 d显著低于核黄素处理果实(P<0.05),且二者H2O2的含量在贮藏第8 天差异最大,核黄素处理果实H2O2含量为对照果实的1.17 倍。
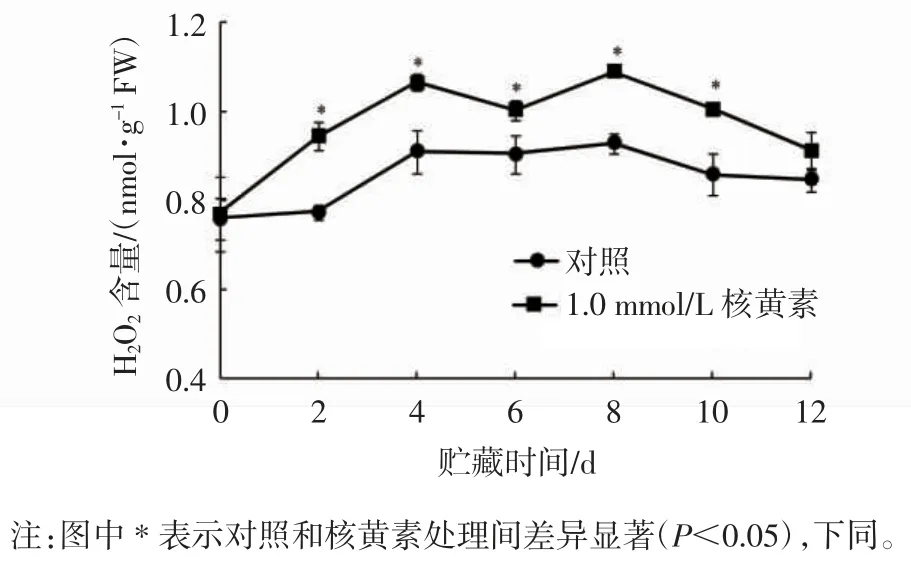
图2 采后核黄素处理对苹果果实H2O2 含量的影响Fig.2 Effects of postharvest riboflavin treatment on H2O2 contents in apple fruits
2.3 核黄素处理对苹果果实CAT 活性的影响
CAT 能够分解 H2O2为 H2O 和 O2,有效降低过量积累的H2O2对细胞的伤害。由图3 可知,贮藏0~8 d对照苹果果实CAT 活性变化不大,贮藏8~12 d 略有下降,而在贮藏0~12 d 核黄素处理果实CAT 活性呈双峰变化趋势,且在贮藏2~12 d 核黄素处理果实CAT 活性显著高于对照(P<0.05)。

图3 采后核黄素处理对苹果果实CAT 活性的影响Fig.3 Effects of postharvest riboflavin treatment on CAT activities in apple fruits
2.4 核黄素处理对苹果果实APX 活性的影响
APX 主要通过抗坏血酸-谷胱甘肽(AsA-GSH)循环清除贮藏后期大量产生的H2O2,以此降低H2O2对寄主细胞的伤害。由图4 可见,核黄素处理和对照苹果果实APX 活性在贮藏0~12 d 整体呈先上升后下降的趋势,核黄素处理果实APX 活性在贮藏第6 天出现峰值,而对照峰值在第8 天出现,且核黄素处理果实中APX 活性在贮藏4~12 d 显著高于对照(P<0.05)。

图4 采后核黄素处理对苹果果实APX 活性的影响Fig.4 Effects of postharvest riboflavin treatment on APX activities in apple fruits
2.5 核黄素处理对苹果果实GR 活性的影响
GR 活性的增强有利于维持AsA-GSH 循环中GSH 的平衡,从而维持寄主体内的活性氧代谢平衡。由图5 可以看出,核黄素处理苹果果实GR 活性在贮藏0~12 d 呈现出较为明显的双峰变化趋势,但对照果实仅出现一个活性高峰,核黄素处理果实GR 活性在贮藏第2 天和8~12 d 显著高于对照(P<0.05)。核黄素处理和对照果实GR 活性差异最大值出现在贮藏第10 天,核黄素处理果实GR 活性为对照果实的1.50 倍。

图5 采后核黄素处理对苹果果实GR 活性的影响Fig.5 Effects of postharvest riboflavin treatment on GR activities in apple fruits
2.6 核黄素处理对苹果果实PAL 和POD 活性的影响
果实抗病能力的强弱与PAL 和POD 活性高低有紧密联系,PAL 和POD 能够调控类黄酮、酚类、木质素等一些植物抗菌性物质的积累。如图6 所示,核黄素处理和对照苹果果实PAL 和POD 活性贮藏0~12 d 整体呈先上升后下降的变化趋势。贮藏4~10 d核黄素处理果实PAL 活性显著高于对照(P<0.05),且在贮藏第4 天二者PAL 活性均出现峰值,核黄素处理为对照的1.24 倍。贮藏第8 天核黄素处理果实POD 活性出现高峰,而对照果实POD 活性高峰在贮藏第10 天出现,在贮藏第2 天和6~12 d 核黄素处理POD 活性显著高于对照果实(P<0.05)。
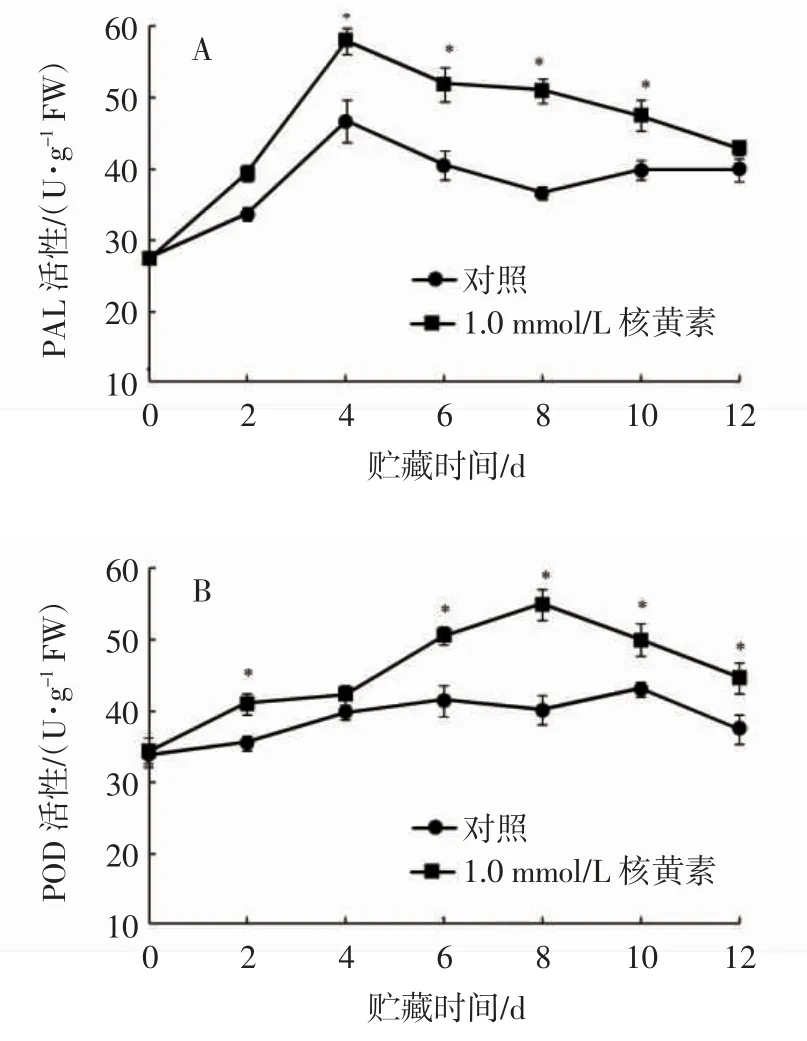
图6 采后核黄素处理对苹果果实PAL(A)和POD(B)活性的影响Fig.6 Effects of postharvest riboflavin treatment on PAL(A)and POD(B)activities in apple fruits
2.7 核黄素处理对苹果果实总酚、类黄酮和木质素含量的影响
酚类物质和类黄酮具有直接的抑菌作用,而木质素含量的提升能有效增强细胞壁厚度进而提高抵抗病原物的能力。由图7A 可见,核黄素处理和对照苹果果实中总酚含量在贮藏0~12 d 整体呈先升高后缓慢降低趋势,核黄素处理果实总酚含量在贮藏6~12 d显著高于对照果实(P<0.05),二者总酚含量均在贮藏第8 天达到最高,此时核黄素处理果实总酚含量是对照果实的1.19 倍。由图7B 可见,核黄素处理和对照苹果果实类黄酮含量变化趋势与总酚含量变化趋势相类似,核黄素处理果实类黄酮含量贮藏6~12 d显著高于对照(P<0.05),分别是对照果实的1.32、1.38、1.50 和1.44 倍。由图7C 可见,对照苹果果实木质素含量在贮藏期间整体变化不大,但核黄素处理果实木质素含量在贮藏2~12 d 显著高于对照(P<0.05),且在贮藏第8天出现峰值,是对照果实的1.34 倍。
3 讨论与结论

图7 采后核黄素处理对苹果果实总酚(A)、类黄酮(B)和木质素(C)含量的影响Fig.7 Effects of postharvest riboflavin treatment on the contents of total phenols(A),flavonoids(B)and lignins(C)in apple fruits
本研究发现,0.5、1.0、1.5、2.0 mmol/L 核黄素处理能够有效抑制损伤接种P. expansum 苹果果实病斑扩展,但并未表现出明显的浓度依赖性,其中以1.0 mmol/L 核黄素处理的苹果果实抑制效果最为明显,说明核黄素处理抑制病斑直径不是浓度依赖性,而是达到一定浓度可有效增强果实抗病性。李灿婴等[12]研究发现,核黄素处理可增强厚皮甜瓜果实对粉霉病和黑斑病的抗性,并且未表现出浓度依赖性。Li等[14]研究也发现1.0 mmol/L 核黄素处理可显著提高梨果实对黑斑病的抗性,也未表现出浓度依赖性。由此表明,用一定浓度的核黄素处理具有诱导果实抗病性的作用,更高浓度并没有明显的增强作用。
植物体内活性氧在正常生理状态下保持一种动态平衡,当受到外界病原物侵染或激发子处理时,活性氧在细胞内被迅速大量积累,从而影响细胞的成分和功能[23]。H2O2是比较稳定且具有重要功能的一种活性氧,不仅对病原生物有直接杀灭的作用,也是一种信号分子用来启动寄主多种防卫反应。本研究发现,采后1.0 mmol/L 核黄素处理显著提高了苹果果实H2O2含量。果实中H2O2的前期积累,有利于启动防卫反应,同时也参与木质素的生物合成过程。已有研究表明,核黄素处理厚皮甜瓜和梨果实均能提高果实H2O2含量,提高其抗病性[7,14]。由此说明,诱导 H2O2的积累是核黄素诱导果实产生抗病性的机理之一。然而,过量产生的H2O2会破坏细胞的结构和成分,从而导致功能紊乱。细胞通过自身的酶促或非酶促抗氧化系统维持活性氧的平衡,从而降低其对自身的损伤。本研究发现,1.0 mmol/L 核黄素处理提高了苹果果实中CAT、APX 和GR 活性。CAT 是生物体内一种关键的抗氧化酶,能够将H2O2分解为H2O 和O2[24]。APX通过AsA-GSH 循环分解H2O2,清除细胞中产生的过量H2O2[23],而GR 主要是保持AsA-GSH 循环中GSH的平衡,维持寄主体内的活性氧代谢水平[25]。Li 等[14]研究发现,采后核黄素处理诱导了梨果实中O2和H2O2的积累,且提高了CAT 活性。李灿婴等[7]在厚皮甜瓜果实中的研究也表明,采后用核黄素可诱导果实CAT、APX 和GR 活性提高,从而提高果实对粉霉病和黑斑病的抗性。由此说明,核黄素处理苹果可通过激活贮藏初期果实中H2O2的大量积累,而后期通过提高CAT 和AsA-GSH 循环中关键酶活性清除过量的H2O2,以此降低对寄主细胞的伤害。
苯丙烷代谢是植物次生代谢的主要途径,通过该途径产生的酚类、黄酮类、生物碱、木质素等在抗病性过程中具有重要作用[26]。PAL 是苯丙烷代谢途径的限速酶,能够调控主要抗菌物质的积累,因而常用作植物抗病性指标[15,27]。POD 是苯丙烷代谢途径的末端氧化酶,可通过催化酚酸类物质的聚合以及木质素的合成来加固细胞壁,从而增强对病原物侵染的抵抗能力[15]。此外,POD 可与CAT 协同作用,有效清除寄主体内可对细胞产生毒害的过量活性氧,减少对果实的伤害[28]。本研究发现,1.0 mmol/L 核黄素处理诱导了苹果果实中PAL 和POD 活性,从而促进酚类、类黄酮和木质素的积累。果实中酚类化合物有直接抑制病原微生物孢子萌发和菌丝生长的作用,也是合成具有抗性作用木质素等物质的前体。类黄酮在一定程度上限制了进入寄主体内病原微生物的扩展过程从而降低微生物活性。木质素沉积在细胞壁上可提高组织的机械强度,是构成植物细胞壁的主要成分[29]。已有研究发现,壳聚糖复合多聚赖氨酸、茉莉酸甲酯、核黄素处理分别提高了苹果[23]、厚皮甜瓜[12]、梨[14]果实 PAL 和POD 活性并增加总酚、类黄酮、木质素的含量,从而增强果实抗病性。由此说明,采后核黄素处理激活了苹果果实中苯丙烷代谢途径,提高了关键酶的活性并促进了抗菌产物的积累,从而提高果实的抗病性。
总之,采后核黄素处理对苹果果实损伤接种P. expansum 病斑直径的扩展具有显著抑制作用,并且提高了苹果果实H2O2含量以及CAT、APX 和GR活性,此外,PAL 和POD 活性升高,总酚、类黄酮和木质素含量得到积累。由此说明,核黄素处理可通过激活活性氧代谢和苯丙烷代谢途径来有效降低苹果青霉病发生。

