丹参-红花药对对心肌缺血大鼠CYP450 酶活力和mRNA 表达的影响
王小平 ,杜少兵,白吉庆,王鹏飞,王 金,胡锦萍,高 速,李 娜
(1.陕西中医药大学药学院,陕西咸阳 712046;2.陕西中药基础与新药研究重点实验室,陕西咸阳 712046)
丹参为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根和根茎,临床常用于胸痹心痛,心烦不眠,热痹疼痛,月经不调,痛经经闭等[1]。红花为菊科植物红花Carthamus tinctoriusL.的干燥花。临床常用于经闭,痛经,胸痹心痛,跌扑损伤等[2]。丹参-红花是近现代临床常用的活血化瘀药对,从中医方剂数据库和复方专利中检索出同时含有丹参-红花的方剂共2 646 首[3];2015 年版《中国药典》 一部成方制剂和《国家中成药标准汇编》 中同时含丹参-红花的方剂共30 首[4]。本研究以丹参-红花为研究对象,采用cocktail 探针药物法,以探针药物的代谢消除百分率为指标[5],评价丹参-红花临床配伍常用比例(1 ∶1、2 ∶1、3 ∶1) 对大鼠细胞色素P450 (Cytochrome P-450,CYP450)酶活性的影响,同时采用实时荧光定量PCR (RT-PCR) 测定CYP450 酶中3 种亚型mRNA 的表达水平,为丹参-红花最佳配伍比例的筛选提供数据支撑,并为探讨其协同增效的机理奠定基础。
1 材料
1.1 仪器 戴安UltiMate 3000 全自动HPLC 仪[配置四元梯度泵、自动进样器、二极管阵列检测器、变色龙6.8 色谱工作站,赛默飞世尔(上海) 仪器有限公司];Avanti JXN-26 高速冷冻离心机 (贝克曼库尔特中国分公司);ME204 双量程电子分析天平(瑞士梅特勒-托利多公司);Direct-Q 3UV 纯化水机(美国Millipore 公司);PHSJ-3F 型PH 计(上海精密仪器仪表有限公司);多管漩涡混合器(杭州瑞诚仪器有限公司);氮吹仪(上海乔跃仪器有限公司);全自动分析心电图机(深圳市科曼医疗设备有限公司);ExicyclerTM96 荧光定量PCR 仪(韩国Bioneer 公司);NanoDrop 2000 超微量紫外-可见分光光度计(美国Thermo公司)。
1.2 试剂 非那西丁(批号20151204,纯度99.2%) 购于北京索莱宝科技有限公司;氯唑沙宗 (批号100364-201302,纯度99.8%)、鬼臼毒素 (批号111645-200301,纯度98.9%) 均购于中国食品药品检定研究院;咪达唑仑(批号171250- 200401;纯度99.8%);盐酸异丙肾上腺素注射液(批号41150102) 购于上海禾丰制药有限公司;RNA提取试剂盒(批号93956420,美国罗氏生物制药有限公司);Super M-MLV 反转录酶(批号PR6502,北京百泰克生物技术有限公司);2×Power Taq PCR Master Mix 试剂(批号PR1702,北京百泰克生物技术有限公司);SYBR Green 试剂(批号SY1020,北京索莱宝科技有限公司);HyClone PBS 缓冲液(批号AAF203865,美国赛默飞世尔科技上海有限公司);RNase inhibitor (批号RP5602,北京百泰克生物技术有限公司);引物由生工生物工程(上海)有限公司合成;还原型辅酶Ⅱ(Nicotinamide adenine dinucleotide phosphate,NADPH) 四钠(批号041939) 购于罗氏公司;考马斯亮蓝(批号20160415) 购于南京建成生物工程研究所;乌来糖(批号20140421) 购于上海山浦化工有限公司。TRIS-base、磷酸二氢钾、磷酸氢二钾、蔗糖、无水氯化钙均为分析纯,购自天津市天力化学试剂有限公司;甲醇、乙腈均为色谱纯(德国Merk 公司);水为超纯水;其余试剂均为分析纯。
1.3 药物 丹参、红花均购于河北安国药材市场,经陕西中医药大学药学院白吉庆副教授鉴定,丹参为唇形科鼠尾草属丹参Salvia miltiorrhizaBge.的干燥根及根茎,红花为菊科红花属植物红花Carthamus tinctoriusL.的干燥花。参照2015 版《中国药典》 一部丹参、红花药材标准项下的内容进行检查,均符合标准。
1.4 动物 100 只SD 大鼠,SPF 级,体质量(200±10)g,由西安交通大学医学部实验动物中心提供,动物生产许可证号SCXK (陕) 2015-002。
2 方法与结果
2.1 溶液制备
2.1.1 中药提取液制备 按一定比例(3 ∶1、2 ∶1、1 ∶1)称取丹参、红花适量,加10 倍量水浸泡30 min,提取1 h,过滤,第2、3 次各加8 倍量水,每次提取1 h,滤过,滤液合并,分别减压浓缩至1、0.75、0.5 g 生药/mL,备用。
2.1.2 探针溶液、内标溶液制备 分别精密称取非那西丁和氯唑沙宗对照品适量,精密量取咪达唑仑注射液适量,加甲醇溶解,制成混合探针药物溶液(非那西丁13.74、27.48、54.96、109.92、219.84 mg/L,氯唑沙宗7.42、14.84、29.67、59.35、118.70 mg/L,咪达唑仑 3.26、6.52、13.03、26.06、52.12 mg/L),4 ℃保存备用。精密称取鬼臼毒素对照品,甲醇制成12.28 mg/L 内标溶液,备用。
2.2 动物造模 选择心电图正常的健康大鼠,试验前测定并记录Ⅱ导联心电图(纸速50 mm/s,1 mV=20 mm),腹腔注射5 mg/kg 盐酸异丙肾上腺素制备动物模型[6-10],连续给药3 d,于最后1 次给药30 min 后,用20%乌拉坦麻醉大鼠(1 g/kg) 并记录心电图。将造模前后的心电图进行比较,具备下列条件之一者说明造模成功:①ST 段向上或向下偏移超过0.1 mV;②T 波高耸且超过同导联R 波的1/2;③T 波高耸且伴有ST 段移位。
2.3 Cocktail 探针法评估丹参-红花药对对大鼠CYP450 酶活力的影响
2.3.1 分组与给药 大鼠随机分为空白对照组、模型组、丹参-红花(3 ∶1) 组、丹参-红花(2 ∶1) 组、丹参-红花(1 ∶1) 组,每组10 只,每天灌胃1 次,灌胃体积2 mL,对照组和模型组给予蒸馏水,其余各组给予“2.1.1” 项下提取液,持续给药15 d。
2.3.2 肝微粒体制备 末次给药后,用20%乌拉坦麻醉大鼠(1 g/kg),快速打开腹腔,从门静脉注射预先制冷的生理盐水至肝脏呈土黄色,取出肝脏,用预先制冷的缓冲液清洗干净,用滤纸吸干表面液体,剪碎肝脏组织,准确称取3 g,加入80.5 g/L 蔗糖溶液12 mL,匀浆。匀浆液在4 ℃、10 000 r/min 离心20 min,取上清,置于离心管中,加入10 倍量9 g/L CaCl2,混合均匀,冰浴放置,5 min后,15 000 r/min 离心15 min,弃去上清液,即得微粒体。微粒体用Tris-HCL 缓冲液洗涤,15 000 r/min 离心15 min,取沉淀用18.17 g/L Tris-HCL 缓冲液重悬,使得每1 mL 含1.1mg 肝微粒体,取出部分稀释,用于测定蛋白含有量,其余贮藏于-70 ℃用于体外孵育实验。
2.3.3 体外温孵 取上述肝微粒体的重悬液,每份100 μL,分别加入20 μL 混合探针药物溶液(非那西丁109.92 mg/L、氯唑沙宗59.35 mg/L、咪达唑仑20.06 mg/L)和30 μL PBS 缓冲液,37 ℃水浴预孵育5 min,加入NADPH 启动反应,使体系总体积为200 μL (肝微粒体终质量浓度0.6 mg/mL,NADPH 终质量浓度256.26 mg/L),37 ℃水浴孵育30 min,立即放入冰水浴中,加入4 ℃甲醇-乙腈(1 ∶1) 混合溶液600 μL 终止反应,再加20 μL 内标溶液涡旋混匀1 min,12 000 r/min 离心10 min,取上清液,室温下氮气吹干。
2.3.4 探针底物测定 测定前用200 μL 流动相复溶“2.3.3” 项下残渣,涡旋混匀1 min,0.22 μm 滤膜过滤,进样15 μL,HPLC 分析非那西丁、氯唑沙宗及咪达唑仑。按下式计算各探针底物的代谢消除率,以评价CYP1A2、CYP2E1和CYP3A2的活性。
2.3.5 探针底物测定的HPLC 条件 ZORBAX StableBond 80Å C18色谱柱(150 mm×4.6 mm,5 μm);流动相甲醇(A) -水(B),梯度洗脱(0~5 min,30%~35% A;5~10 min,35%~38% A;10~15 min,38%~46% A;15~30 min,46%~54%A;30~45 min,54%~65%A);体积流量1.0 mL/min;柱温35 ℃;检测波长235 nm;进样量15 μL。
2.3.6 探针底物HPLC 测定的方法学考察
2.3.6.1 专属性考察 取空白肝微粒体孵育体系,含探针药物和内标物的肝微粒体孵育体系和给药组肝微粒体的孵育体系,注入HPLC 仪,结果见图1。由图1 可知,3 种探针药物与内标物峰形对称性好,基线平直,探针药物、内标物分离完全,无杂质峰干扰,且空白肝微粒体孵育体系对3 种探针药物的测定无干扰。
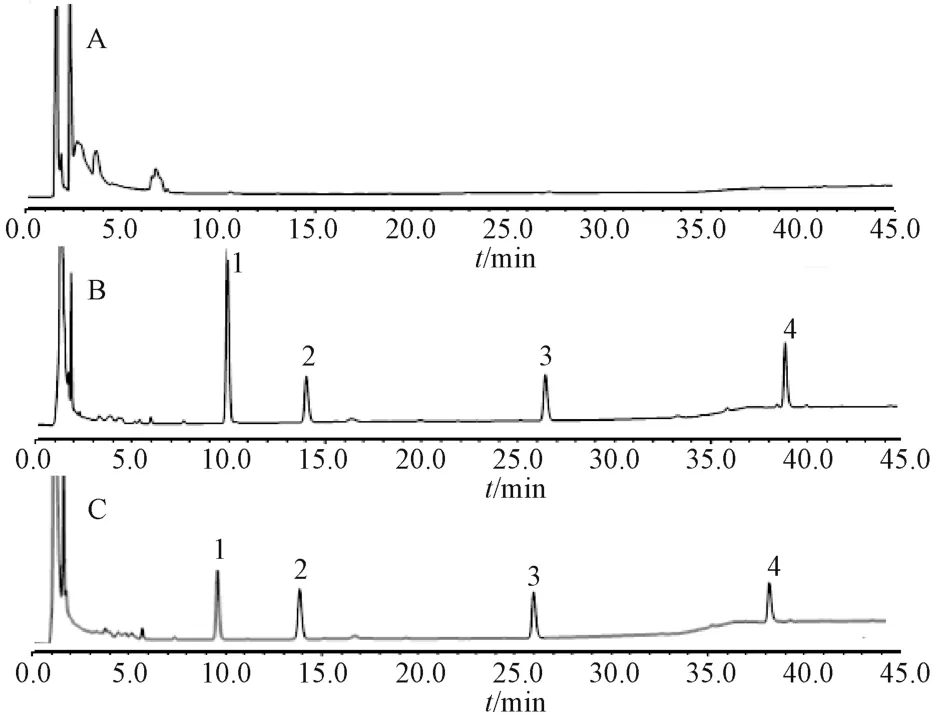
图1 大鼠肝微粒体中3 种探针药物的HPLC 色谱图
2.3.6.2 线性关系考察 取空白组的肝微粒体,精密加入适量各系列质量浓度的混合探针药物溶液,每批3 份,按“2.3.3” 项下方法体外温孵,按“2.3.4” 项下方法复溶后测定。以各探针药物和内标物的峰面积比值(Y) 为纵坐标,各探针药物的质量浓度(X) 为横坐标进行线性回归,再以探针药物峰响应信号与噪音信号比为10 时的探针药物浓度为定量限,结果见表1。
2.3.6.3 精密度试验 取空白组的肝微粒体,精密加入适量高(混标中非那西丁219.84 mg/L)、中(混标中非那西丁54.96 mg/L)、低(混标中非那西丁13.74 mg/L) 质量浓度的混合探针药物溶液,各3 份,按“2.3.3” 项下方法体外温孵,按“2.3.4” 项下方法复溶制得高、中、低质量控制(QC) 样品,每个样品1 d 内重复测定5 次,计算日内精密度;连续测定5 d,计算日间精密度。结果,非那西丁、氯唑沙宗和咪达唑仑日内、日间峰面积RSD 分别为1.85%~6.58%、1.74%~3.5%、1.67%~2.7%。
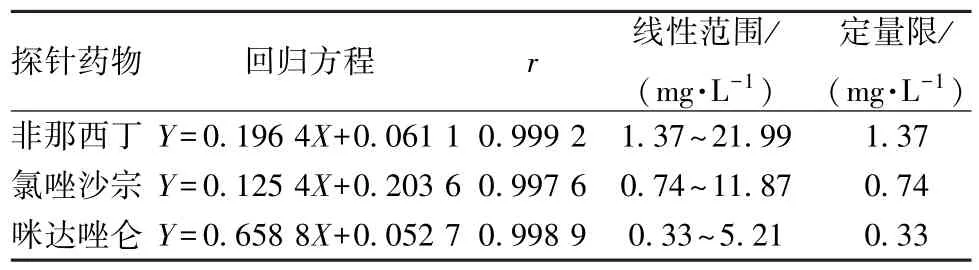
表1 3 种探针药物线性关系
2.3.6.4 稳定性试验 按“2.3.6.3” 项下方法制备高、中、低质量控制(QC) 样品,每个时间点平行3 份,氮气吹干后于4 ℃分别放置0、4、8、12、24 h,-20 ℃分别放置0、6、12、18、24、30 d,测定前按“2.3.4” 项下方法复溶,进行液相分析。结果,4 ℃下3 种探针药物峰面积RSD 均小于0.9%,-20 ℃下均小于4.9%,表明非那西丁、氯唑沙宗和咪达唑仑在4 ℃时24 h 内稳定,-20 ℃时30 d内基本稳定。
2.3.6.5 准确度试验 按“2.3.6.3” 项下方法制备高、中、低质量控制(QC) 样品,根据测定值与加入量的比值计算准确度。结果,非那西丁、氯唑沙宗、咪达唑仑的准确度分别在96.1%~100.2%、96.9%~103.2%、96.8%~99.9%之间,RSD 在1.0%~9.9%之间。
2.3.7 统计学分析 用SPSS 13.0 软件进行分析,数据以() 表示。P<0.05 表示差异有统计学意义。
2.3.8 结果 各给药组非那西丁加入1.08 mg,氯唑沙宗加入1.19 mg,咪达唑仑加入0.52 mg,不同比例丹参-红花对3 种探针药物的代谢消除率见表2。由此可知,不同比例丹参-红花药对CYP1A2、CYP2E1和CYP3A2的活性均表现显著的抑制作用(P<0.05)。
表2 不同给药组心肌缺血大鼠肝微粒体中3 种探针药物的消除率(, n=10)
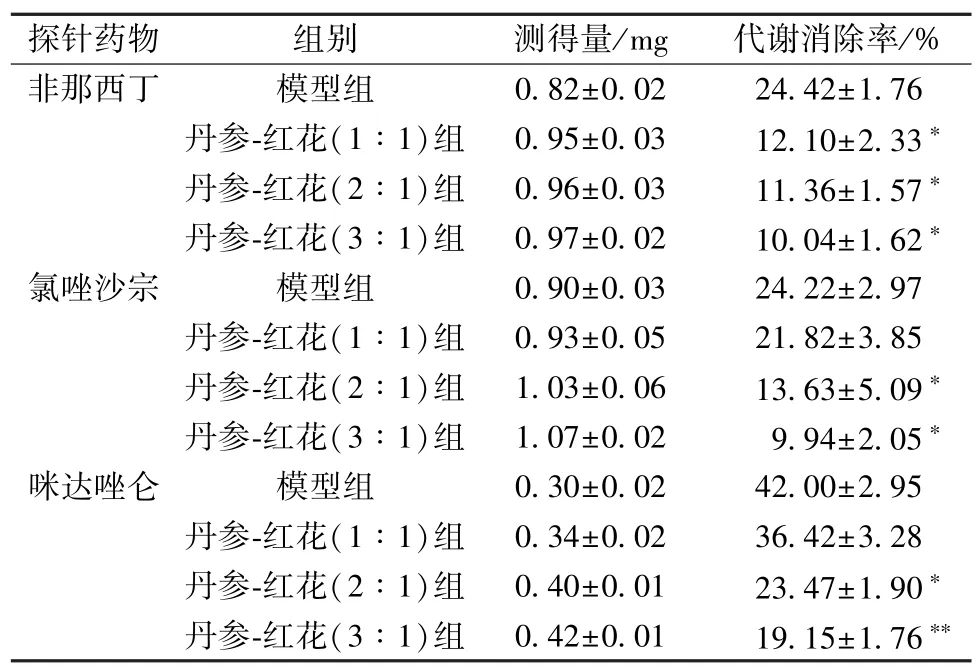
表2 不同给药组心肌缺血大鼠肝微粒体中3 种探针药物的消除率(, n=10)
注:与模型组比较*P <0.05,**P <0.01。
2.4 RT-PCR 法测定丹参-红花药对对大鼠CYP450 酶mRNA 表达的影响
2.4.1 分组与给药 SD 大鼠随机分为空白对照组、模型组、丹参-红花(3 ∶1) 组、丹参-红花(2 ∶1) 组、丹参-红花(1 ∶1) 组,每组10 只,灌胃体积2 mL,每天给药1次,对照组和模型组给予蒸馏水,其余各组给予“2.1.1”项下提取液,持续15 d。末次给药后,20%乌拉坦(1 g/kg)麻醉大鼠,迅速取出肝脏组织,-80 ℃保存。
2.4.2 RNA 提取与浓度测定 按RNA 提取试剂盒说明书提取肝脏总RNA,并于260、280 nm 波长处测定吸光度OD260、OD280,两者比值介于1.8~2.0 之间时,提取的RNA 纯度视为合格。
2.4.3 引物设计及特异性验证考察 基因β-actin、CYP1A2、CYP2E1和CYP3A2的引物由生工生物工程(上海) 有限公司合成,引物序列信息和扩增产物长度见表3。

表3 大鼠CYP450 酶引物序列
随机选择样本进行RT-PCR 反应,结果β-actin、CYP1A2、CYP2E1和CYP3A2基因RT-PCR 扩增产物的融解曲线都为单一的特异峰,说明RT-PCR 中的荧光均为目的基因cDNA 扩增双链DNA 发出的荧光,即引物特异性好,可进行后续的定量测定。见图2~4。
图2 CYP1A2 基因RT-PCR 扩增产物的融解曲线

图3 CYP2E1 基因RT-PCR 扩增产物的融解曲线
图4 CYP3A2 基因RT-PCR 扩增产物的融解曲线
2.4.4 RT-PCR 测定 将大鼠肝组织提取的总RNA 反转录合成cDNA,按下述体系进行RT-PCR 反应:cDNA 模板1 μL,10 μmol/L 正、反向引物各0.50 μL,SYBR GREEN(稀释至20×) 0.3 μL,2×Power Taq PCR MasterMix 10 μL,用超纯水H2O 补足至20 μL。RT-PCR 反应程序为94 ℃预变性5 min,94 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,循环40 次。用RT-PCR 仪自带软件进行荧光定量分析,得出Ct,2-ΔΔCt法计算mRNA 的表达量。结果见表4。
表4 大鼠肝脏CYP450 酶3 种亚型mRNA 表达(,n=10)
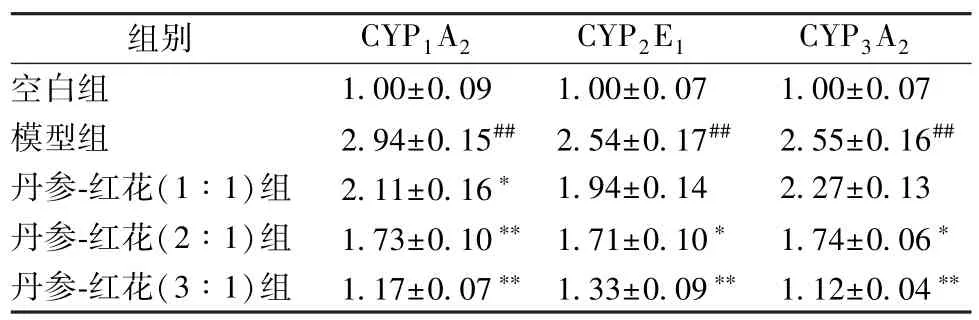
表4 大鼠肝脏CYP450 酶3 种亚型mRNA 表达(,n=10)
注:与空白组比较,##P <0.01;与模型组比较,* P <0.05,**P<0.01。
由表4 可以看出,与空白组比较,模型大鼠肝脏组织中P450 酶3 种亚型的mRNA 的表达增加(P<0.01);与模型组比较,丹参-红花不同比例均能够抑制模型大鼠肝组织中P450 酶3 种亚型mRNA 表达,其抑制程度与丹参的剂量呈依赖性。其中,丹参-红花(3 ∶1、2 ∶1) 组能显著抑制模型大鼠CYP1A2、CYP2E1和CYP3A2mRNA 表达,丹参-红花(1 ∶1) 组能显著抑制模型大鼠CYP1A2mRNA 表达(P<0.05),同时对CYP2E1和CYP3A2也具有抑制作用,但与模型组比较,差异无统计学意义(P>0.05)。
3 讨论
丹参、红花配伍比单独使用丹参、红花具有更好的药理作用[5,11]。肝微粒体CYP450 是口服药物进入体内代谢的主要途径,CYP1、CYP2和CYP3是参与药物代谢的主要家族[13]。研究表明,不同病理生理因素可调节CYP450 同工酶的活性[14-16]。因此,本实验采用急性心肌缺血模型大鼠研究丹参-红花配伍对心肌缺血大鼠CYP450 酶活力及其mRNA 表达的影响,结果与文献报道一致[12]。
目前已知的CYP1A2特异性代谢的药物有非那西丁、咖啡因等[17-18],咖啡因不易获得,非那西丁价廉易得;CYP2E1特异性代谢的药物有氯唑沙宗、对位硝基酚和N-亚硝基双甲胺[19-20],氯唑沙宗90%经CYP2E1代谢生成6-羟基氯唑沙宗;咪达唑仑是人体CYP3A4特异性代谢药物,CYP3A4是人体特有的,人体CYP3A4与大鼠体内的CYP3A2相当[17,21]。因此,本研究选用非那西丁、氯唑沙宗和咪达唑仑为探针底物。
在含丹参、红花的中药复方中,两者比例1 ∶1者占20.8%,2 ∶1 者占45.8%,3 ∶1 者占31.2%[22-23],因此,本研究选用1 ∶1、2 ∶1、3 ∶1。结果表明,3 ∶1 时对酶的抑制作用更显著,这与药效学研究结果[22]和临床使用比例相吻合,推测该药对协同增效机理可能与上述酶的活性有关。
当丹参、红花配伍比例为3 ∶1、2 ∶1 时,由于对CYP1A2、CYP2E1、CYP3A2活性有显著的抑制作用,导致上述3 种酶对其特异性代谢药物的代谢减慢。因此,在临床上CYP1A2、CYP2E1、CYP3A4的特异性代谢药物与丹参、红花(3 ∶1、2 ∶1) 联合用药时,建议应适当调整三者使用剂量。