桔梗多糖对桔梗皂苷D 在体肠吸收的影响
陈青青,任蓉蓉,张青青,杨 晔,2,3,4*
(1.安徽中医药大学药学院,安徽 合肥 230012;2.新安医学教育部重点实验室,安徽 合肥 230012;3.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012;4.中药复方安徽省重点实验室,安徽合肥 230012)
桔梗或以其为主药的方剂在临床上常用于治疗慢性支气管炎等呼吸系统疾病[1],主要活性成分为桔梗皂苷D,也是药材及制剂质量控制的指标物质。但该成分脂溶性差,口服后难以透过肠细胞膜吸收入血[2]。
肠道是药物口服吸收利用的主要场所,小分子可被其直接吸收,而某些物质则需要通过特定通道或受体才能被人体吸收,其中细胞旁路转运是桔梗皂苷D 透过肠黏膜吸收的主要途径[3]。紧密连接是细胞旁路物质转运途径的“看门人”,具有选择性渗透作用;闭锁蛋白、闭合蛋白、闭合小环蛋白等是构成紧密连接结构的主要部分,其表达水平和分布可影响紧密连接的开放或闭合,改变细胞单层通透性,影响药物细胞旁路途径被动转运[4]。
中医临床上,桔梗大多通过汤剂形式给药,并以水为溶剂,在煎煮过程中能将药物有效成分充分溶入汤液,吸收快,生物利用度高[5]。现代研究将汤剂的良好疗效大多归因于配伍药物的相互促进吸收,但同一提取物中各成分之间也可能会相互影响[6]。因此,本实验通过在体肠灌注模型研究桔梗中含量较高的多糖对桔梗皂苷D 在体肠吸收特性的影响,并对紧密连接表达水平作出评价,以期阐明中药汤剂活性成分肠吸收的作用机制。
1 材料
1.1 试剂与药物 桔梗多糖(批号DST191105-178,纯 度 ≥98%)、桔梗皂苷D (批号DST191103-015,纯度≥98%) 对照品(成都德思特生物技术有限公司)。Claudin-1 兔抗鼠多克隆抗体(武汉华美生物工程有限公司);Occludin、ZO-1 兔抗鼠多克隆抗体(北京博奥森生物技术有限公司);Cy3-山羊抗兔IgG (美国Abbkine 公司);DAPI (上海碧云天生物技术有限公司)。乙腈、甲醇为色谱纯(瑞典Oceanpak 公司);其余试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 仪器 HL-2 型恒流泵(嘉鹏科技有限公司);HH-S2 型恒温水浴锅(江苏金坛市环宇科学仪器厂);TG16-WS 型台式高速离心机(长沙湘仪离心机仪器有限公司);DM2000 型荧光显微镜(德国Leica 公司);LC-20AOXR 型液相色谱仪(日本岛津公司);Milli-Q 型超纯水系统(美国Millipore公司)。
1.3 动物 雄性SD 大鼠,体质量(200±20) g,购于安徽医科大学实验动物中心,动物生产许可证号SCXK (皖) 2017-001。实验开始前,大鼠适应性饲养1 周。
2 方法
2.1 溶液制备
2.1.1 人工肠液Kreb-Ringer 试剂(K-R 液)称取NaCl 8 g、KCl 0.28 g、NaHCO31 g、NaH2PO40.05 g、MgCl20.1 g,溶于500 mL 超纯水中,作为A 液;称取CaCl20.2 g、葡萄糖1 g,溶于500 mL超纯水中,作为B 液,密封冷藏,用时将A、B 液等比例混合,即得。
2.1.2 空白肠灌流液 将K-R 液置于37 ℃水浴锅中孵育至恒温,进行大鼠在体肠循环实验,收集循环液,即得。
2.1.3 肠灌流液 精密称取适量桔梗皂苷D 对照品,K-R 液溶解定容至20 μg/mL,作为对照组肠灌流液;精密称取3 种质量的桔梗多糖,溶于对照组肠灌流液中,分别调节其质量浓度至1、2、4 mg/mL,作为低、中、高剂量多糖组肠灌流液。
2.2 方法学考察
2.2.1 色谱条件 Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-水(25 ∶75);体积流量1.0 mL/min;柱温30 ℃;检测波长206 nm;进样量20 μL。
2.2.2 样品处理 取肠灌流液2 mL,12 000 r/min离心5 min,上清液经0.45 μm 微孔滤膜过滤,滤液在“2.2.1” 项色谱条件下进样测定。
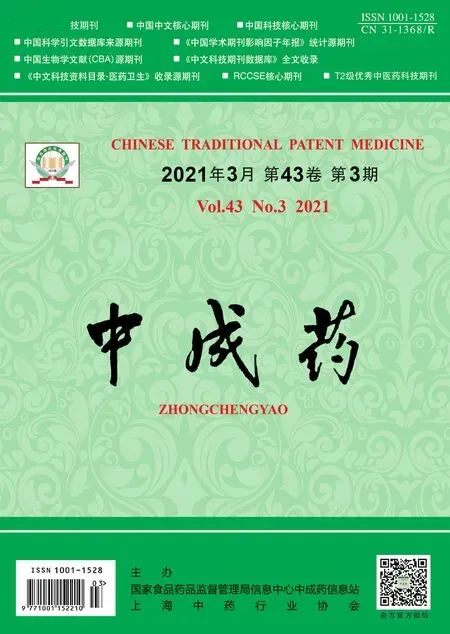
2.2.3 专属性试验 取空白肠灌流液、对照组肠灌流液、中剂量多糖组肠灌流液,按“2.2.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定,结果见图1。由此可知,桔梗皂苷D 保留时间约为11.8 min,空白灌流液、桔梗多糖均不干扰测定(分离度大于1.5),表明该方法专属性良好。
2.2.4 线性关系考察 精密称取桔梗皂苷D 对照品适量,空白肠灌流液溶解并定容至100 μg/mL,再依次稀释至50、30、25、20、15、10 μg/mL,按“2.2.2” 项下方法处理,取上清液,在“2.2.1”项色谱条件下进样测定。以峰面积为纵坐标(Y),桔梗皂苷D 质量浓度为横坐标(X) 进行回归,得方程为Y=2 724.6X-24 531(R2=0.999 0),在10~50 μg/mL范围内线性关系良好。
2.2.5 重复性试验 空白肠灌流液配制低、中、高质量浓度(15、30、45 μg/mL) 对照品溶液,每个质量浓度平行3 份,按“2.2.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定,测得桔梗皂苷D 峰面积RSD 分别为0.45%、0.82%、0.60%,表明该方法重复性良好。
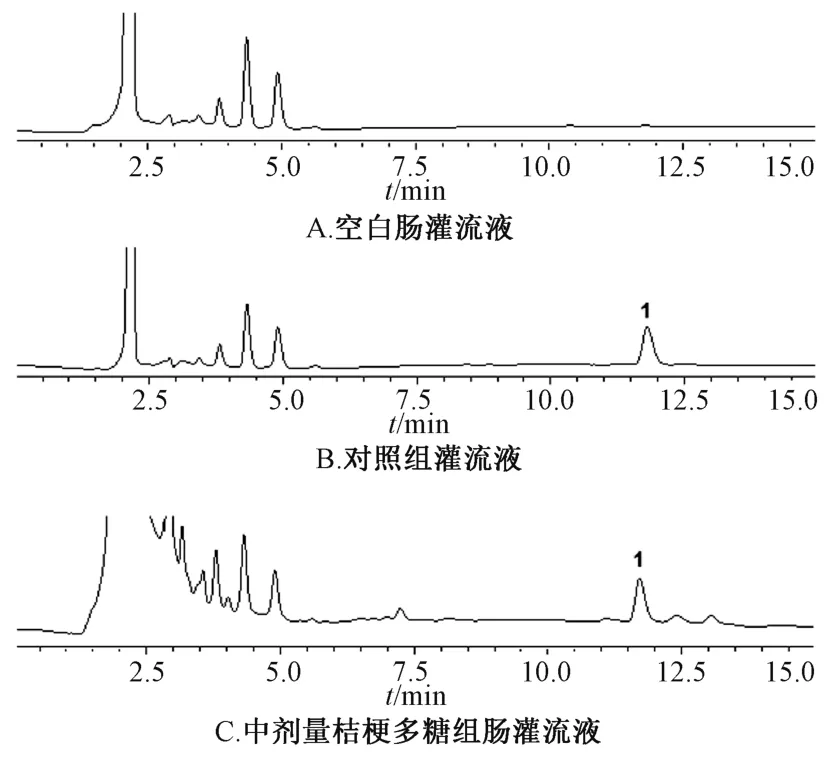
图1 桔梗皂苷D HPLC 色谱图Fig.1 HPLC chromatograms of platycodin D
2.2.6 精密度试验 空白肠灌流液配制低、中、高质量浓度(15、30、45 μg/mL) 对照品溶液,按“2.2.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定,同一天内重复6 次,测得日内精密度RSD 分别为2.18%、1.96%、0.53%;每天1 次,连续3 d,测得日间精密度RSD 分别为2.99%、1.81%、0.65%,表明该方法精密度良好。
2.2.7 稳定性试验 空白肠灌流液配制低、中、高质量浓度(15、30、45 μg/mL) 对照品溶液,每个质量浓度平行3 份,置于37 ℃恒温水浴锅中,于0、2 h 取样,再于室温下6、12、24 h 取样,按“2.2.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定,测得桔梗皂苷D 峰面积RSD 分别为3.45%、1.36%、0.68%,表明桔梗皂苷D 在37 ℃水浴、室温下稳定性良好,符合生物样品测定要求。
2.2.8 加样回收率试验 空白肠灌流液配制低、中、高质量浓度(15、30、45 μg/mL) 对照品溶液,每个质量浓度平行3 份,按“2.2.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定,以测得质量浓度与实际质量浓度之比为回收率。结果,低、中、高质量浓度下桔梗皂苷D 加样回收率分别为(102.50±3.48)%、(100.13±2.36)%、(100.34 ± 3.48)%,RSD 分别为 3.39%、2.36%、3.47%。
2.3 在体肠吸收实验 参考文献[7-8] 报道。
2.3.1 造模 大鼠随机分为对照组及桔梗多糖低、中、高剂量组,每组5 只。实验前大鼠禁食12 h,自由饮水,腹腔注射20%乌拉坦(5 mL/kg) 麻醉后固定,沿腹中线剪开腹腔,选取10 cm 左右肠段,两端切口,插管结扎,用浸有生理盐水的纱布将伤口覆盖保湿(其间不停地滴加预热至37 ℃的生理盐水),红外灯照射取暖以维持体温,用预热至37 ℃的生理盐水排净肠内容物后,换成K-R 液平衡肠道内环境15 min,排空气法将肠内液体全部排出,加入25 mL “2.1” 项下肠灌流液进行在体肠循环灌注,体积流量0.2 mL/min。当灌流液充满整个循环通路时,记为初始时刻,此时取灌流液1 mL 并补加相同体积空白K-R 液,循环90 min 后排净管路液体,读取剩余灌流液体积并取样。灌流结束后处死大鼠,剪下灌流肠段,手术丝线附着法测定其内径和长度,并置于中性福尔马林溶液中固定,对组织进行石蜡包埋、切片。
2.3.2 肠吸收参数计算

2.4 免疫荧光染色检测紧密连接蛋白表达 参考文献[10] 报道。肠组织石蜡切片常规脱蜡后梯度乙醇脱水,PBS 缓冲液漂洗,95 ℃10 mmol/L枸橼酸钠溶液中修复20 min,冷却至室温,室温下过氧化物酶阻断剂孵育10 min,PBS 缓冲液漂洗,37 ℃下山羊血清孵育20 min,倾去血清(无需洗涤),滴加兔抗Claudin-1、Occludin、ZO-1 抗 体(均按1 ∶200 比例稀释),4 ℃下孵育过夜,PBST缓冲液漂洗,滴加二抗Cy3-山羊抗兔IgG (按1 ∶300比例稀释),37 ℃下避光孵育1 h,PBST 缓冲液漂洗,滴加DAPI 染细胞核,室温下避光孵育5 min,PBST 缓冲液漂洗,50%甘油封片,在荧光显微镜下观察。再以PBS 缓冲液代替一抗,作为阴性对照。每张切片随机选取6 个视野(×100),采用Image-J 图像分析系统进行光密度分析,记录光密度。
2.5 统计学分析 通过SPSS 23.0 软件进行处理,计量资料以() 表示,组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 桔梗多糖对桔梗皂苷D 在体肠吸收的影响图2 显示,桔梗多糖组Ka、Papp值高于对照组(P<0.05,P<0.01),并呈剂量依赖性。表1 显示,桔梗多糖组fa值高于对照组(P<0.01),并呈剂量依赖性。
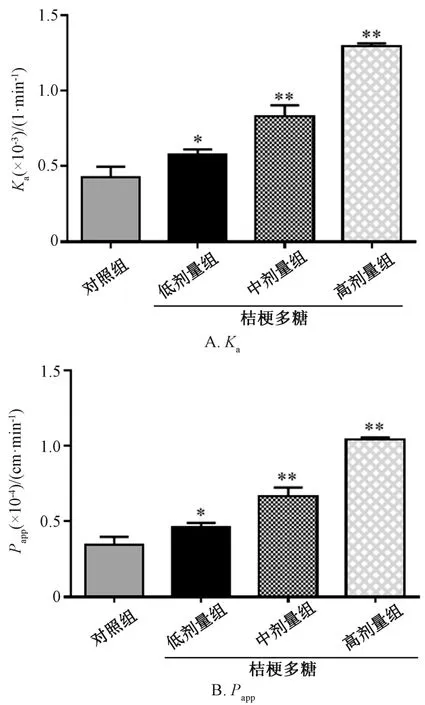
图2 桔梗多糖对桔梗皂苷D 在体肠吸收的影响Fig.2 Effects of P.grandiflorum polysaccharides on the in vivo intestinal absorption of platycodin D
3.2 桔梗多糖对紧密连接蛋白表达的影响 图3显示,Claudin-1、Occludin 主要表达于细胞膜及细胞之间的连接处,胞质中也有少量存在,沿肠上皮细胞均匀分布;ZO-1 均匀分布于小肠绒毛,多表达于胞核中,呈蜂窝或者点状聚集;与对照组比较,桔梗多糖组Claudin-1、Occludin、ZO-1 表达下调(P<0.05,P<0.01),并呈剂量依赖性。
表1 各组桔梗皂苷D fa 值比较(, n=5)Tab.1 Comparison of fa values for platycodin D among various groups (, n=5)

表1 各组桔梗皂苷D fa 值比较(, n=5)Tab.1 Comparison of fa values for platycodin D among various groups (, n=5)
注:与对照组比较,**P<0.01。
3 讨论
中医临床处方中桔梗常用剂量为9~12 g[11],不同产地药材中桔梗皂苷D、桔梗多糖质量分数范围分别为1.43~2.97、182~517 mg/g[12]。参考大鼠给药剂量换算方法,本实验设定在体肠循环灌注体积为25 mL,桔梗皂苷D 质量浓度为20 μg/mL,桔梗多糖低、中、高剂量分别为1、2、4 mg/mL,多糖与皂苷含量比例以两者在含桔梗临床处方中的比例为依据。
桔梗皂苷D 水溶性较好,但膜渗透性较差,属于生物药剂学分类系统中的Ⅲ类药物,生物利用度不理想。大鼠肠灌流模型中某一化合物Papp<0.18×10-3cm/min 时,表示其难以吸收[13],而对照组中桔梗皂苷D 的Papp为3.43×10-5cm/min,是口服难吸收药物,与文献[3] 报道一致,而桔梗多糖的加入使该成分肠吸收水平、人体预测口服吸收系数均显著升高,并呈剂量依赖性。
天然药物作为其他活性成分的吸收促进剂,通常与抑制P-糖蛋白的外排作用或松驰细胞间的紧密连接等有关[14]。研究证实,桔梗皂苷D 不是P-糖蛋白底物,其转运不受后者影响[3]。本实验发现,不同剂量桔梗多糖均可显著降低Claudin-1、Occludin、ZO-1 表达,并随着剂量增大作用更明显,推测该成分可能通过直接或间接调控紧密连接蛋白表达来影响桔梗皂苷D 吸收。
桔梗多糖可促进巨噬细胞及T 淋巴细胞增殖,显著诱导TNF-α、IL-6、IL-2 等细胞因子产生[15],其表达对调控紧密连接起到关键作用,进而影响肠上皮细胞通透性[16],故推测该成分的促吸收机制可能与免疫活性的激活相关。此外,中药成分可通过肠道菌群代谢或生物转化而产生新的生物活性分子,促进药物吸收[17]。汤剂中被忽视的一些辅助成分或“无效” 成分(如多糖、甾醇、鞣质等)可能是一些转运体或代谢酶的底物,是否也会对活性物质的药动学过程产生影响尚不明确[18],需在其肠吸收机制中继续考察。
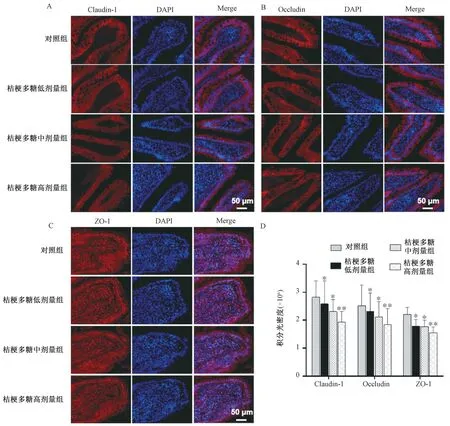
图3 桔梗多糖对Claudin-1、Occludin、ZO-1 表达的影响Fig.3 Effects of P.grandiflorum polysaccharides on expressions of Claudin-1,Occludin and ZO-1
综上所述,桔梗多糖可改善桔梗皂苷D 在体肠吸收,可能与细胞间紧密连接的改变有关,可为今后研究汤剂中活性成分的肠吸收机制奠定基础。
——辨别味之苦甜