制枳壳HPLC 指纹图谱与小肠推动作用的谱效关系
王红阳,钟佩芸,梁家怡,周敏贤,陈 康,夏 荃*
(1.广州中医药大学,广东 广州 510006;2.暨南大学,广东 广州 510632)
枳壳为芸香科植物酸橙Citrus aurantiumL.及其栽培变种的干燥未成熟果实,具有理气宽中、行滞消胀等功效[1],其炮制品种较多[2]。2015 年版《中国药典》 收载了枳壳、麸炒枳壳,并将柚皮苷、新橙皮苷作为含量测定的指标成分。
制枳壳[3]作为广东等岭南地区习用的炮制品种,采用了浸泡、发酵、蒸制等一系列步骤的独特工艺,能较好地缓和生品峻烈之性,避免损气、耗气之弊,在当地广泛应用。但目前对制枳壳的研究较少,仅涉及炮制前后其化学成分变化,尽管有学者对其指纹图谱进行了研究[4],但尚未涉及其药效及物质基础,存在成分变化与药效研究分离的问题。课题组前期研究发现,枳壳经发酵、蒸制后,柚皮苷、新橙皮苷、挥发油等药效成分含量均有所降低[5],但临床疗效依旧显著,故推测炮制品发挥药效的主要成分可能与生品不同,其药效评价及物质基础有待进一步考察。
灰色关联分析[6-7]是目前谱效关系研究中应用较广泛的方法,但存在易受分辨系数影响的缺点,并且不能反映相关的正负性,故实际分析时很多学者更趋向于采用2 种及2 种以上方法联合应用[8]。正交投影偏最小二乘法(OPLS)[9]是一种改进的偏最小二乘法,在分析多因素模型时能有效去除预测矩阵中与因变量无关的信息,改善了模型的解释性和真实性,被广泛应用于模型验证,可很好地弥补灰色关联度分析方法的不足。因此,本实验在建立生、制枳壳指纹图谱的基础上,通过联合应用灰色关联分析与OPLS 进行谱-效关联,旨在探讨制枳壳小肠推动作用的药效物质,为相关基础研究提供参考。
1 材料
1.1 仪器 LC-20A 高效液相色谱系统、Inertsil ODS-3 高效液相色谱柱(250 mm×4.6 mm,5 μm) (日本岛津公司);Triple TOF 5600 超高效液相色谱仪-飞行时间质谱仪(美国AB SCIEX 公司)。
1.2 试剂橙皮苷 (110721-201617,20 mg,纯度96.1%)、柚皮苷(110722-201714,20 mg,纯度93.4%)、新橙皮苷(111857-201703,20 mg,纯度99.2%) 对照品均购自中国食品药品检定研究院;柚皮素(BWB50920,20 mg,纯度≥98%)、橙皮素(BWB50172,20 mg,纯度≥98%)、川陈皮素(BWB0620,20 mg,纯度≥98%) 对照品均购自北京世纪奥科生物技术有限公司。枸橼酸莫沙必利分散片(180902) 购自成都康弘药业集团有限股份公司。甲醇、乙腈为色谱纯(德国默克公司);其他试剂均为分析纯。
1.3 药物 枳壳经广州中医药大学中药鉴定教研室张丹雁教授鉴定为酸橙Citrus aurantiumL.及其栽培变种的干燥未成熟果实,具体信息见表1。制枳壳制备方法为将生品(编号S1~S10) 除去杂质及瓢核,洗净,浸至七成透,取出,发酵3~4 d,洗净,蒸4~6 h,闷一夜,至内部呈紫褐色时取出,切片,干燥,即得,编号S11~S20[3]。
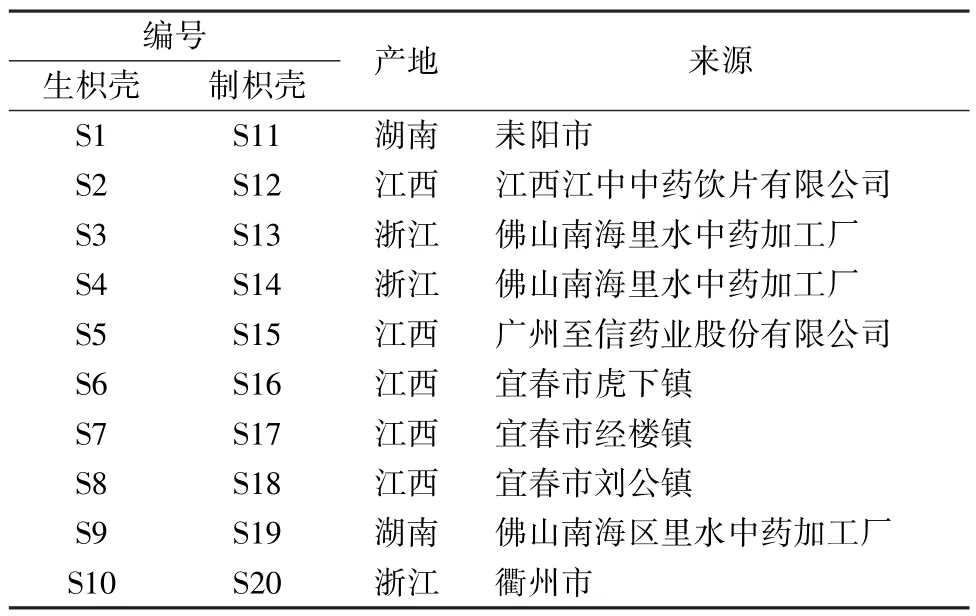
表1 样品信息
1.4 动物 264 只SPF 级昆明种小鼠,雌雄各半,体质量(20±2) g,由广州中医药大学实验动物中心提供,实验动物合格证号44005800006682,动物实验许可证号SYXK(粤) 2013-0085。
2 方法与结果
2.1 HPLC 指纹图谱建立
2.1.1 对照品溶液制备 精密称取柚皮苷、新橙皮苷、橙皮苷、柚皮素、橙皮素、川陈皮素对照品适量,加甲醇制成每1 mL 分别含上述成分80 μg 的溶液,即得。
2.1.2 供试品溶液制备 取本品粗粉约1 g,精密称定,置于具塞锥形瓶中,精密加入90 mL 甲醇,称定质量,加热回流1.5 h,放冷,甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.3 色谱条件 参考文献[10] 报道。Inertsil ODS-3 色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A) -水(含0.1%磷酸) (B),梯度洗脱(0~10 min,5%~6%A;10~20 min,6%~15% A;20~75 min,15%~27% A;75~120 min,27%~65% A);体 积流量1.0 mL/min;柱温25 ℃;检测波长283 nm。色谱图见图1。

图1 各成分HPLC 色谱图
2.1.4 质谱条件 电喷雾ESI 离子源,负离子模式扫描;检测范围50~1 200 Da;喷雾电压5 500 eV;离子源温度550 ℃;去簇电压100 V;二级碰撞电压±45 V。
2.1.5 图谱生成 按“2.1.2” 项下方法制备供试品溶液,在“2.1.3” 项色谱条件下进样测定,将10 批样品色谱图导入“中药色谱指纹图谱相似度评价系统” (2008A 版),以S6 为参照,采用平均数法得到指纹图谱及对照指纹图谱,见图2~3,发现各批样品相似度均>0.95,表明其质量稳定。
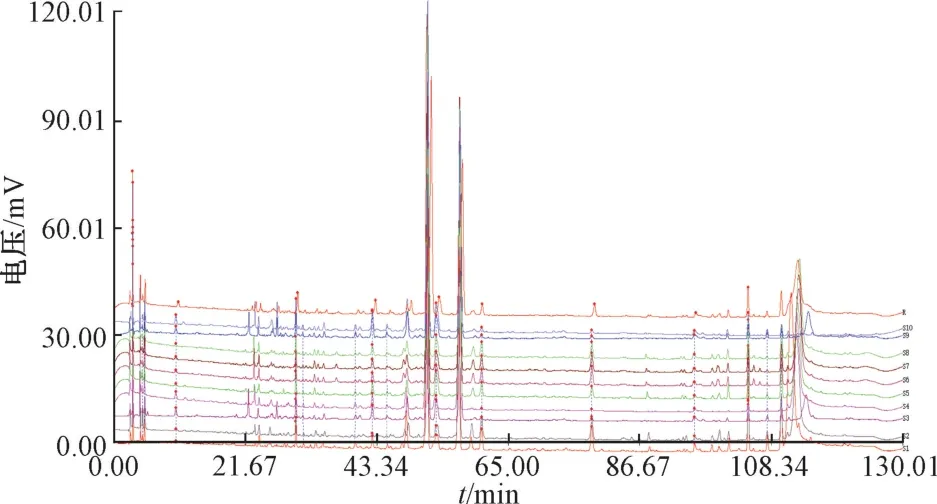
图2 生枳壳指纹图谱、对照图谱
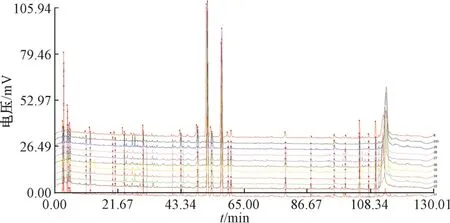
图3 制枳壳指纹图谱、对照图谱
2.1.6 方法学考察 取供试品溶液(S10),在“2.1.3”项下色谱条件进样测定6 次,测得各共有峰相对峰面积RSD 均<3%,表明仪器精密度良好。按“2.1.2” 项下方法制备供试品溶液6 份,在“2.1.3” 项色谱条件下进样,测得各共有峰相对峰面积RSD 均<3%,表明该方法重复性良好。按“2.1.2” 项下方法制备供试品溶液,于0、2、4、6、12、24 h 在“2.1.3” 项色谱条件下进样测定6 次,测得各共有峰相对峰面积RSD 均<3%,表明溶液在24 h 内稳定性良好。
2.1.7 HPLC-Q-TOF-MS 数据采集 见图4。
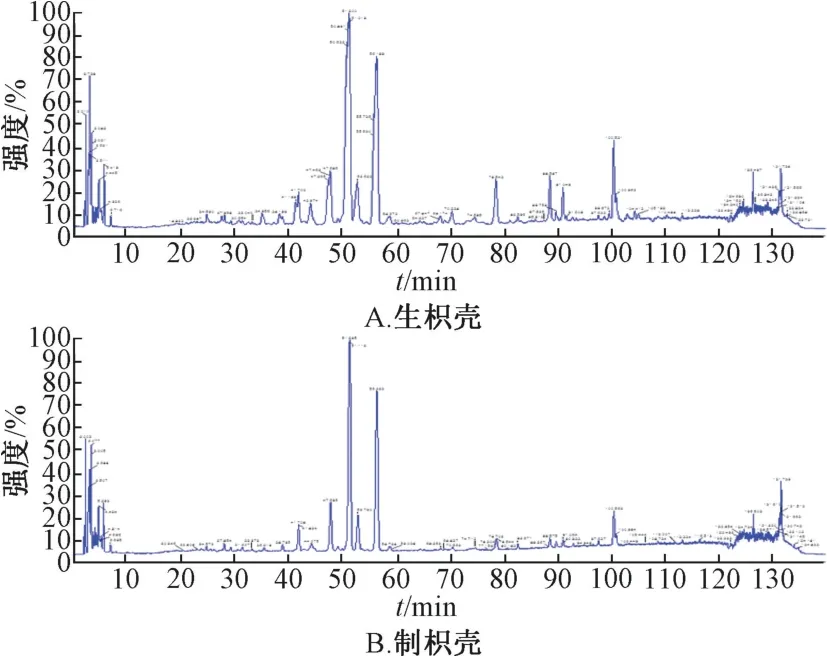
图4 样品总离子流图(正离子)
2.2 药效学实验
2.2.1 药液制备 取生、制枳壳各500 g,加10 倍量水浸泡30 min,煎煮30 min,纱布过滤,残渣加8 倍量水煎煮20 min,合并水煎液,减压抽滤,将滤液浓缩至生药量1 g/mL,即得。
2.2.2 分组及给药 小鼠适应性喂养3 d 后,随机分为22 组,每组12 只,分别为空白组、阳性组(10 mg/kg 枸橼酸莫沙必利)、10 个生枳壳组(4 g/kg)、10 个制枳壳组(4 g/kg)。给药组按0.2 mL/10 g 剂量灌胃,空白组灌胃给予相应体积蒸馏水,每天1 次,连续4 d。
2.2.3 小肠推进实验 小鼠末次给药前禁食不禁水14 h,末次给药1 h 后灌胃给予营养性半固体糊,每只0.6 mL,5 min后脱颈处死,分离肠胃,测量幽门到盲肠部全长及半固体糊推进前沿的距离,计算小肠推进率,公式为推进率=(幽门到指示前沿距离/幽门至回盲肠全部距离) ×100%[11],通过SPSS 22.0 软件进行处理,数据以()表示,组间比较采用单因素方差分析,结果见表2。由此可知,与空白组比较,生、制枳壳组对小鼠小肠推进能力均有不同程度的促进作用(P<0.05),但组间比较差异无统计学意义(P>0.05)。
表2 生、制枳壳对小鼠小肠推进能力的影响()
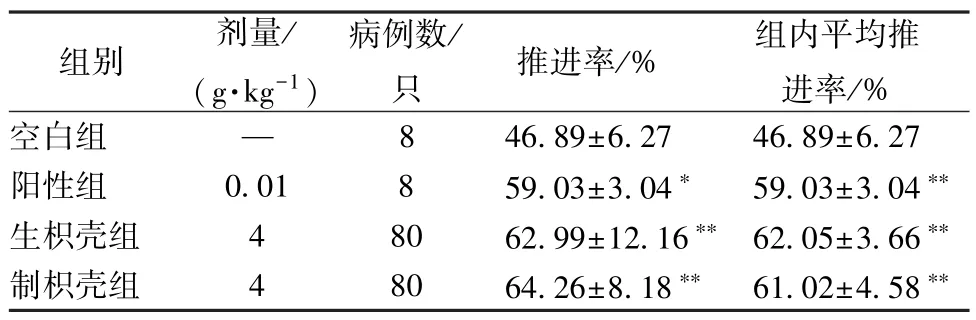
表2 生、制枳壳对小鼠小肠推进能力的影响()
注:与空白组比较,*P<0.05,**P<0.01。
2.3 灰色关联分析
2.3.1 数据无量纲化处理 采用DPS7.05 软件,原始数据采用初值化变换法。以小肠推进率的药效指标为母序列,记为{X0(t) };生、制枳壳特征峰的峰面积作为子序列,记为{Xi(t) }。
2.3.2 绝对差序列、关联系数计算 经数据变换的母序列标记为{X0(k) },子序列记为{Xi(k) },k=t时两者关联系数L0i(k) 可由以下公式计算。其中,Δ0i(t) 表示2 个比较序列的绝对差,即Δ0i(t)=|x0(t) -xi(t) |(1≤i≤m);Δmin、Δmax分别表示所有比较序列各时间点绝对差中的最小值、最大值;ρ为分辨系数,通常取0.5。
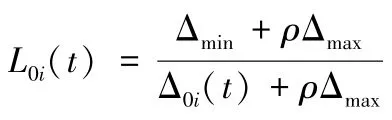
2.3.3 关联度计算 按下式计算各比较序列与参考序列关联系数的平均值,以反映两者关联关系。其中,r0i为子序列与母序列的关联度,n为子序列的长度即数据个数。

2.4 药效高相关色谱峰指认 通过Peakview、Markerview 软件对UPLC-Q-TOF-MS 数据进行预处理,基于文献研究和chemspider、HMD 公共数据库进行成分分析,结果见表3~4。
2.5 偏最小二乘法(OPLS-DA) 判别分析
2.5.1 数据标准化处理 采用SIMCA-P14.1 软件,分别将表2、4 中的色谱峰进行标准化处理。
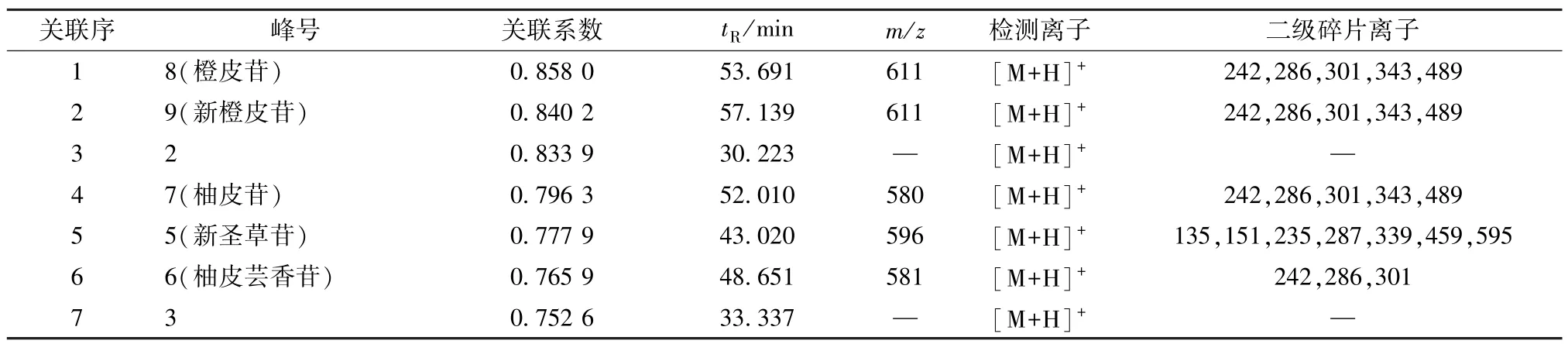
表3 小肠推动作用与生枳壳色谱峰峰面积的相关度(关联系数>0.75)
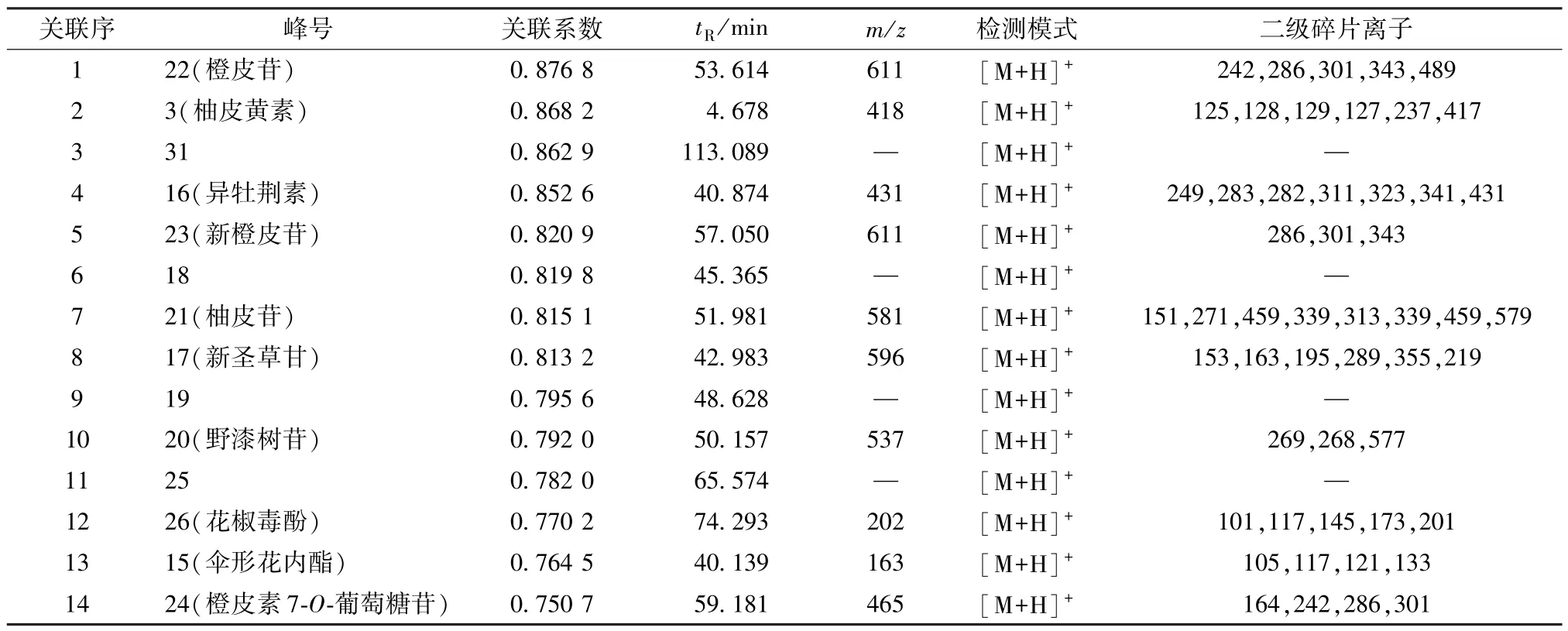
表4 小肠推动作用与制枳壳色谱峰峰面积的相关度(关联系数>0.75)
2.5.2 生枳壳谱效关系的OPLS-DA 分析 以标准化处理的特征峰峰面积为自变量X,各组小鼠小肠推进率为因变量Y1,采用SIMCA-P14.1 软件进行OPLS 回归分析,见图5~6。由此可知,X5(新圣草苷)、X8(芸香柚皮苷)、X3的VIP 值均>1,其中X5、X8均为正值,表明两者与小肠推进率呈高度正相关性。
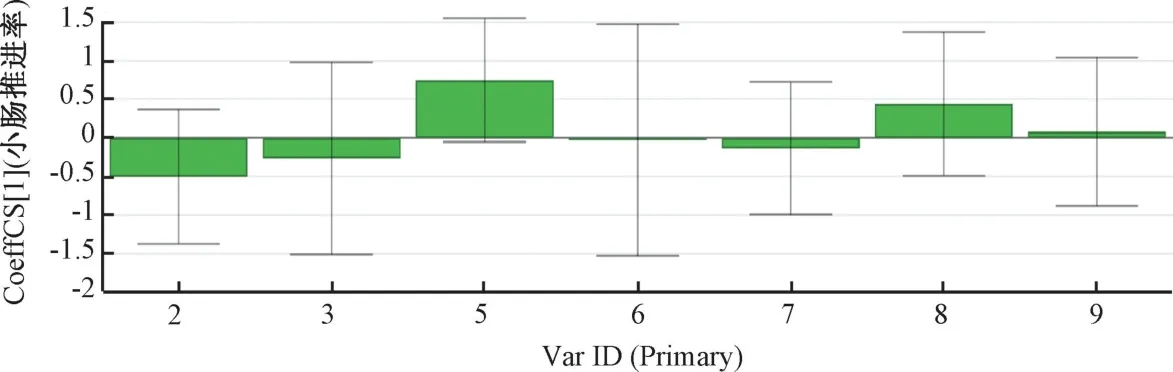
图5 生枳壳谱效相关性的标准化回归系数
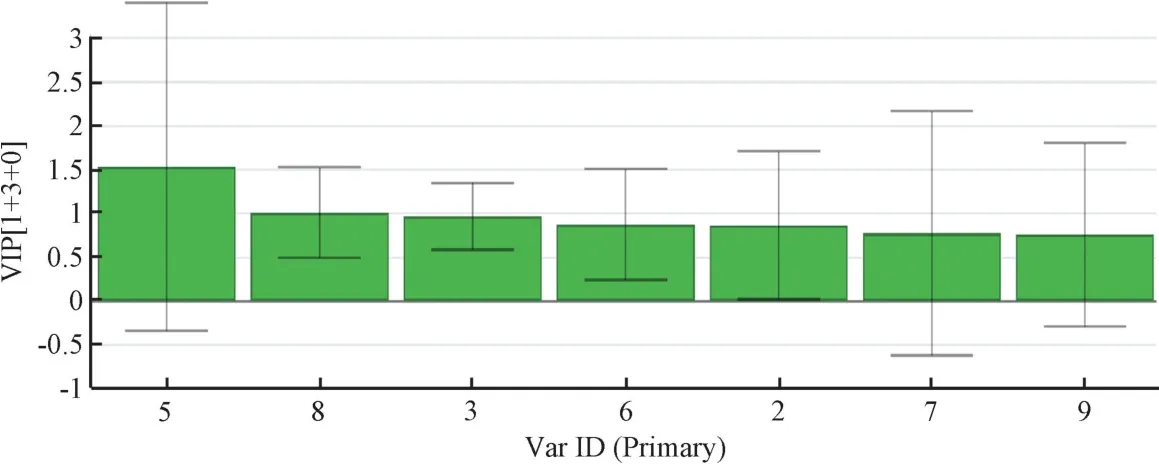
图6 生枳壳各药效相关峰对小肠推动作用的贡献
2.5.3 制枳壳谱效关系的(OPLS-DA) 分析 以标准化处理特征峰峰面积为自变量X,各组小鼠小肠推进率为因变量Y2,采用SIMCA-P14.1 软件进行OPLS 回归分析,见图7~8。由此可知,X3(柚皮黄素)、X15(伞形花内酯)、X16(异牡荆素)、X17(新圣草苷)、X19、X26均与小肠推进率呈正相关,其中X3、X15的VIP 值均>1,表明两者为制枳壳主要活性成分。
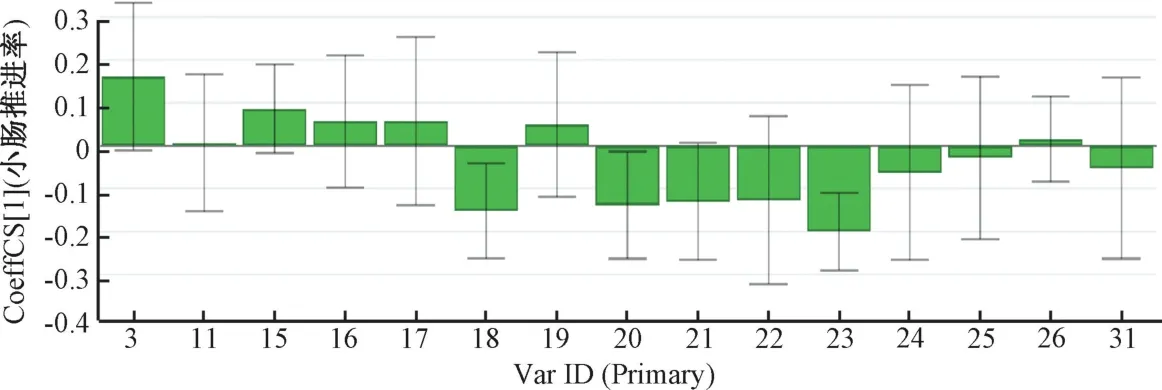
图7 制枳壳谱效相关性的标准化回归系数
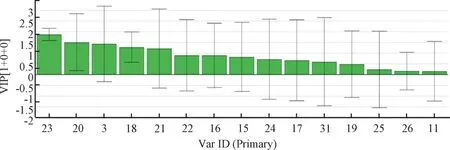
图8 制枳壳各药效相关峰对小肠推动作用的贡献
3 讨论
本实验发现,制枳壳药效高相关成分明显多于生枳壳,而且种类存在较大差异。生枳壳中橙皮苷、新圣草苷、新橙皮苷与药效呈正向高相关性,与目前发现的促胃肠动力主要成分基本一致[12-14],说明所建立谱效关系可靠。
在制枳壳的OPLS 模型中,柚皮素、新橙皮素与药效表现出高度正相关性,而部分苷类,尤其是橙皮苷、新橙皮苷则与表现出负相关性。其原因可能为(1) 柚皮苷、新橙皮苷是枳壳中含量较高的黄酮类成分,两者均含有分子量较大的双糖结构,亲脂性低,在消化道内不易被吸收[15],从生物利用度和活性来讲,黄酮苷类的生物活性低于对应的苷元;(2) 制枳壳在发酵过程中柚皮苷、橙皮苷在微生物群的作用下水解,含量降低,同时脱去糖基转化成柚皮素、新橙皮素等苷元,使得对应苷元含量明显升高,而苷元脂溶性较大,有利于经小肠吸收进入血液循环,能较快达到所需血药浓度,并发挥其药效作用。
胃肠运动同时受到神经系统、内分泌激素的调控,是极为复杂、高度协调的神经-肌肉活动[16]。本研究发现,生、制枳壳虽然在药效相关性成分上差异明显,但两者对正常小鼠的促小肠推动作用并无显著差异,提示它们可能有不同的促小肠运动作用机制。对慢性胃肠功能障碍的患者而言,糖苷类成分可能更难以被吸收利用,而制枳壳中黄酮苷元有更好的生物利用度,从而疗效更强,可能是临床上以其组方治疗脾虚体弱患者的原因。因此,需建立相应的病理状态动物模型或进行临床研究,从多个角度进行更深入的探讨,并且枳壳炮制后的作用表现在多个方面,如缓和烈性与燥性等,有待进一步探讨。
虽然制枳壳作为岭南地区习用药被广泛使用,但广东省中药饮片炮制规范尚未建立其含量测定的方法及标准,不利于质量控制及评价。本实验发现,制枳壳胃肠推动药效成分远多于生枳壳,而且种类不同,故以柚皮苷、新橙皮苷等2015 年版《中国药典》 规定的指标成分对制枳壳质量进行评价不够合适。今后,可从制枳壳未知药效相关成分的分离、结构鉴定及药效评价入手,为该炮制品物质基础和质量控制的研究奠定基础。