重庆市艾滋病患者新型隐球菌临床分离株基因分型和临床特点分析
李晓旭,曹培明,胡永芳,杨 坤,何 静,李小凤,刘 敏,周 刚,廖国建,李同心
新型隐球菌(Cryptococcus neoformans)是致命的病原真菌之一,每年在全球引起超过100万例感染[1]。免疫缺陷患者,尤其是HIV感染和艾滋病患者,是新型隐球菌感染的主要人群。在HIV高流行区,新型隐球菌性脑膜炎发病率高,且预后差;即使通过药物治疗,新型隐球菌感染的死亡率仍然高达30%~95%[1-2]。
隐球菌属至少有30多个种,其中具有致病性的绝大多数为新型隐球菌和格特隐球菌,我国以新型隐球菌感染为主[3]。有学者对亚洲新型隐球菌菌种分布与构成的研究显示我国华北、华东地区的新型隐球菌临床株以ST5型为主[4-5]。本研究旨在分析重庆市艾滋病患者临床分离新型隐球菌的基因型,了解新型隐球菌的分子流行病学特点,同时对相关的临床资料进行总结,分析主要型别菌株感染患者的临床症状、预后等特点,为新型隐球菌病的预防、诊断、治疗提供更加科学的依据。
1 材料与方法
1.1 研究资料
1.1.1 研究对象 收集重庆市公共卫生医疗救治中心感染科住院部2017年3月1日—2018年7月31日送检的艾滋病患者行真菌培养的体液标本共1 063份。艾滋病诊断标准参照《中国艾滋病诊疗指南(2018版)》[6]。本研究取得所有患者知情同意和重庆市公共卫生医疗救治中心学术伦理委员会批准。本研究试验中使用的标准菌株H99(ATCC 208821)为西南大学药学院赠与。
1.1.2 患者临床特征 收集患者一般资料(姓名、性别、年龄、职业、婚姻状况、民族等)、基础疾病(糖尿病、结核病、系统性红斑狼疮、肾病综合征、慢性支气管炎等)、临床症状、检验结果(血常规、脑脊液生化等)、影像学检查表现以及转归情况等临床信息。
1.2 方法
1.2.1 标本分离培养、鉴定和药敏 痰液、纤维支气管镜灌洗液的真菌分离培养使用沙保弱培养基(sabouraud dextrose agar,SDA),35℃培养5~7 d,菌株传代接种于SDA,35℃培养24~48 h,挑取纯的单个菌落进行鉴定与抗真菌药物敏感性试验。血液、脑脊液、胸水等采用美国BD BACTECTMFX 200全自动血液培养仪和配套的真菌培养瓶培养,待仪器报阳后转种SDA,35℃培养24 h,挑取纯的单个菌落进行鉴定与药物敏感性试验。新型隐球菌的鉴定与最低抑菌浓度 (MIC)药敏使用Thermo Scientific 生产的SENSITITRE ARIS 2X 微生物鉴定、药敏分析系统及配套的鉴定药敏试剂盒,按照试剂盒说明书完成对菌种的鉴定和隐球菌对两性霉素B、氟胞嘧啶、氟康唑、伊曲康唑和伏立康唑5种抗真菌药物的药敏试验,MIC判读参考美国临床和实验室标准化协会(CLSI)2012年 M27-S4中念珠菌标准。
1.2.2 菌株保藏、培养与复苏 将新型隐球菌分离株从分离平板上刮取足够菌体至含有20%甘油保种管中,混匀并放于-80℃保藏。活化菌株时,挑取适量冻存菌体至SDA平板上培养24 h以上,待平板上长出菌体进行下一步实验。
1.2.3 隐球菌基因组DNA的提取 用氧化苄法提取隐球菌临床株与标准菌株的基因组DNA,提取所得的DNA于-20℃保存备用。
1.2.4 基因型鉴定 按照文献用血清型和交配型特异性引物(STE20Aa、STE20Aα、STE20Da和STE20Dα)对患者入院首次分离的54株新型隐球菌基因组DNA进行PCR扩增[4]。
1.2.5 PCR扩增 参照国际人与动物真菌学会(ISHAM)共识方案,选取新型隐球菌的7个管家基 因CAP59、GPD1、IGS1、LAC1、PLB1、SOD1、URA5进行PCR扩增[7-8]。
1.2.6 隐球菌基因分型 利用提取的54株临床菌株的基因组,对新型隐球菌上述7个管家基因进行PCR扩增,将扩增产物纯化、测序,将测序结果按照数据库的要求进行校正,校正后符合数据库要求的序列提交至数据库网站(National Center for Biotechnology Information)获得GenBank登录号并通过新型隐球菌/格特隐球菌复合群数据库(http://mlst.mycologylab.com)确定每株菌的序列型ST型。
1.2.7 统计学方法 利用医院信息系统(HIS,上海瑞美电脑科技有限公司)检索统计原始检验结果;采用Microsoft Excel进行数据整理,建立数据库,SPSS 21.0进行统计学分析;应用BioNumerics软件进行多位点序列分型(MLST)。采用率或构成比(%)进行计数资料描述,组间比较采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 菌株收集
1 063 份体液标本行真菌培养分离出致病真菌619株,其中189株初步鉴定为新型隐球菌,体液标本类型含有脑脊液148份、血液40份、胸水1份。由于菌株复苏失败或同时混有其他致病菌、临床资料不全等原因,最终获得来自54例艾滋病患者分离的149株菌株有效。纳入本研究统计分析中54株新型隐球菌为患者入院首次分离的菌株,其原始标本类型分别为脑脊液38份、血液15份、胸水1份。
2.2 临床资料
2.2.1 一般资料 54例艾滋病患者现居地均为重庆市,男42例,女12例,男女比1∶0.3;年龄为11~75岁,平均(45.0±14.5)岁。从发病至就诊的间隔时间为2~60 d,平均(18.3±16.1)d。平均住院天数(26.5±14.5) d(1~53 d)。转归:好转38例(70.4%),病情无改善16例(29.6%)。
2.2.2 临床表现与出院诊断 54例患者入院时临床表现以发热为最多见,占88.9%(48/54)。12例有基础性疾病,占22.2%(12/54),基础性疾病主要为:2型糖尿病2例,高血压2例,肺结核1例,结核性胸膜炎1例,慢性乙肝4例,脑动脉血栓1例,痛风1例。出院诊断均有“新型隐球菌性脑膜炎”。
2.2.3 入院首次实验室检查
2.2.3.1 血细胞检查 54例艾滋病患者中32例(59.3%)血常规检查白细胞在正常范围内;5例(9.3%)淋巴细胞在正常范围内,38例(70.4%)淋巴细胞<1.1×109/L。
2.2.3.2 HIV-1病毒载量检查 54例患者HIV-1病毒载量平均值(326 152.6±109 395.4)拷贝/mL;7例(13.0%)HIV-1病毒载量检测正常(<40拷贝/mL)。
2.2.3.3 CD4+T淋巴细胞检查 54例患者CD4+T细胞绝对值检查均<200.0/μL,最低值3.0/μL,最高值155.0/μL,平均(33.5±4.8)/μL。
2.2.3.4 脑脊液常规及生化检查 53例患者有腰穿脑脊液记录,腰穿脑脊液压力中位数为190 mmH2O,22例(41.5%)脑脊液压力在正常范围内。脑脊液总蛋白检测平均值(964.9±96.4)mg/L,11例(20.4%)脑脊液总蛋白在正常范围内。脑脊液氯化物检测平均值(118.1±2.4)mmol/L,24例(44.4%)脑脊液氯化物在正常范围内。脑脊液葡萄糖检测平均值(2.4±0.2)mmol/L,21例(38.9%)脑脊液葡萄糖在正常范围内。
2.2.3.5 新型隐球菌特异性检查 48例患者进行脑脊液墨汁染色,85.4%(41/48)的患者墨汁染色涂片查见新型隐球菌。53例患者分别进行了脑脊液新型隐球菌抗原检测和真菌培养,阳性率分别为100%(53/53)和88.7%(47/53)。见表1。
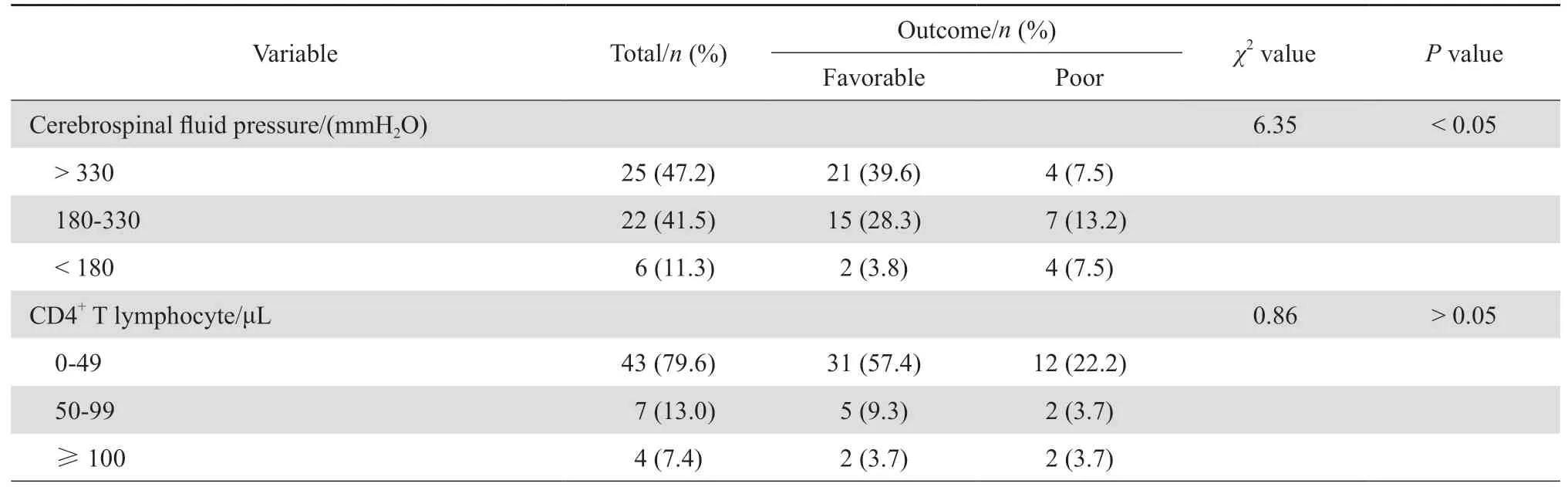
表1 54例艾滋病患者入院首次临床检测结果与预后的特征分析Table 1 Baseline laboratory tests and corresponding outcome of the 54 AIDS patients admitted to hospital
2.2.4 影像学检查 44例进行头颅影像学检查的患者中,25例表现为颅内多发斑点状、斑片状、囊状改变;8例表现为双侧基底节/额叶多发线状、斑点状改变;3例表现为右侧额叶条片状改变;4例表现为颅内散在缺血灶,伴脑萎缩改变,4例头颅影像学检查未见异常。

表1 (续)Table 1(continued)
2.3 抗真菌药物敏感试验
54株新型隐球菌中,1株(1.9%)对伏立康唑耐药,1株(1.9%)对氟胞嘧啶耐药,3株(5.6%)对伊曲康唑耐药,54株均对氟康唑和两性霉素B敏感。
2.4 MLST分型结果
54株新型隐球菌菌株共分为4个型,分别为VNⅠST5型46株,占85.2%;VNⅠST31型6株,占11.1%;VNⅠST79型1株,占1.9%;VNⅠST53型1株,占1.9%。上述5株耐药菌株均为ST5型。
3 讨论
新型隐球菌是一种被包裹的真菌,在周围环境中普遍存在。近年来采用不同的分型方法,将全球各地的新型隐球菌分为8种主要的基因型,即VNⅠ~VNⅣ和VGⅠ~VGⅣ[9-10]。人 类 主要通过呼吸道感染新型隐球菌,其次为接触和消化道感染[11],新型隐球菌是真菌性脑膜炎的常见致病菌之一。对于HIV/艾滋病患者,新型隐球菌主要侵犯其中枢神经系统,引起新型隐球菌性脑膜炎,此外亦可侵入骨骼、肌肉、淋巴结、皮肤黏膜引起慢性炎症和脓肿。
本研究采集54例艾滋病患者的临床病例中,男女比1∶0.3,男性远多于女性,这与广东地区、台湾地区及欧洲研究结果一致[5,12];年龄为11~75岁,平均(45.0±14.5)岁,多数为汉族,已婚,家务及待业等人群特点,且77.8%患者平素体健,无基础疾病,近30%患者经治疗后病情无好转。54例患者首次送检体液培养阳性的样本类型最多的为脑脊液,占70.4%(38/54),这与新型隐球菌容易侵犯HIV/艾滋病患者中枢神经系统有关。患者临床表现以发热为最多见,其次为头痛、乏力、体重下降;影像学检查显示,大部分患者头颅影像学表现为颅内多发斑点状、斑片状、囊状改变,与既往报道相似[13-14],这提示新型隐球菌性脑膜炎临床表现不典型,最常见的症状是头痛、发热、呕吐、乏力等中枢神经系统症状,需要与其他细菌性脑膜炎等中枢神经系统疾病相鉴别,早期对症干预,减少死亡率。
实验室检查结果显示,59.3%患者首次实验室检查白细胞检测值处于正常参考值范围内,70.4%患者首次淋巴细胞检测值低于参考值下限,而CD4+T淋巴细胞绝对值<100/μL患者占92.6%,小于50/μL患者占79.6%;HIV-1病毒载量>104拷贝/mL的患者占70.4%,虽然CD4+T淋巴细胞绝对值和HIV-1病毒载量与患者预后无显著相关性,但较低的CD4+T淋巴细胞绝对值和较高的HIV-1病毒载量可能会增加艾滋病患者感染新型隐球菌的概率。通过脑脊液检查发现,大多数患者主要表现为“两高两低”的特征,即脑脊液压力增高、总蛋白定量增高、脑脊液氯化物及葡萄糖定量降低,与其他细菌性脑膜炎相似,增加了临床上与其他性质的颅内病变的鉴别难度。从本研究统计结果来看,脑脊液压力增高与患者预后有显著相关性(P< 0.05),而脑脊液氯化物、葡萄糖定量、白细胞和淋巴细胞计数与患者预后无密切关系(P均> 0.05)。有研究显示,艾滋病合并新型隐球菌感染的住院患者中约90%有颅内压增高的症状,近80%院内死亡病例有颅内压升高的表现[14],与本研究中住院患者、预后不良患者的颅内压增高分别占88.7%(47/53)、73.3%(11/15)一致。
本研究纳入的艾滋病患者均有明确的新型隐球菌性脑膜炎病原学和/或免疫学证据(培养、脑脊液墨汁染色和新型隐球菌抗原检测三种方法任意一种为阳性[13]),但这些新型隐球菌性脑膜炎患者入院首次培养阳性的样本除了脑脊液以外,有9例患者血液培养在时间上优先于脑脊液报阳,有6例患者血液培养阳性而脑脊液培养阴性。本研究对54例患者的脑脊液墨汁染色诊片和新型隐球菌抗原检测进行了对比分析:48例患者进行了脑脊液墨汁染色,41例患者查见新型隐球菌;53例进行新型隐球菌抗原检测患者中,阳性率100%。以脑脊液培养方法为金标准,脑脊液墨汁染色涂片和新型隐球菌抗原检测两种方法的灵敏度、一致性 分 别是85.4%(41/48)、87.5%(42/48)和100%(47/47)、100%(47/47)。目前临床上确诊新型隐球菌脑膜炎感染,仍需要借助于真菌培养、脑脊液墨汁染色和新型隐球菌抗原检测三种实验室方法,在缺乏病原学依据时鉴别诊断尤为困难。在重庆地区两项回顾性研究中指出,新型隐球菌脑膜炎是艾滋病死亡中常见的机会感染疾病之一(排列第六位)[15];艾滋病人群中枢神经系统感染总体发病率为11.27%,新型隐球菌性脑膜炎发病率为3.25%,仅次于结核性脑膜炎(4.50%),排列第二位[16]。因此,在经济较发达的地区,当高度怀疑新型隐球菌性脑膜炎感染时,应多次送检不同类型样本,联合多种实验室方法进行检测,以提高检测阳性率。
两性霉素B、氟胞嘧啶和氟康唑是目前艾滋病合并隐球菌性脑膜炎抗真菌治疗的常用有效药物。临床上常采用两性霉素B联合氟胞嘧啶一期诱导治疗后,再使用氟康唑和氟胞嘧啶联合用药进行巩固期维持治疗。本研究中所有受试菌株均对氟康唑敏感,但以往有研究对全球近3 000株新型隐球菌进行体外药敏试验结果显示,氟康唑耐药率11.2%[14],故其耐药问题仍然不容忽视。本研究中,伊曲康唑耐药率5.6%,其作为诱导期和巩固期的替代药物,较少用于治疗隐球菌性脑膜炎。伏立康唑在临床上的使用日渐增多,本研究54例患者中,有7例使用了伏立康唑联合治疗,体外药敏试验结果显示伏立康唑耐药率较低(0.7%),亦有研究显示伏立康唑对标准方案治疗失败的难治性隐球菌病,病情可得到有效控制[15],提示伏立康唑对治疗隐球菌病具有潜在价值。
本研究借助于测序技术来揭示保守基因的等位基因突变来对病原菌进行分型和鉴定,通过对每个菌株MLST的比较可以揭示各个分离株之间的亲缘关系。54株新型隐球菌菌株经鉴定:基因型均为VNⅠ型,85.2%的菌株为ST5家族,11.1%的菌株为ST31型。与相关文献报道的我国广东、华北、华东、香港、台湾地区以及日本、韩国的主要型别相同[17-20]。本研究也提示ST5家族是重庆市艾滋病患者感染的主要克隆系,除ST5家族以外的其他家族暂未发现耐药株。
本研究受限于对同一患者用药前后培养分离出不同菌株或同一患者不同体液标本分离出的菌株缺乏药物敏感性试验、MLST等比较分析,对服药前后菌株耐药谱是否发生改变,同一患者是否感染了不同基因型的菌株仍不清楚,需进一步深入研究。

