捕后干露对3种贝类活品品质的影响
闫丽新,姜明慧,刘俊荣,衣鸿莉,王选飞,田元勇
(大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
我国是贝类生产大国,2017年我国海水养殖贝类产量约1.5×108t,其中牡蛎、蛤和扇贝作为主要养殖经济品种,产量分列前3位[1]。我国贝类养殖量居世界首位,但销售端的品质和国外相比依然存在较大差距。目前,我国活贝运输包括带水运输和无水运输两种方式,如虾夷扇贝(Patinopectenyessoensis)在产地周边通常采用无水运输方式,从产地运往广州等地远距离一般利用活水车进行运输。菲律宾蛤仔(Ruditapesphilippinarum)和长牡蛎(Crassostreagigas)采用无水运输,到达零售端再放入海水中进行销售。带水运输对于保持风味品质具有一定的优势,但具有运输成本高的缺点。无水运输可降低运输成本,目前实际操作更多依赖于经验进行操作,缺乏科学指导。
贝类自采捕离水开始频繁经历无水环境,不同贝类对无水条件耐受程度也存在较大差异。虾夷扇贝干露超过24 h后其生理状态快速恶化进而导致死亡,但4 ℃条件下短期(24 h内)无水贮藏处置后复水,扇贝仍具有较好的恢复能力[2]。菲律宾蛤仔在4 ℃条件下干露24 h,复水后生理状态几乎能完全恢复[3-4]。而牡蛎具有更强的抗干露能力,4 ℃条件下无水贮藏后的半数致死时间为47.8 d[5]。此外,大量研究表明,不同贝类在面临缺氧胁迫时存在不同的无氧代谢途径。海洋无脊椎动物无氧代谢途径主要有4种:葡萄糖—乳酸途径、天冬氨酸—琥珀酸途径、葡萄糖—奥品途径和葡萄糖—琥珀酸途径[6]。其中,葡萄糖—奥品途径是奥品脱氢酶将糖酵解产生的丙酮酸与特异性氨基酸还原缩合成奥品化合物,以产生氧化型烟酰胺嘌呤二核苷酸(NAD+)用来合成腺苷三磷酸(ATP)。贝类进行无氧代谢时,alanopine脱氢酶(ADH)、strombine脱氢酶(SDH)、章鱼碱脱氢酶(ODH)和tauropine脱氢酶(TDH)活性较高,有研究报道,新鲜的牡蛎闭壳肌中,alanopine脱氢酶和strombine脱氢酶活性较高[7],而虾夷扇贝和菲律宾蛤仔则是章鱼碱脱氢酶活性较高[8]。明确不同贝类干露耐受能力和生化代谢变化机理,对贝类捕后无水贮藏工艺的设定至关重要。
笔者选取菲律宾蛤仔、长牡蛎、虾夷扇贝3种典型的经济贝类为研究对象,分析无水贮藏条件下肌肉的pH、糖原含量、ATP关联化合物含量、磷酸精氨酸含量及奥品脱氢酶活性等指标的变化规律,为建立贝类捕后无水贮藏工艺提供依据。
1 材料与方法
1.1 原料
虾夷扇贝(142.4±22.15) g和长牡蛎(180.1±15.14) g分别于2019年3月31日和4月6日购自大连长兴水产品市场,菲律宾蛤仔(13.6±0.71) g于2019年3月28日购自丹东水产公司,以上原料均用泡沫箱无水条件下密封,冰袋降温后快速运至实验室。原料到达实验室后放入循环海水养殖槽内进行24 h缓冲处理。
1.2 预处理
3种活贝经缓冲处理后,分别进行干露贮藏(4 ℃冰箱,覆盖海水湿布),在贮藏的第1、2、4、8天分别取样。去壳后取闭壳肌组织用液氮速冻后,用于分析。
1.3 方法
1.3.1 闭壳肌pH的测定
分别称取2.0 g预处理的样品,立刻加入10 mL 20 mmol/L碘乙酸钠溶液,在冰浴条件下用玻璃棒将肌肉充分捣碎后静置25 min,用精密pH计测定。每组3个平行。
1.3.2 闭壳肌中糖原含量的测定
取2.0 g 肉糜加入30% KOH溶液4 mL,沸水浴消化20 min。冷却后加入20 mL无水乙醇,5650 r/min离心15 min后取沉淀作为粗糖原,采用蒽酮比色法测定其含量[9]。
1.3.3 闭壳肌中关联化合物的提取及测定
分别称取1.0 g闭壳肌,加入5% PCA溶液10 mL,在冰浴下用玻璃棒捣碎10 min,后用2 mol/L KOH调节pH在2.0~3.5,将其定容至20 mL,7300 r/min离心5 min,将上清液用0.45 μm滤膜过滤后,取4.0 mL加入0.1 mol/L磷酸缓冲液1 mL后等待分析。用高效液相色谱法对关联化合物含量进行分析,选取大连依利特公司的色谱柱(SinoChrom ODS-BP 5 μm,4.6 mm×250 mm),采用二极管阵列检测器(DAD),在254 nm、35 ℃、0.7 mL/min、进样量0.02 mL的条件下进行检测。流动相A:0.05 mol/L K2HPO4-KH2PO4缓冲液(pH 6.5),流动相B:V(流动相A)∶V(甲醇溶液)=8∶2[10]。
1.3.4 闭壳肌中磷酸精氨酸的测定
磷酸精氨酸和ATP及相关化和物的提取方法相同。参考文献[10]的检测方法,用高效液相色谱法进行测定。选取日本岛津公司的色谱柱(Shim-pack CLC-NH26.0 mm×150 mm Shimadzu),在柱温40 ℃、波长205 nm的条件下进行检测,流动相:10 mmol/LV(磷酸缓冲液)(pH 3.4)∶V(乙腈)=8∶2,流速为1.0 mL/min。
1.3.5 闭壳肌中奥品脱氢酶活性的测定
取横纹肌3.0 g,加入0.1 mol/L NaCl,20 mmol/L Tris-HCl(pH 7.5)缓冲溶液15 mL。10 000 r/mim均质3次,每次30 s,其间隔30 s。后10 320 r/min离心10 min,上清液即为粗酶。用双缩脲法[11]测定粗酶的蛋白含量。在4 ℃条件下进行整个提取过程。
奥品脱氢酶活性测定参考文献[8]的方法,在反应体系中加入0.2 mmol/L还原型烟酰胺嘌呤二核苷酸(NADH),5 mmol/L丙酮酸,氨基酸底物,100 mmol/L磷酸盐缓冲溶液(pH 6.6),整个反应体系总体积为2.9 mL,加入0.1 mL粗酶使反应开始。章鱼碱脱氢酶、strombine脱氢酶、alanopine脱氢酶、tauropine脱氢酶的氨基酸反应底物分别是5 mmol/L精氨酸、甘氨酸、丙氨酸和牛磺酸。酶活性单位(U)定义为每分钟分解1 μmol NADH所需的酶量。
1.4 统计分析
试验数据均采用平均值±标准差的形式表示,用SPSS软件进行方差统计分析,用独立样本t检验对两组间显著性进行检验,显著性水平设为0.05。使用Panel Check 1.4.2软件对试验数据进行主成分分析。
2 结 果
2.1 闭壳肌pH
菲律宾蛤仔、长牡蛎、虾夷扇贝在无水贮藏过程中肌肉pH变化见图1,初始pH分别为7.13、7.23和7.39,无水贮藏过程中,菲律宾蛤仔pH无明显变化,长牡蛎和虾夷扇贝pH分别降至6.88和6.80。相比于菲律宾蛤仔,虾夷扇贝闭壳肌pH下降最明显,其次是长牡蛎。
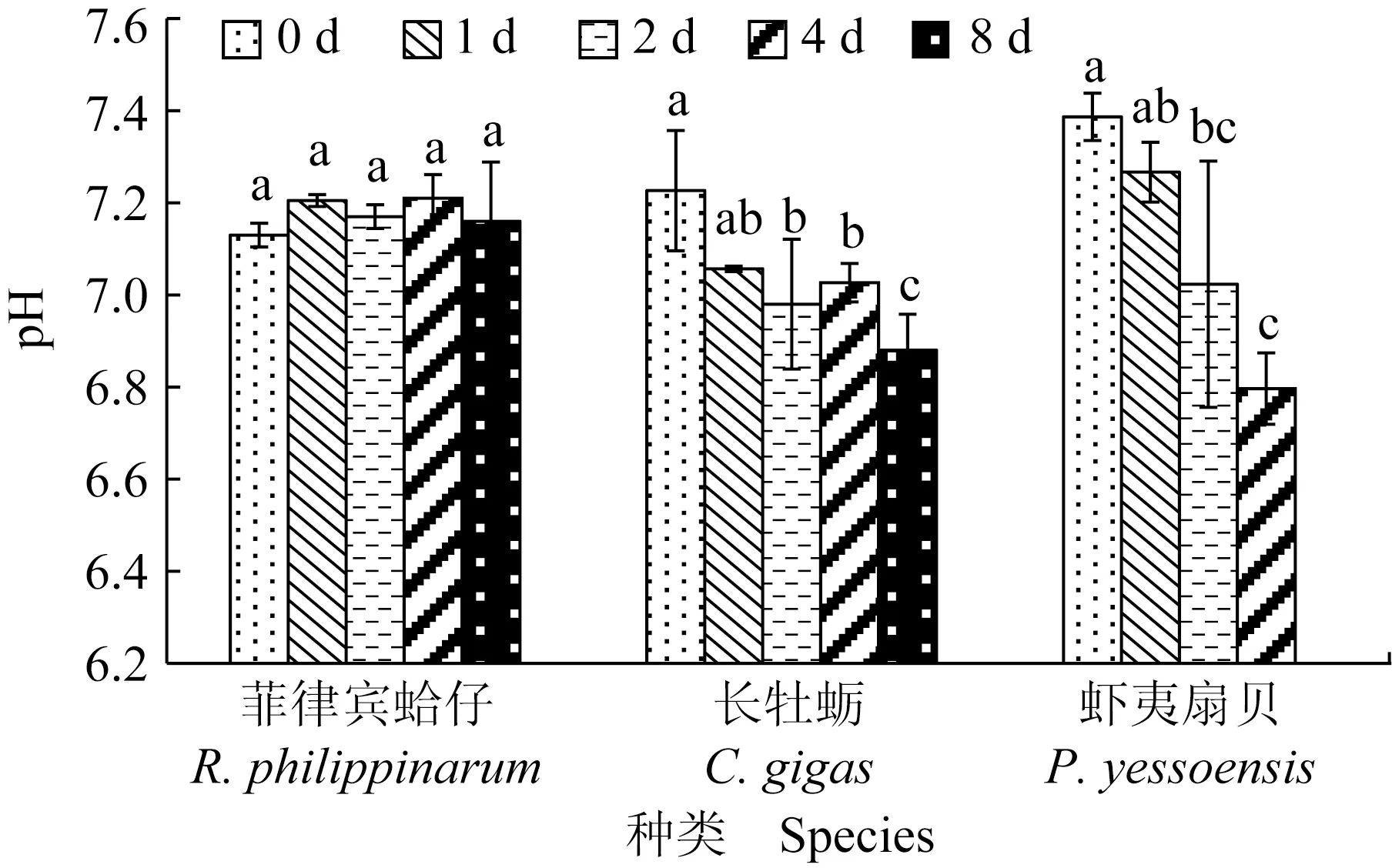
图1 3种双壳贝无水贮藏条件下pH的变化Fig.1 Changes in pH in three kinds of bivalves under air-exposure storage conditions同组内标有不同的字母表示有显著性差异(P<0.05),标有相同字母表示无显著性差异(P>0.05),下同.The means with different letters in the group are significant differences (P<0.05),and those with the same letter are no significant differences (P>0.05),et sequentia.
2.2 肌肉糖原
菲律宾蛤仔、长牡蛎、虾夷扇贝在无水贮藏过程中糖原含量变化见图2,初始糖原含量分别为23.1、7.8、36.5 mg/g,虾夷扇贝糖原含量最高,其次是菲律宾蛤仔,长牡蛎最低。无水贮藏过程中,3种贝糖原含量均呈下降趋势,8 d后分别降至7.3、2.3 mg/g和12.2 mg/g,虾夷扇贝下降最明显。
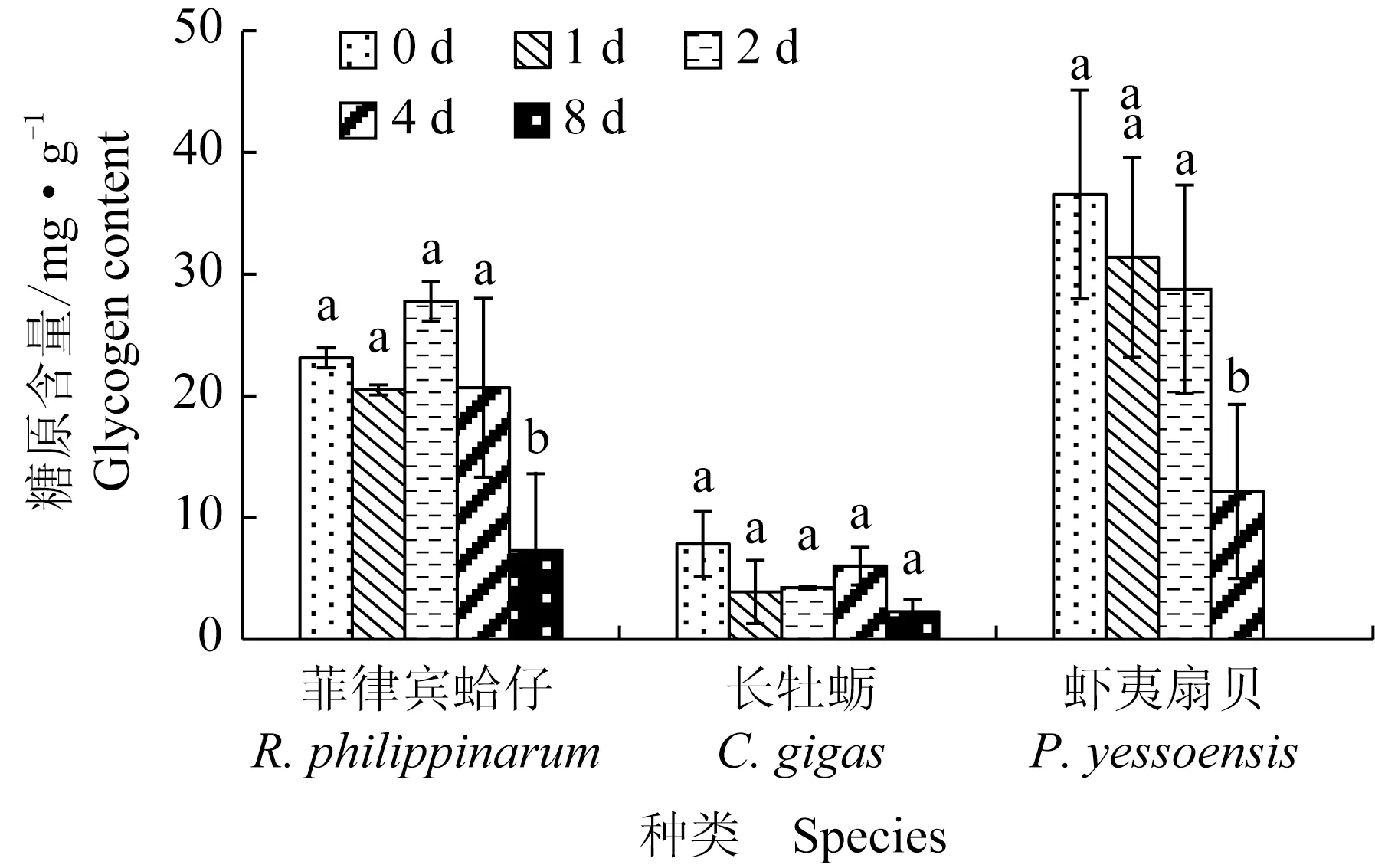
图2 3种双壳贝无水贮藏条件下糖原含量的变化Fig.2 Changes in glycogen content in three species of bivalves under air-exposure storage conditions
2.3 ATP及其关联物
菲律宾蛤仔、长牡蛎、虾夷扇贝在无水贮藏过程中ATP及其相关化合物含量变化见图3,初始ATP含量分别为0.41、0.42 μmol/g和4.05 μmol/g,腺苷二磷酸(ADP)含量分别为0.77、2.35 μmol/g和0.38 μmol/g,菲律宾蛤仔和长牡蛎初始腺苷一磷酸(AMP)含量分别为1.35、2.14 μmol/g,虾夷扇贝在初始点没有AMP产生。无水贮藏过程中,菲律宾蛤仔和长牡蛎ATP含量无显著变化,虾夷扇贝ATP含量在第2天显著下降并在第4天降至1.91 μmol/g。长牡蛎和菲律宾蛤仔ADP含量和AMP含量无显著变化,虾夷扇贝均呈现上升趋势。
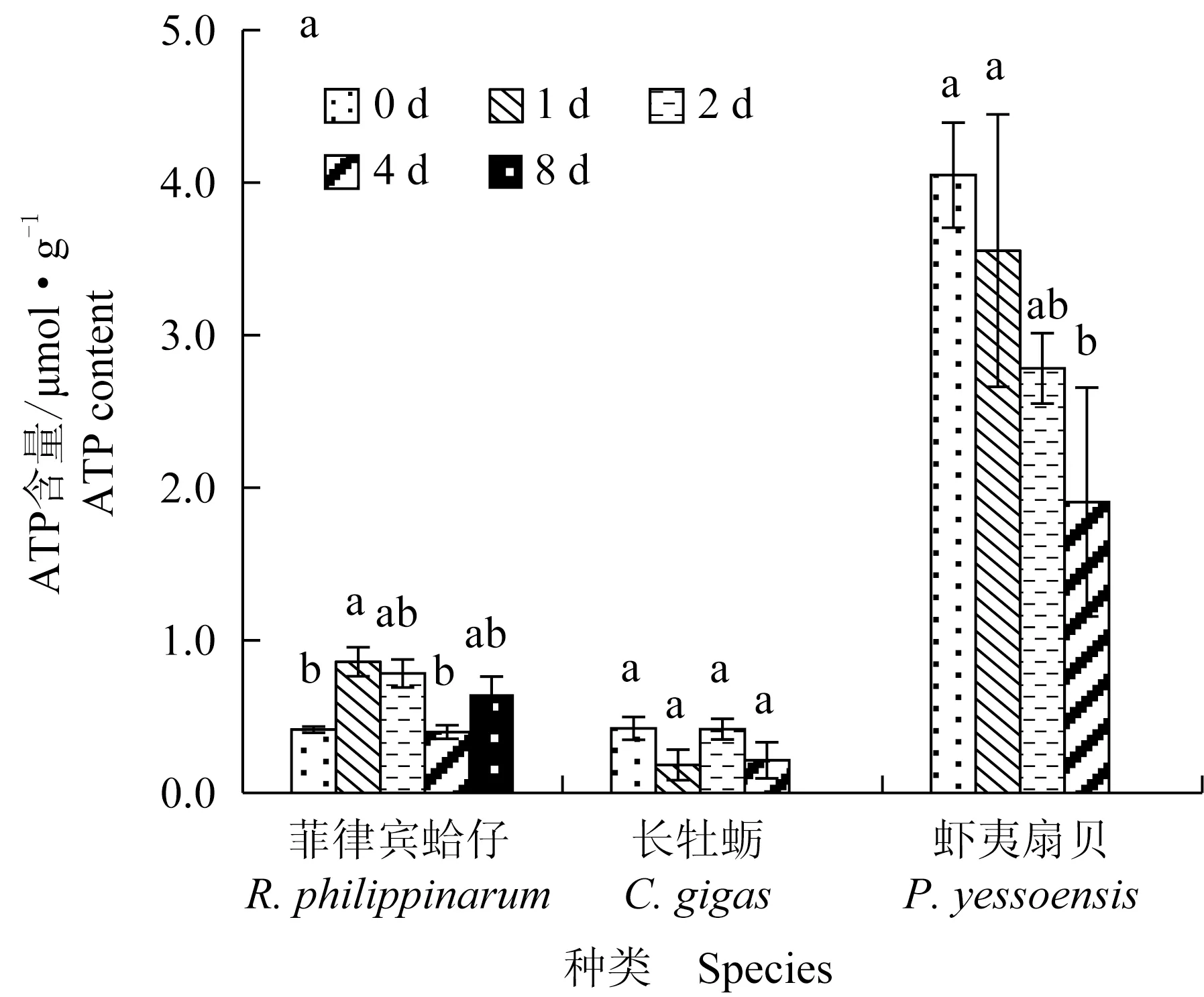
图3 3种双壳贝无水贮藏条件下ATP关联化和物含量变化Fig.3 Changes in ATP and related compounds in three species of bivalves under air-exposure storage conditions
2.4 磷酸精氨酸
菲律宾蛤仔、长牡蛎、虾夷扇贝在无水贮藏过程中磷酸精氨酸含量变化见图4,虾夷扇贝初始磷酸精氨酸含量为4.05 μmol/g,明显高于菲律宾蛤仔,在牡蛎闭壳肌中未检测到磷酸精氨酸。菲律宾蛤仔磷酸精氨酸含量在无水贮藏过程中无明显变化,虾夷扇贝在第2天显著下降并在第4天降至0.65 μmol/g,无水贮藏过程中呈下降趋势。
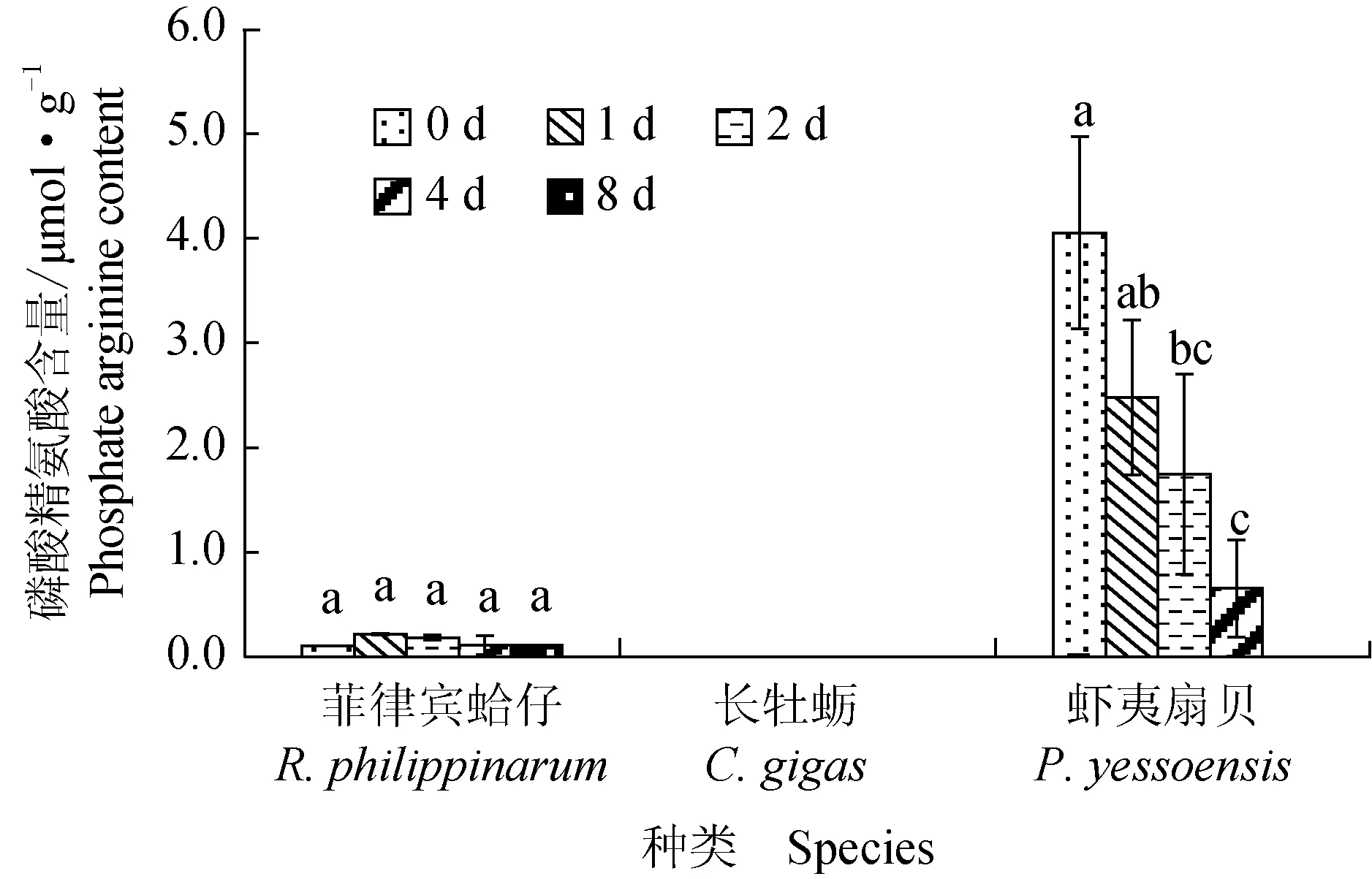
图4 3种双壳贝无水贮藏条件下磷酸精氨酸含量的变化Fig.4 Changes in arginine phosphate content in three species of bivalves under air-exposure storage conditions
2.5 奥品脱氢酶活性
菲律宾蛤仔、长牡蛎、虾夷扇贝在无水贮藏过程中奥品脱氢酶活性变化见表1,菲律宾蛤仔初始章鱼碱脱氢酶、strombine脱氢酶、alanopine脱氢酶、tauropine脱氢酶活性分别为355、32、44、12 mU/mg,无水贮藏过程中均无明显变化,其中章鱼碱脱氢酶活性远高于另外3种奥品脱氢酶。牡蛎闭壳肌中没有检测到章鱼碱脱氢酶活性,初始strombine脱氢酶、alanopine脱氢酶、tauropine脱氢酶活性分别为76、59、9 mU/mg,strombine脱氢酶和alanopine脱氢酶活性高于tauropine脱氢酶活性,无水贮藏过程中均呈上升趋势。虾夷扇贝初始章鱼碱脱氢酶、strombine脱氢酶、alanopine脱氢酶、tauropine脱氢酶活性分别为1090、28、77、64 mU/mg,其中章鱼碱脱氢酶活性最大,并且和胁迫强度呈现正相关性。
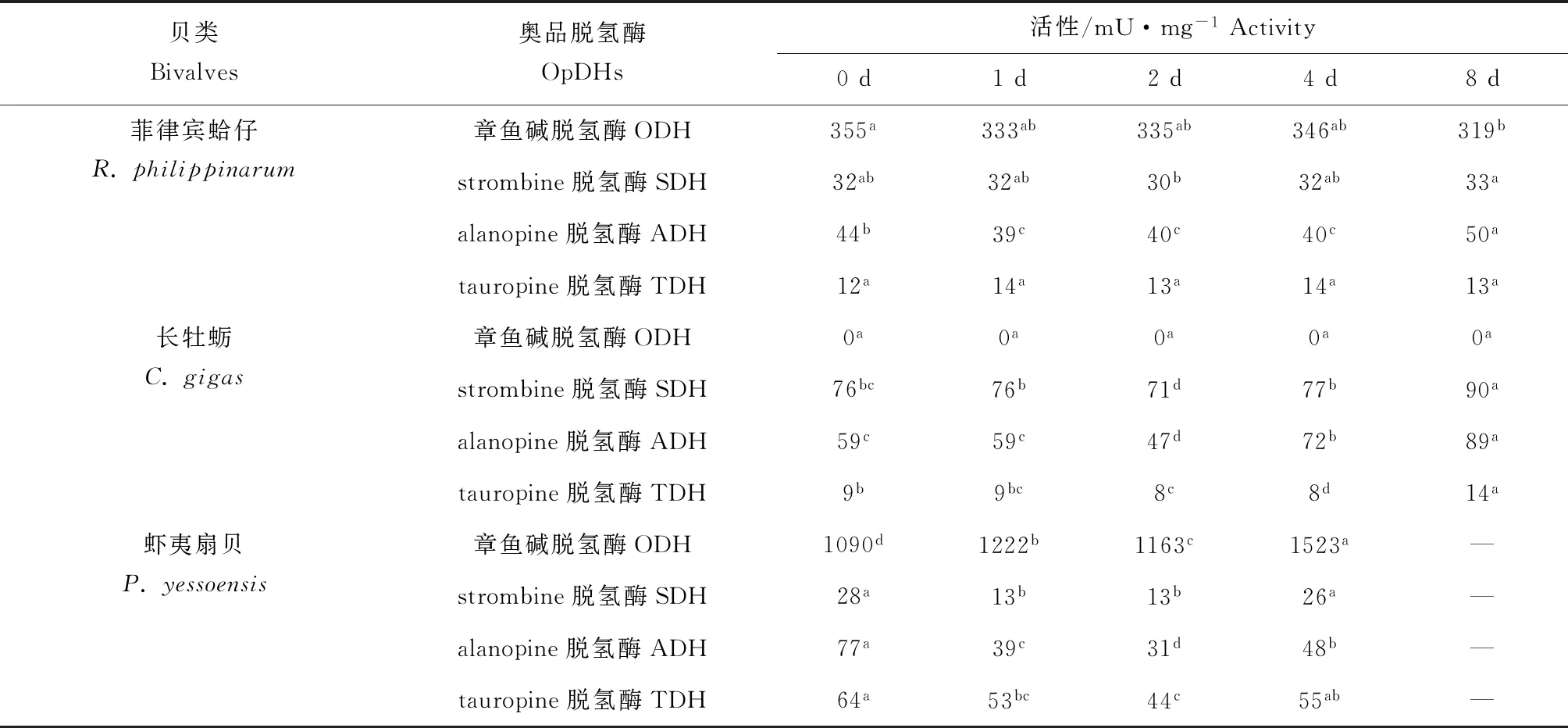
表1 3种双壳贝无水贮藏条件下奥品脱氢酶活性变化Tab.1 Changes in the dehydrogenase activity of opine in three species of bivalves under air-exposure storage conditions
2.6 主成分分析
综合菲律宾蛤仔、长牡蛎、虾夷扇贝无水贮藏过程各理化指标进行主成分分析(图5)。前2个主成分的累计贡献率为99.7%,反映了原指标的大部分信息。3种贝大致分为3个区域,其中,菲律宾蛤仔(R)聚集在图片下侧,虾夷扇贝(P)和长牡蛎(C)分别聚集在图片左上侧和右侧。无水贮藏8 d内,长牡蛎各指标变化不明显,而虾夷扇贝和菲律宾蛤仔分别在第4天(P-4)和第8天(R-8)发生显著性变化。
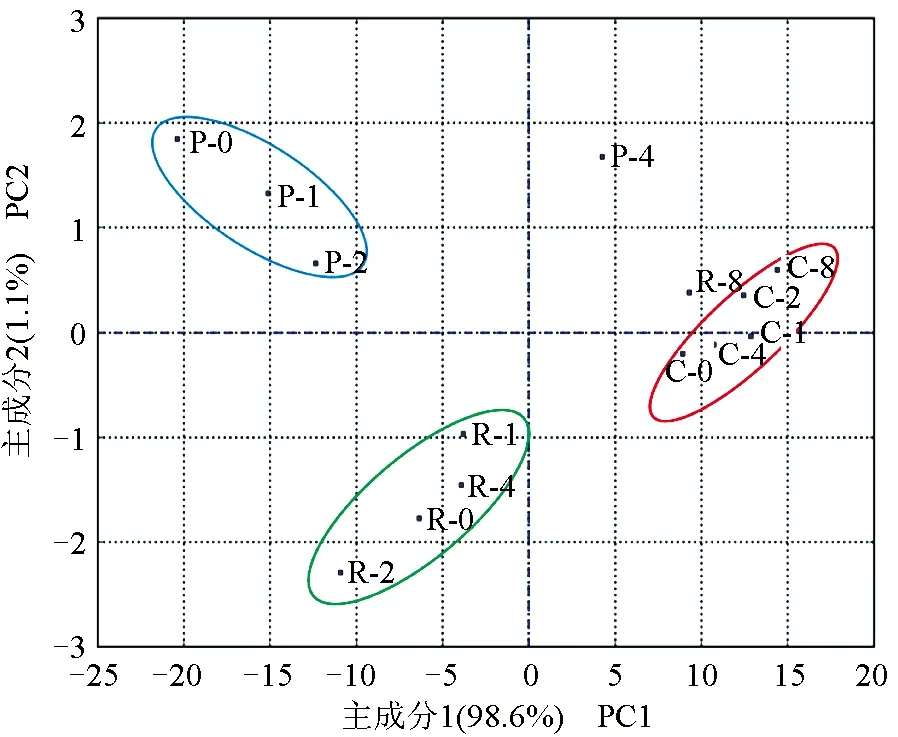
图5 3种双壳贝无水贮藏条件下主成分分析得分图Fig.5 Principal component analysis (PCA) scores of three species of bivalves under air-exposure storage conditions
3 讨 论
3.1 活力变化
捕后尽可能维持贝类生活相近的条件,对于维持其品质至关重要。但是考虑到贮运成本,无水贮藏是最经济和常用的贮藏手段。目前,活贝捕后贮运方案更多依据感官经验进行,缺乏理论支撑。本试验结果显示,捕后干露胁迫对菲律宾蛤仔、虾夷扇贝、长牡蛎的影响有较大差异,生产中需要建立品种针对性的贮运方案。
首先,3种贝肌肉中糖原的初始含量差异明显。虾夷扇贝的运动方式与菲律宾蛤仔和牡蛎不同,如可以通过横纹肌快速收缩进行游泳以躲避海星等捕食者等。因此虾夷扇贝横纹闭壳肌中储备了更多的糖原[12-13]。此外有研究表明,季节对虾夷扇贝糖原含量存在较大影响,其中8月左右糖原含量最高,而3月最低,ATP含量季节变化趋势和糖原含量变化趋势保持一致,这与其生殖周期密切相关[14]。ATP是一种高能磷酸化合物,可以为细胞各项生命活动提供能量。无水贮藏过程中氧气不足导致ATP合成效率下降。为了维持机体代谢,磷酸精氨酸作为无脊椎动物体内一种重要的能量储备,能够在磷酸精氨酸激酶的作用下将ADP转化成ATP,给机体提供一个ATP的缓冲库,从而保证机体的能量供应处于平衡状态[15-17],因此,虾夷扇贝闭壳肌具有更高的ATP和磷酸精氨酸水平。推测这种差异可能与3种贝的生活习性息息相关,在天然环境中,长牡蛎主要附着在其他物体上,菲律宾蛤仔一般埋栖在泥沙中,两种贝均不需要消耗太高的能量。Storey[18]研究表明,牡蛎闭壳肌中存在磷酸精氨酸,在面临缺氧时,组织中磷酸精氨酸储量的减少和AMP含量的增加,加上低pH条件下磷酸精氨酸Ki值的增加,可以激活磷酸果糖激酶,帮助维持厌氧能量的生成。本试验长牡蛎闭壳肌中未检测到磷酸精氨酸,可能与长牡蛎在采捕过程中经历了较大的胁迫有关。同时虾夷扇贝对胁迫产生的反应最激烈,无水贮藏过程中能观察到外壳的频繁闭合活动,其结果导致糖原在短时间内大量消耗,在无水贮藏第4天,肌肉中糖原含量消耗过半,随着磷酸肌酸和糖原逐渐耗尽,肌肉中的ATP迅速降解成ADP和AMP等物质,磷酸精氨酸也伴随着ATP的消耗而急剧下降,在无水贮藏第2天产生AMP并且磷酸精氨酸显著下降,郑尧[19]也发现类似现象。其次,菲律宾蛤仔在无水贮藏期间也能观察到外壳的开闭行为,无水贮藏第8天时,糖原也出现较大消耗。牡蛎无水贮藏过程几乎都处于外壳紧闭状态,无水贮藏8 d内几乎未检测到糖原的消耗。菲律宾蛤仔和牡蛎无水贮藏期间ATP一直维持在较低水平,没有显著变化。
3.2 代谢途径
无氧代谢过程中,糖原进行无氧糖酵解生成ATP来为机体提供能量,此时ATP通过底物水平磷酸化而产生,NADH也在此过程中产生。为确保甘油醛-3-磷酸继续氧化,糖酵解继续进行,需要将NADH再氧化成NAD+。脊椎动物主要依靠乳酸脱氢酶发挥作用,而在海洋无脊椎动物中,不仅存在乳酸脱氢酶[20],还存在奥品脱氢酶发挥同样的作用[6]。并且,大多数海洋无脊椎动物的总奥品脱氢酶活性超过了乳酸脱氢酶活性[8]。在海洋无脊椎动物体内含有丰富的游离氨基酸,为细胞内奥品脱氢酶提供充足的反应底物[21-22]。奥品途径相较于乳酸途径的另一个优势在于其终产物奥品在改变细胞内pH的程度上要比乳酸小的多,因此细胞内渗透压更容易维持恒定[23]。而不同贝类面临缺氧时代谢途径存在差异,在绝大多数贝类中,章鱼碱脱氢酶活性远高于其他奥品脱氢酶[7],如Haliotislamellosa[24]、Solenmarhinatus[25]等,也有少数贝类alanopine脱氢酶和strombine脱氢酶活性较高,如文蛤(Meretrixlusoria)[8]等。本试验结果表明,在无水贮藏过程中菲律宾蛤仔和虾夷扇贝章鱼碱脱氢酶活性均高于另外3种奥品脱氢酶,而由于面临缺氧时代谢途径不同,在长牡蛎闭壳肌中未检测到章鱼碱脱氢酶活性,相应的alanopine脱氢酶和strombine脱氢酶活性较高。从酶活性应答可发现,物种不同导致奥品脱氢酶分布不同,不同贝类面对缺氧胁迫时奥品脱氢酶活性应答情况存在差异,各自应答机制不同[26]。在天然环境中,由于潮汐作用,菲律宾蛤仔和长牡蛎经常面临干露胁迫,导致这两种贝类进化出了更强的无氧呼吸能力,菲律宾蛤仔章鱼碱脱氢酶活性在无水贮藏前4 d较稳定,在无水贮藏第8天显著升高。而由于代谢途径的不同,长牡蛎闭壳肌中alanopine脱氢酶和strombine脱氢酶活性较高,且在无水贮藏第8天显著升高,表现出较好的耐干露特性。在无氧代谢过程中,一些有关能量代谢的小分子代谢产物,会抑制奥品脱氢酶活性,比如ATP,作为生物体内重要的高能磷酸化合物就对章鱼碱脱氢酶展示出一定的抑制作用[27],琥珀酸作为无氧代谢产物之一,对alanopine脱氢酶展示出一定的抑制作用[28]。另外,有研究发现,奥品脱氢酶活性在贝类肌肉组织中较高,并远高于其他组织,因为在贝类肌肉组织中,环境型无氧代谢和功能型无氧代谢同时存在。另外贝类的闭壳肌在逃离天敌、追捕猎物等过程中起到重要作用,ATP在短时间内大量消耗,无氧代谢会产生一定的ATP,提供部分能量[25]。无氧代谢产生的酸性奥品化合物会使pH降低[29],导致品质下降。
4 结 论
在4 ℃条件下无水贮藏过程中,3种贝应对无水胁迫的代谢途径存在差异,虾夷扇贝和菲律宾蛤仔以章鱼碱脱氢酶代谢途径为主,而长牡蛎以alanopine脱氢酶和strombine脱氢酶代谢为主。并且3种贝表现出不同的干露耐受性,长牡蛎至少在8 d内可保持较好的品质,而菲律宾蛤仔、虾夷扇贝耐受时间为4、2 d。在捕后流通过程中,应根据耐受性的不同建立品种针对性流通方案。

