术前血液炎性指标及临床特征与直肠癌肺转移患者预后的关联
朱静雅,苏日新,葛菁茹,罗会芹,吴书胜,何义富,
结直肠癌是全球第3大恶性肿瘤,死亡率在中国排名第5位,其恶性程度高,预后与能否行根治性手术、TNM分期和远处转移等有关。既往研究大多将结肠癌与直肠癌视为一类肿瘤,然而2者的转移倾向、治疗方式以及预后相关因素均有所不同,因此许多文献建议将结肠癌与直肠癌视为2种不同类型的肿瘤予以研究。既往研究发现,结肠癌较直肠癌更易发生肝转移(13.8%vs12.3%),而肺转移在直肠癌中更为多见(5.6%vs3.7%)[1-4],因此进一步研究直肠癌肺转移的临床病理特征具有重要的临床意义。有研究对直肠癌肺转移患者的临床特征及相关危险因素进行分析,结果发现原发肿瘤部位、淋巴结转移以及远处转移是直肠癌肺转移患者预后的独立影响因素[5]。近年来,越来越多的证据也提示炎症在直肠癌的发生和发展中具有重要作用[6-7],中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)和血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)作为常用的评估全身炎症状况的指标,在多种肿瘤中被证实与预后相关[8-13]。国内目前有关直肠癌肺转移的研究较少,因此本研究旨在探讨直肠癌肺转移患者术前NLR和PLR对直肠癌肺转移患者预后的意义,以期为临床评估和诊疗提供证据。
1 资料与方法
1.1 病例选择标准
(1)病理诊断为腺癌;(2)无其他合并肿瘤;(3)术前无放疗或化疗史,均接受过直肠癌根治术(包括保肛及造瘘2种手术方式);(4)术后病理分期明确;(5)临床分期为Ⅱa~Ⅲc期;(6)有辅助化疗指征,术后均接受2~6个周期的辅助化疗(化疗方案以奥沙利铂为基础);(7)接受术后放疗,单次放疗剂量为1.8~2.0 Gy,总剂量为45 Gy,放疗25~28次;(8)术后发生肺转移;(9)无血液学和免疫系统疾病及病毒感染,未长期接受糖皮质激素治疗。
回顾性收集2016年1月1日—2018年12月31日在安徽医科大学附属省立医院接受诊治的181例直肠癌肺转移患者的临床病历资料,包括首诊时间、直肠癌确诊时间、手术时间、原发肿瘤部位(将上段直肠癌定义为直肠肿瘤下缘距离肛缘≥7 cm,将下段直肠癌定义为直肠肿瘤下缘距离肛缘<7 cm)、直肠肿瘤大小及浸润深度、至肺转移时间(time to lung metastasis,TLM)、术后是否接受放疗、局部淋巴结有无转移、病理分型、TNM分期、有无胸腔积液或腹腔积液、吸烟史以及RAS/BRAF基因状态等。最终纳入104例符合病例选择标准的直肠癌肺转移患者。
本研究获得安徽医科大学附属省立医院伦理委员会的批准。
1.2 随访
采用电话、短信、门诊及住院方式进行随访,随访时间截至2021年1月30日。将确诊为直肠癌的时间至死亡或末次随访时间定义为总生存(overall survival OS)期。将确诊为直肠癌的时间至发现肺转移的时间定义为TLM。
1.3 观察指标
术前1周内血液学指标,包括中性粒细胞计数、淋巴细胞计数、血小板计数、癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9),计算NLR和PLR。
1.4 统计学方法
应用SPSS 22.0软件进行统计学分析。根据治疗前血液学参数构建受试者工作特征(receiver operating characteristic curve,ROC)曲线以确定NLR、PLR、CEA和CA19-9预测直肠癌肺转移患者预后的最佳截断值。曲线下面积(area under the curve,AUC)评估诊断价值。生存分析采用Kaplan-Meier法,生存比较采用log-rank检验。预后的多因素分析采用COX回归,应用逐步向前法进行模型拟合。应用GraphPad prism 8.0软件对预后数据进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征与OS和TLM的关系
104例直肠癌肺转移患者的临床特征见表1,中位生存期为43.25个月,中位TLM为21.43个月。术后第1、2、3、4和5年的肺转移发生率分别为22.12%、28.85%、23.00%、10.58%和4.80%,提示肺转移主要发生于术后前3年。
单因素分析结果显示,直肠癌肿瘤部位、肿瘤分化程度、远处淋巴结转移、T分期和N分期均与OS相关(P<0.05),而年龄、性别、放疗、胸腔积液或腹腔积液以及RAS和BRAF基因突变均与OS无关(P>0.05),见表1。下段直肠癌、T3-4期、N2期、低分化腺癌以及远处淋巴结转移患者的TLM显著较短(P<0.05),而性别、年龄、放疗、胸腔积液或腹腔积液以及RAS和BRAF基因突变均与TLM无关,见表1。
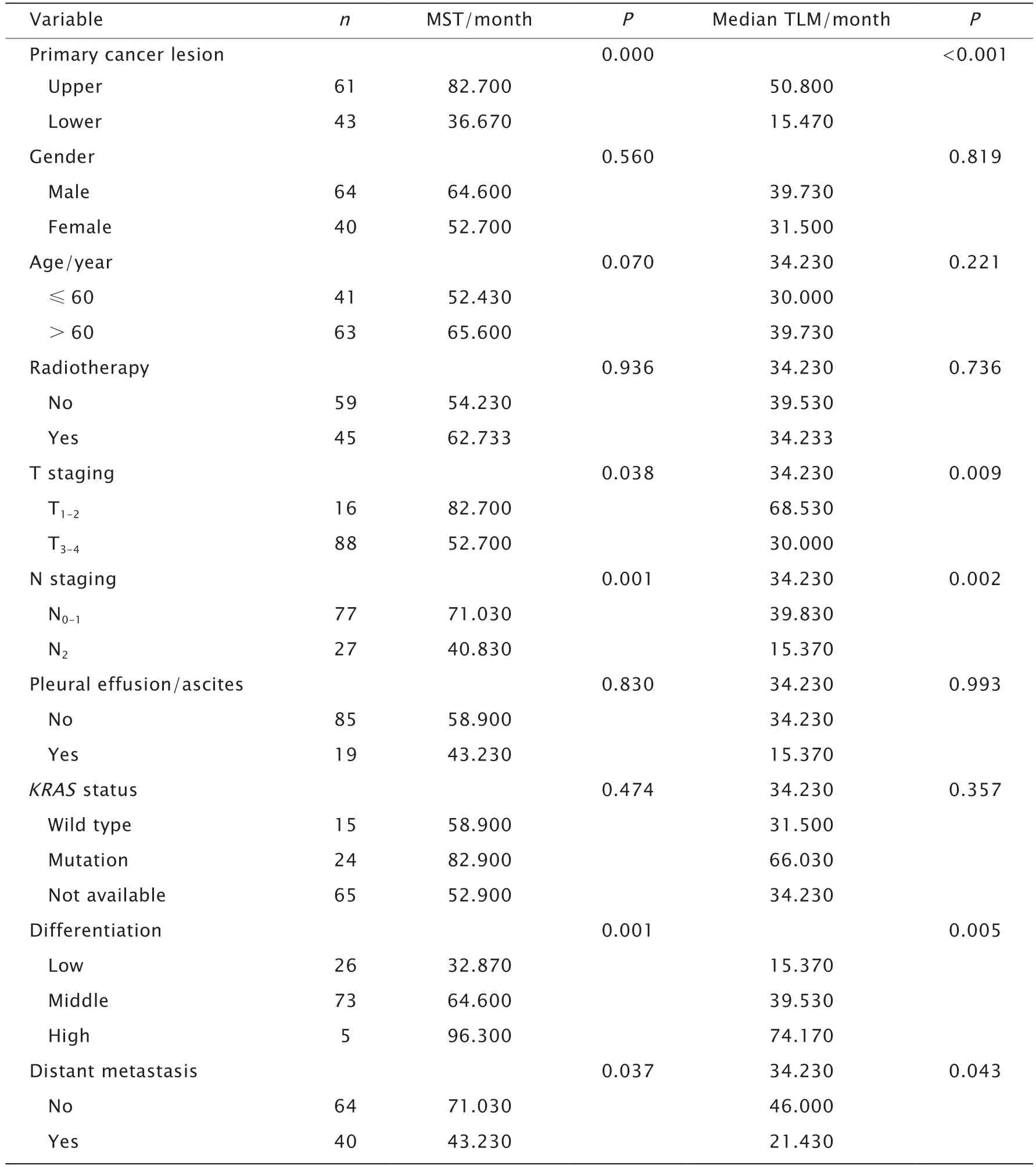
表1 104例直肠癌肺转移患者OS和TLM的单因素分析Table Univariate analysis of OS and TLM of 104 patients with lung metastasis of rectal cancer
多因素分析结果显示,直肠癌肿瘤部位、肿瘤分化程度、T分期和N分期是直肠癌肺转移患者OS的独立危险因素(P<0.05),见表2。直肠癌肿瘤部位、肿瘤分化程度和T分期是直肠癌肺转移患者TLM的独立危险因素(P<0.05),见表3。

表2 104例直肠癌肺转移患者OS的多单因素分析Table 2 Multivariate analysis of OS of 104 patients with lung metastasis of rectal cancer

表3 104例直肠癌肺转移患者TLM的多单因素分析Table 3 Multivariate analysis of TLM of 104 patients with lung metastasis of rectal cancer
2.2 直肠癌肺转移患者术前NLR、PLR、CEA和CA19-9与OS和TLM的相关性
104例患者中,55例患者的基线病历资料完整,因此对其术前NLR、PLR、CEA和CA19-9进行分析。同时纳入20例年龄匹配的健康志愿者,收集一般资料和血液学检测指标,结果发现直肠癌肺转移患者术前NLR(2.95±1.63vs1.99±0.85,P<0.05)、PLR(167.72±95.58vs125.96±59.17,P<0.05)和MPV(11.09±1.27vs10.31±1.26,P<0.05)均显著高于健康志愿者。采用ROC曲线确定NLR、PLR、MPV、SII、CEA和CA19-9预测直肠癌肺转移患者预后的最佳截断值,结果显示NLR的最佳截断值为2.690(AUC为0.711),PLR的最佳截断值为183.980(AUC为0.724),MPV的最佳截断值为13.550(AUC为0.384),SII的最佳截断值为357.470(AUC为0.337),CEA的最佳截断值为29.435(AUC为0.663),CA19-9的最佳截断值为56.040(AUC为0.625)(图1)
以最佳截断值为界,分成2组。术前高NLR、PLR、CEA和CA19-9的直肠癌肺转移患者的OS和TLM均较差(P<0.05);术前高MPV的直肠癌肺转移患者的OS明显缩短(P<0.05),但对TLM无显著影响(P>0.05);术前SII则与直肠癌肺转移患者的OS和TLM均无关(P>0.05),见表4和图2。

表4 55例直肠癌肺转移患者术前NLR、PLR、MPV、SII、CEA和CA19-9水平与OS和TML的关系Table 4 Relationship between preoperative NLR,PLR,MPV,SII,CEA and CA19-9 levels with OS and TML in 55 patients with lung metastasis of rectal cancer
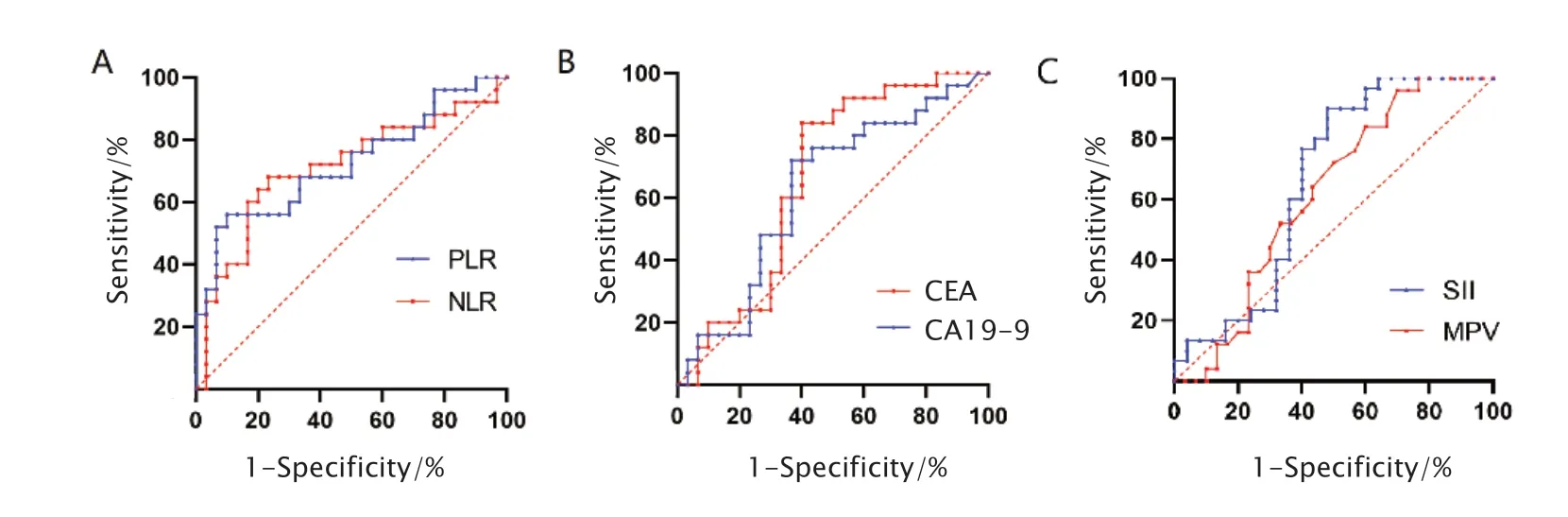
Fig.1 The receiver operating characteristic (ROC) curve was constructed according to the hematological indexes before treatment to determine neutrophil to lymphocyte ratio (NLR),platelet to lymphocyte ratio (PLR),carcinoembryonic antigen (CEA),carbohydrate antigen 19-9 (CA19-9),systemic immune inflammation index (SII) and mean platelet volume (MPV) to determine the best cutoff values for predicting the prognosis of patients with lung metastasis of rectal cancer.图1 ROC曲线确定NLR、PLR、CEA、CA19-9、SII和MPV预测直肠癌肺转移患者预后的最佳截断值

Fig.2 Relationship between preoperative NLR,PLR,CEA and CA19-9 levels and OS and TLM in patients with lung metastasis of rectal cancer.OS:Overall survival;TLM:Time to lung metastasis;NLR:Neutrophil to lymphocyte ratio;PLR:Platelet to lymphocyte ratio;CEA:Carcinoembryonic antigen;CA19-9:Carbohydrate antigen 19-9 (CA19-9).图2 术前NLR、PLR、CEA和CA19-9水平与直肠癌肺转移患者OS和TLM的关系
3 讨论
直肠癌是中国常见的恶性肿瘤之一,其发生率和死亡率均较高[14]。研究显示直肠癌较结肠癌更容易发生肺转移[1,3]。SAKORAFAS等[15]认为,这可能与直肠静脉引流有关,直肠上2/3的静脉引流是由直肠上静脉引流至门静脉而入肝脏,下1/3的静脉引流是由直肠中下静脉引流至全身进而到达肺脏。研究发现,下段直肠癌较上段直肠癌更易出现肺转移[16],本研究结果验证了这一结论(P<0.05)。AUGESTAD等[17]还发现,直肠癌原发肿瘤部位与单肺或双肺转移无关,尚待进一步探讨。
HAWKES等[18]研究发现,对于可切除的直肠癌肺转移患者,给予适当的围手术期化疗可能会提高生存率。由于本研究纳入的病例数较少,因此尚不能分析围手术期化疗方案对患者预后的影响,今后可以扩大样本量以进一步探讨。此外,初发肺转移往往缺乏特征性的临床症状,影像学仅表现为不典型的肺结节,后期随访观察结节变化以评估是否是肺转移[19]。本研究发现,直肠癌术后第1、2、3、4和5年的肺转移发生率分别为22.12%、28.85%、23.00%、10.58%和4.80%,提示肺转移主要发生于术后前3年,这与LEE等[20]的研究结果一致。因此,直肠癌术后3年是肺转移的高危时期,在此期间密切观察肺部情况,有助于早期发现肺转移。有研究发现,KRAS基因突变状态是直肠癌肺转移的危险因素[21],KRAS野生型的直肠癌患者更倾向于发生肝转移;而与结肠癌相比,无论KRAS基因状态如何,直肠癌都更倾向于肺转移[22]。本研究还发现,术前高水平CEA和CA19-9是OS和TLM的不良预后因素(P<0.05),这与既往研究的结果一致[23-25]。
炎症是结直肠癌发生的危险因素[6],始终伴随结直肠癌的发生和发展。炎症与免疫反应之间存在相互促进、相互制衡的微妙关系[7]。有效的炎症依靠机体的免疫系统和免疫力,在治疗反应或抗性发展中发挥积极的作用[26],但是如果无法控制炎症,就会介导机体免疫系统产生各种不良反应。有研究表明,炎性细胞和细胞因子可能促进肿瘤的生长和进展以及免疫抑制[27]。一般认为,中性粒细胞具有促癌作用,淋巴细胞具有抗肿瘤作用,并且介导宿主的免疫反应;血小板被认为可以调节新血管生成,帮助循环肿瘤细胞逃避免疫监视,从而促进肿瘤的发生和发展[28]。NLR和PLR是常用的人体炎症指标。已有研究证实,术前NLR和PLR[29-30]升高是预后不良指标。CARRUTHERS等[31]报道,高NLR是OS和无进展生存的独立不良预后因素,而PLR与直肠癌患者的生存无显著相关性。KE等[32]分析了184例接受新辅助放化疗的直肠癌患者,发现高NLR与更差的OS和无进展生存显著相关,而高PLR只与更差的无进展生存显著相关。此外,一项荟萃研究表明,高PLR与较差的无进展生存和OS有关[33]。本研究显示,术前高NLR和PLR与更差的OS和TLM相关,由此可能反映了肿瘤患者体内的炎症不仅不能产生有效的抗肿瘤反应,反而会加速肿瘤进展。术前中性粒细胞和血小板计数相对升高或淋巴细胞计数相对降低都可以导致NLR和PLR升高,由此表明机体处于较低的抗肿瘤免疫应答状态与肿瘤具有较强的侵袭能力有关。在大多数研究中,高NLR被认为与不良反应和预后不良有关。然而,也有学者报告未发现术前NLR与病理完全缓解和预后相关[34]。因此,目前对于NLR和PLR与预后的关系尚存在争议。此外,本研究发现术前高MPV与较差的OS有关(P<0.05)。众所周知,大血小板比小血小板具有更强的活性,目前认为大血小板是参与炎症过程的关键分子,持续的炎症状态导致肿瘤细胞凋亡显著受抑,肿瘤细胞增殖和血管生成增加[35]。因此,从临床角度考虑,MPV对肿瘤患者的预后具有一定的预测意义[36]。然而,由于MPV在临床实践中的应用较少,因此尚需进一步研究。最后,本研究尚存在一些局限。首先,本研究的样本量较小且来自单中心,可能会影响本研究的结果。其次,本研究为回顾性研究,没有考虑一些合并症可能影响血液学参数。
综上所述,直肠癌肺转移主要发生在术后3年,原发肿瘤部位、分化程度、术前高NLR、PLR、CEA和CA19-9水平[37]可能是直肠癌肺转移患者预后的独立危险因素。

