小麦籽粒植酸含量聚类及相关基因位点研究
陈广凤,李冬梅,邓志英,冯建英,郑世英,郑 芳,吴秀芬,田纪春✉
(1.德州学院 生态与资源环境学院,山东 德州 253000;2.山东农业大学 农学院,小麦品质育种研究室,作物生物学国家重点实验室,山东 泰安 271018)
小麦种质资源是小麦育种的主要亲本来源,是培育高产、优质和高抗小麦新品种的重要物质基础。随着社会经济发展和生活水平进一步提高,健康和营养已成为近十年我国小麦品质研究的主题,培育特色功能性小麦新品种是小麦育种专家近几年来的重要育种目标。
目前,微量营养元素铁、锌等缺乏造成的营养不良非常严重。全世界约20亿人患有不同程度的贫血,其中约12%由缺铁所致,我国的缺铁性贫血发病率为20%左右,贫困地区儿童和孕妇则高达45%和35%[1]。小麦是我国北方地区的主要粮食作物,提高人体对小麦籽粒中矿物质元素铁、锌等的吸收利用,对于解决我国人民由于铁、锌等元素含量摄入不足造成的健康问题具有重要意义[2-3]。影响铁、锌等生物有效性的限制性因子包括植酸、纤维素、丹宁和重金属等,以植酸最为重要[4-5]。小麦籽粒中植酸含量较为丰富,并且通过与矿物质元素铁、锌等正二价金属离子结合,形成螯合态植酸盐,显著降低人体对铁、锌等的吸收利用[6-7]。小麦种质资源是选育高产、优质和高抗小麦新品种的重要物质基础,小麦籽粒中植酸含量较为丰富,品种间籽粒植酸含量存在显著差异[8-9],并且含量受遗传因素和环境条件的共同作用[10]。因此,对小麦种质资源的深入研究,不仅能提高所选用育种材料的目标性,而且有利于提高育种科学预见性。自1921年Mellanby首次提出植酸对营养的影响以来,植酸与营养的关系一直是植酸研究的热点[11]。对其研究主要集中在低植酸玉米、大麦和水稻的研究,以期培育兼具营养和环保功能的新型低植酸作物[12-13]。李颖睿等[10]、吴澎等[14]和Liu等[8]曾对我国的地方品种和河南、山东、陕西、江苏和四川等少数地区的小麦品种进行了植酸含量分析。目前国内外对小麦中植酸的研究主要侧重于植酸对小麦生理功能的影响、植酸的抗营养效应、植酸对人和动物的影响和植酸的工业应用等方面[13]。
到目前为止,在遗传方面,关于小麦籽粒植酸含量的报导较少。何秋怡等[15]利用重组自交系群体定位到2个与植酸含量相关的QTL位点,分布在3B和3D染色体上。凡迪等[16]利用小麦重组自交系群体定位到 6个与籽粒植酸含量相关的位点,分布于 1B、2A、2B 和 6B 染色体上。总体来说,有关植酸含量分析的资料十分有限,中国冬麦区主要品种(系)的植酸含量尚不清楚。
本研究以中国冬麦区共 205份(包括 20世纪80年代以来的推广品种或骨干亲本 132 和高代品系73份)小麦种质资源为研究材料,测定其植酸含量进行聚类分析,并定位解析其单核苷酸多态性(SNP)标记关联位点,筛选出低植酸和高植酸种质资源,为中国冬麦区低值酸小麦品质育种提供优良的育种材料。
1 材料与方法
1.1 实验材料
205份供试材料,包括中国冬麦区20世纪80年代以来的推广品种或骨干亲本132份和高代品系73份,其中高代品系全部来自中国山东省。于2016和2017年度将供试材料种植于山东农业大学试验农场,每份材料种3行,2次重复,行长2 m,均匀播种70粒,行间距25 cm。常规田间管理,生长期间没有发生严重病虫害和倒伏。
高通量组织研磨机,SPEX GENO 2010 GRINDER:美国SPEX Sample Prep公司;酶标仪,SPECTRA max PLUS384:北京龙跃生物科技发展有限公司。
1.2 实验方法
1.2.1 表型鉴定
种子收获后,晒干储存于种子库中。试验时取每个小区的种子分别测定。用高通量组织研磨机磨粉。按 Chen等[17]的方法测定植酸含量,并适当改进。将30 mg全粉置于1.5 mL离心管中,加入0.4 mol/L HCl 1 mL和15%的TCA提取液,室温下振荡3 h,再以2 000×g离心10 min,然后取 50 μL上清液,置于 1.5 mL离心管中(内装36.3 mmol/L NaOH 550 μL);加入 200 μL 显色液(含0.03%氯化铁,0.3%磺基水杨酸),反应后取200 μL溶液,用酶标仪在500 nm下读数,测定植酸含量。
1.2.2 DNA提取和全基因组90k SNP芯片分型
参照略有改动的 Triticarte Pty.Ltd(http://www.triticarte.com.au/)方法提取供试材料群体DNA,用0.8%琼脂糖电泳检测DNA质量和浓度。委托美国加利弗尼亚大学戴维斯分校植物科学系生物技术检测中心,使用美国 Illumina公司和美国堪萨斯州立大学共同开发的小麦90k基因芯片(81 587个SNP)进行供试群体DNA的基因分型,利用 GenomeStudio 软件读取分型数据并以文本文件形式导出保存。用PLINK v1.07对获得的基因型数据进行质量控制,剔除检出率小于80%和低频基因频率小于 5%的 SNP标记,最终获得24 355个SNP用于植酸含量关联分析。
利用 Wang等[18]对 6个 DH遗传群体(BTSchomburgk AUS33384、Young AUS33414、Chara Glenlea、W7984×Opata M85、Sundor AUS30604和Westonia Kauz)进行图谱整合的位点信息,获得本研究群体 SNP 位点遗传信息(表 1)及整合复合遗传图谱[19]。
1.2.3 性状和标记的关联分析
应用TASSEL 3.0软件(http://www.maizegenetics.net/)中的MLM(mixed linear model)进行性状和标记之间的关联分析。利用Structure 2.3.1软件计算Q值,用TASSEL 3.0软件计算Kinship值,对群体结构和基因型过滤后,运行 MLM_Q+K模型进行关联分析,当标记的P≤0.001时认为标记与性状存在关联。
1.3 表型数据处理
采用 SAS(Statistical Analysis System)8.0 软件,将植酸含量数据分别按年度进行标准化后,以欧氏距离为标准,按 Ward 类平方和法分别对品种进行聚类。
2 结果与分析
2.1 205份种质资源小麦的植酸含量
两个种植年度环境植酸含量均值分别为4.99 g/kg和3.31 g/kg,变幅分别为17.90 g/kg和10.20 g/kg。结果表明,供试群体植酸含量变异范围较大,偏度和峰度绝对值接近 1,近似符合正态分布,表明植酸含量属于数量性状,通过品种筛选降低籽粒植酸含量的潜力较大(表2)。
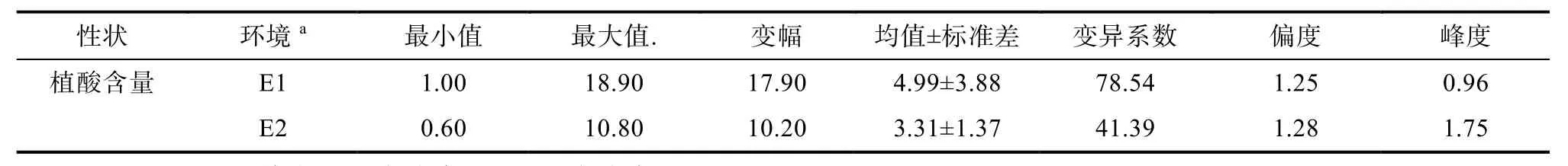
表2 供试群体小麦面粉植酸含量表型变异Table 2 Phenotypic variations of Phytic acid content in the wheat population
2.2 聚类分析
将供试群体所有品种的植酸含量数据按年度进行标准化,在决定系数(R2)为 85%水平将供试群体聚为6类(表3)。6类间植酸含量差异均达到极显著水平。其中,第2和第3类的品种数量较少(分别包括3个和2个品种),其次是第1类(包括15个品种)、第5类和第6类(分别包括24个和37个品种),第4类品种数量最多(包括124个品种)。第3类品种的平均植酸含量最高,为18.35 g/kg,其次是第2、1、5和6类,分别是15.35 g/kg、12.71 g/kg、8.10 g/kg 和 6.19 g/kg。第4类品种的平均植酸含量最低,为2.34 g/kg,显著低于其他5类。73个高代育种品系,除第2和3类没有分布之外,其它各类中都有均匀分布。

表3 205份小麦种质资源植酸含量聚类分析Table 3 Cluster of 205 cultivars based on Phytic acid content
第4类品种数量最多,包括124个品种,占群体百分比为60.49%,且平均植酸含量最低,为2.34 g/kg,表明该种质群体绝大多数品种植酸含量较低。并且第四类品种(系)变幅较小,在低植酸含量育种中具有较高的利用价值。其中,132个推广品种或骨干亲本中,B54、B40、B86和B126植酸含量最低,有可能成为重要的育种亲本,在低植酸含量小麦品质育种中发挥作用。高代品系 B131、B141、B181和 B149植酸含量最低,结合品系优异性状,有可能选育出低值酸含量功能性小麦新品种。
2.3 植酸含量全基因组关联位点
两个种植年度环境,共检测到36个与面粉植酸含量相关联的显著关联位点(P<0.001),分布在2B、3A、3B、3D、6A和 6B染色体上,单个关联位点表型变异贡献率为 5.73%~9.69%(表4,图1)。通过TASSELV3.0 软件分析,获得2个环境下面粉植酸含量全基因组关联分析的QQ图(图2),关联群体的群体结构得到了较好控制。E1环境检测到24个关联位点,其中,22个位点集中在3A染色体 85-91区段内,说明这个此区段内可能存在控制小麦面粉植酸含量的重要基因。另外两个位点分别分布在染色体3B和3D上,3D染色体上位点,Tdurum_contig35799_208,达到极显著关联水平(2.27×10-5)。E2环境检测到12个关联位点,分布在2B、3B、6A和6B染色体上,其中,4个位点集中在3B染色体同一位置,各有3个位点分别集中在6A和6B的同一位置上,说明染色体上这些区段是控制小麦籽粒植酸含量基因的重要区段。

表4 植酸含量关联位点及其对表型变异的贡献率(R2)Table 4 Loci associated with Phytic acid content and percentage of phenotypic variation explained (R2)
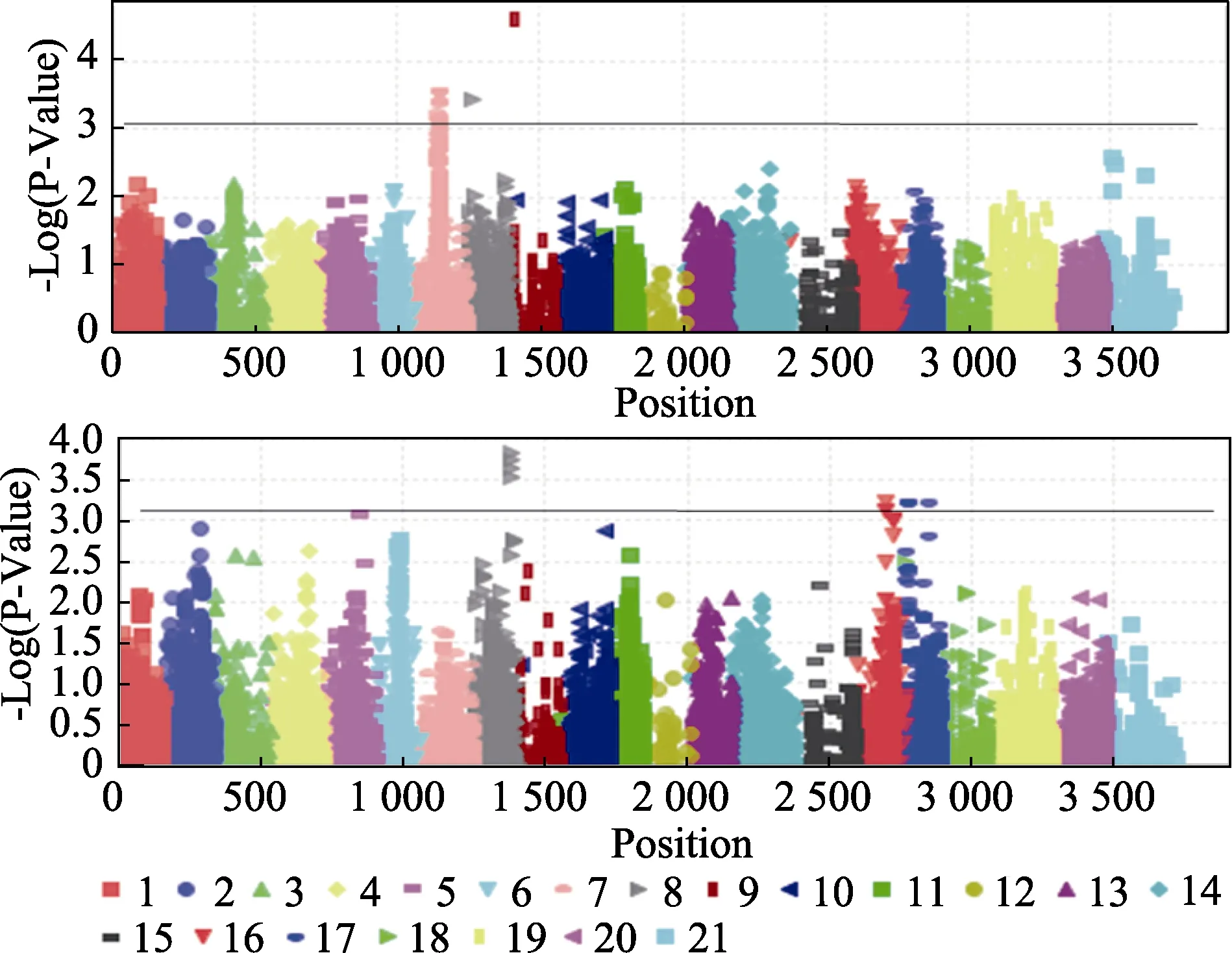
图1 植酸含量全基因组关联分析曼哈顿图Fig.1 Manhattan plot for Phytic acid content in two environments

图2 植酸含量全基因组关联分析QQ图Fig.2 Quantile-quantile plot for Phytic acid content in two environments
2.4 关联位点优异等位变异
两个种植年度环境中共检测到36个关联位点,其携带不同等位变异品种的植酸含量表型差值为 0~0.98 g/kg。其中,不同等位变异品种的表型差值达到显著性差异水平的位点共25个,E1环境19个位点,E2环境 6个位点,品种间表型差值为0.33~0.98 g/kg(表5)。在E1环境检测到的位点Tdurum_contig35799_208对低植酸含量效应最大,差值为0.98 g/kg,该位点的碱基G相对于T为优异等位变异。此外,E2环境中的优异等位变异Excalibur_c96134_152-C、Excalibur_c96134_182-T和Tdurum_contig43538_1687-A对低植酸含量效应较大。

表5 植酸含量关联位点等位变异表型Table 5 Phenotypic effect of allelic for Phytic acid content loci

续表5
3 讨论
对我国76份小麦地方品种和 62 份来自黄淮、长江中下游和西南麦区品种的分析表明,小麦植酸含量为5.16~9.87 g/kg[7]。在我国137份微核心种质资源中,植酸含量变异范围为9.59~29.63 g/kg,大多数品种植酸含量属于中等水平[14]。400份印度及 CIMMYT品种和人工合成种植酸含量的变异范围为11.7~19.3 g/kg[20]。黄淮麦区212份代表性品种的植酸含量为2.18~13.37 g/kg,绝大多数品种植酸含量属于中等水平[10]。本研究表明,中国冬麦区205份20世纪80年代以来的推广品种或骨干亲本及高代品系的植酸含量为1.00~18.90 g/kg,绝大多数品种植酸含量较低。与前人报道相比[9,10,14,20],本研究中植酸含量的变异范围更大,且绝大多数品种植酸含量较低,可能与所选取的材料和数量有关。目前还没有对小麦植酸含量进行育种选择,因而其变异范围较大。因此,在当前进行小麦低值酸品质改良时,首先对现有品种的目标性状进行筛选将是一个有效的选择手段。本研究中,推广品种或骨干亲本中,B54、B40、B86和 B126植酸含量较低,有可能成为重要的育种亲本,在低植酸含量小麦品质育种中发挥作用。
高代育种品系具有优异目标性状突出、遗传稳定的特征,有经济价值的可直接在生产上应用,也可选育成为品种。本群体中B131、B141、B181和 B149等高代育种品系植酸含量较低,结合品系优异性状,有可能选育出低值酸含量功能性小麦新品种。
目前,国内外对小麦籽粒植酸含量QTL定位方面的报道较少。本研究分别在2B、3B、3D和6B染色体上检测到植酸含量的QTL位点,何秋怡等[15]在3B和3D染色体上检测到2个控制植酸含量的 QTL,凡迪等[16]在 2B和 6B染色体上定位到控制植酸含量的QTL,初步推断这些染色体上可能存在控制植酸含量的重要基因。
国内外对小麦铁、锌等元素含量已进行了较深入研究,品种间存在显著差异[21],但植酸含量和铁、锌等微量元素含量相关性研究鲜有报道。建议在本研究的基础上,进一步测定冬麦区种质资源的铁、锌等微量元素含量,同时筛选出值酸含量低且铁、锌等微量矿质元素含量高的种质资源,同时将其用于育种,为小麦新时代品质育种提供参考。
4 结论
两个种植年度环境群体植酸含量平均值为4.99 g/kg和3.31 g/kg,变幅分别为17.90 g/kg和10.20 g/kg,群体植酸含量变异范围较大。聚类分析将群体材料聚为6类。其中,高代育种品系除第2和3类没有分布之外,其它各类中都有均匀分布;推广品种或骨干亲本中,B54、B40、B86和 B126植酸含量最低,有可能成为重要的育种亲本,在低植酸含量小麦品质育种中发挥作用。高代品系 B131、B141、B181和 B149植酸含量最低,结合品系优异性状,有可能选育出低值酸含量功能性小麦新品种。关联分析共检测到36 个与小麦籽粒植酸含量相关联的显著关联位点(P<0.001),分布在 2B、3A、3B、3D、6A和6B染色体上,单个关联位点表型变异贡献率为5.73%~9.69%。同时,挖掘了一批低值酸含量基因的优异等位变异,例如Tdurum_contig35799_208-G、Excalibur_c96134_152-C、Excalibur_c96134_182-T和Tdurum_contig43538_1687-A对低植酸含量效应较大。

