PD-1/PD-L1相关免疫逃逸机制在头颈部鳞状细胞癌中的研究进展
季一鸣 孙乐刚 王岳 张凌楠 马向瑞
【摘要】 肿瘤细胞利用免疫检查点逃避免疫监视是肿瘤发生发展的重要步骤之一。程序性细胞死亡受体-1(programmed cell death protein 1, PD-1)/程序性细胞死亡配体-1(programmed cell death ligand 1, PD-L1)是参与肿瘤免疫逃逸过程重要的调节因子,与肿瘤的发生发展及预后密切相关。以PD-1/PD-L1为主要靶点的免疫疗法近年来在临床上取得了显著疗效。本文就PD-1/PD-L1参与肿瘤细胞免疫逃逸的机制及其在头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)免疫治疗中的应用现状及前景进行综述。
【关键词】 头颈部鳞状细胞癌 程序性细胞死亡受体-1 程序性细胞死亡配体-1 免疫逃逸 预后
[Abstract] Escape of immune surveillance using immune checkpoints by tumor cells is one of the important steps in tumorigenesis and development. Programmed cell death protein-1 (PD-1) and programmed cell death ligand-1 (PD-L1) are important regulators involved in tumor immune escape, and closely related to the occurrence, development and prognosis of tumors. Immunotherapy with PD-1 and PD-L1 as the main target has yielded significant therapeutic effects in recent years. This article reviews the PD-1 and PD-L1 mechanism involved in tumor cell immune escape and its current applications and prospects in immunotherapy of head and neck squamous cell carcinoma.
[Key words] Head and neck squamous cell carcinoma Programmed cell death protein 1 Programmed cell death ligand 1 Immune escape Prognosis
First-author’s address: Binzhou Medical University Hospital, Binzhou 256603, China
doi:10.3969/j.issn.1674-4985.2021.17.044
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)在头颈部恶性肿瘤中的占比达90%以上,其发病率位居所有癌症种类的第六位,全球每年约有60万新增病例,目前治疗方法以个体化的综合序列为主[1-3]。近年来,HNSCC治疗中,以PD-1/PD-L1为主的免疫治疗成为研究热点,其可通过协助免疫系统发挥抗肿瘤功效,影响肿瘤的发生发展,以期达到治愈的目的,具有安全性较高、不良反应少等优势。
1 PD-1/PD-L1概述
PD-1及其配体PD-L1属于B7-CD28家族成员。从结构上来说,PD-1作为一种Ⅰ型跨膜单体糖蛋白,其分子量的大小为50~55 kD[4]。属于Ig超家族(IgSF),共含288个氨基酸残基,由三个区域构成,分别为类似免疫球蛋白(immunoglobulin,Ig)V样的胞外区结构域、疏水性跨膜区以及胞内区。其胞内区有2个酪氨酸残基,近N端为免疫受体酪氨酸抑制基序、近C端为免疫受体酪氨酸转换基序(immunoreceptor tyrosine-based switch motif,ITSM)。PD-1以单体的形式存在于细胞表层,可由CD4-、CD8-的胸腺细胞,外周活化的CD4+、CD8+ T细胞、B细胞、单核细胞和一些树突状细胞等表达,在T细胞抑制和衰竭中起重要作用[4]。
PD-L1是一种跨膜蛋白,共含290个氨基酸残基,由三个区域构成,分别为胞外区结构域、疏水性跨膜区及胞内区,其中胞外区各有一个IgC和IgV样结构域[4]。PD-L1广泛存在于成熟的CD4+、CD8+ T细胞、B细胞、NK细胞、树突状细胞等细胞表面,在肿瘤微环境(包括癌细胞和肿瘤侵袭性巨噬细胞)中也有该受体的表达[5]。
2 PD-1/PD-L1参与肿瘤免疫逃逸的分子机制
PD-1与其配体的结合主要通过T细胞受体(T cell receptor,TCR)传导信号,使PD-1胞内区ITSM中的酪氨酸磷酸化,而后募集Src同源区结构域中的蛋白酪氨酸磷酸酶1(SHP-1)与蛋白酪氨酸磷酸酶2(SHP-2)。SHP-2可使TCR相关的CD3ζ及ζ链相关的蛋白激酶(ZAP70)去磷酸化,进而抑制T细胞活化信号的传导,包括磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)及其下游蛋白激酶Akt的活性,扰乱葡萄糖代谢以及抑制白细胞介素-2的分泌[6]。该过程介导的负性信号能够有效阻碍T淋巴细胞的增殖、活化及细胞因子的分泌,負向调控免疫应答,使已激活的T细胞呈“耗竭(hyper exhaustion)”状态,降低效应T细胞的活性并终止免疫反应,在正常情况下可防止发生过度的炎症反应或自身免疫反应[7]。在HNSCC细胞表面PD-L1显著表达,同时在其结合淋巴细胞表面的PD-1分子之后,会削弱机体抗肿瘤免疫功能,形成利于肿瘤存活的免疫微环境,促进肿瘤免疫逃逸,以此参与肿瘤的发生、发展过程[8]。最近研究表明PD-1/PD-L1均可通过多种分子信号通路参与肿瘤免疫逃逸[9-12]。
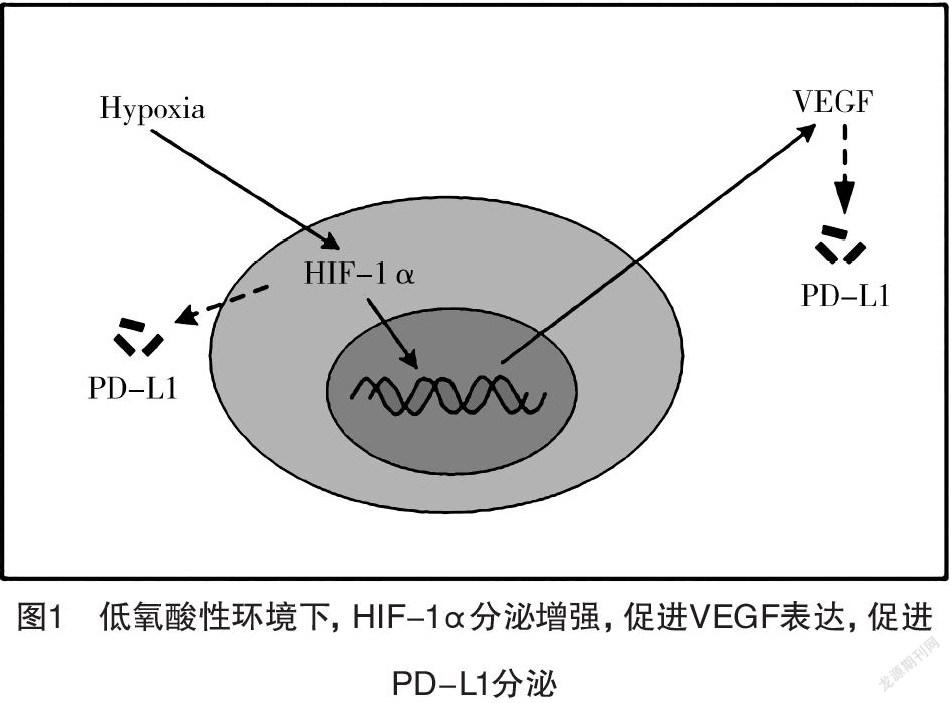
2.1 缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)及血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路 在低氧酸性肿瘤微环境下,HIF-1α的分泌增强,利于VEGF的表达。VEGF基因调控区内包含多个HIF-1结合位点,且VEGF转录需要HIF-1的参与。HIF-1α在体外条件下具有激活血管内皮生长因子启动子的功能。Barsoum等[9]通过研究发现低氧环境下HIF-1α可促进肿瘤细胞中PD-L1的表达,VEGF亦可上调PD-L1表达。而PD-L1可与激活的细胞毒性T淋巴细胞的(CTLs)上的PD-1相互作用,诱导CTLs凋亡,抑制免疫反应从而导致肿瘤细胞免疫逃逸。见图1。
2.2 肿瘤源性转化生长因子β(TGF-β)信号通路 肿瘤诱导树突状细胞及常规和调节性T细胞(regulatory T cell,Tregs)分泌TGF-β,通过Foxp1介导的转录、抑制等多种机制损害效应性T细胞的活性[10]。Stephen等[11]通过研究发现,在成熟T细胞活化过程中,TGF-β可抑制SATB1的产生,从而促进PD-1的表达。TGF-β通过SATB1启动子与Smad蛋白结合,抑制SATB1的表达。在肿瘤浸润性T细胞中,这种途径的失调导致抗肿瘤免疫功能降低。而SATB1可向PD-1增强子招募NuRD复合物,在调节PD-1表达的基因组区域CR-C、CR-B处推动组蛋白去乙酰化,抑制PD-1转录进而影响PD-1的表达。TGF-β通过抑制TCR激活介导的SATB1表达,在SATB1介導的组蛋白去乙酰化过程中释放PD-1转录机制,解除SATB1介导的PD-1抑制,促进PD-1表达。TGF-β对SATB1缺陷T细胞中PD-1的表达没有影响,表明TGF-β介导的PD-1升高完全依赖于SATB1。
2.3 糖原合成酶激酶-3(GSK-3)信号通路 GSK-3是调节CD8+ T细胞和PD-1表达的关键上游激酶。TCR信号活化使GSK-3失活,增加CD8+ CTLs中TbX21的转录,促进T-bet的活化,而T-bet可抑制Pdcd1的转录进而抑制PD-1的表达,还可增强CTLs的功能。Taylor等[12]通过微阵列分析等,证明GSK-3失活还可增加T-bet与Pdcd1启动子的结合,并用siRNAs干扰实验证实了T-bet负调控Pdcd1转录,通过体内实验证实GSK-3是PD-1表达的调节因子,并证明了GSK-3抑制剂在免疫治疗中调节PD-1的适用性。在体内使用GSK-3抑制剂可抑制PD-1的表达,增强T细胞清除病毒感染的能力,进而提高身体免疫力。
3 PD-1/PD-L1免疫治疗与HNSCC
近年来PD-1/PD-L1抑制剂逐步应用于多种恶性肿瘤的治疗,在HNSCC患者中也取得了显著疗效。国外多项单药或联合用药临床试验证实,PD-1/PD-L1抑制剂可有效延长HNSCC患者的生存时间,且较传统治疗方案不良反应发生率更低[13-15]。目前应用PD-1/PD-L1抑制剂是HNSCC治疗的有效手段,但该免疫疗法仍存在导致免疫相关不良事件及耐药等问题[5,16-19]。
3.1 PD-1/PD-L1与HNSCC预后的相关性 PD-1、PD-L1在HNSCC中呈高表达,且其表达与患者的总生存期(overall survival,OS)呈强相关[20-21]。肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)中PD-1高表达可显著提升HNSCC患者的OS[21]。但患者自身免疫反应较强时可诱导PD-1/PD-L1分泌,反而限制TILs在无治疗干预时的抗肿瘤能力[22]。PD-L1的表达与患者性别、肿瘤的分化程度、是否合并人乳头瘤病毒(human papillomavirus,HPV)感染、肿瘤复发、淋巴结受累、临床分期、OS、Treg浸润程度密切相关,但与肿瘤组织大小、颈淋巴结转移无明显关联性[4,23]。PD-L1在肿瘤细胞中的定位也与预后相关,其在HNSCC中主要表达于淋巴细胞浸润处[22]。在HNSCC中,PD-L1的过度表达通常提示患者免疫应答削弱,预后不良[24]。Yearley等[25]研究发现,肿瘤相关PD-L1的表达可以预测PD-1导向免疫治疗的临床效果。但部分PD-L1阴性患者对PD-1阻断治疗也有反应,提示PD-1的其他配体可能与免疫治疗的效果相关。
3.2 抗PD-1和抗PD-L1免疫治疗在HNSCC中的应用 肿瘤免疫治疗主要用于挽救呈耗竭状态的T细胞、调控免疫抑制细胞,唤醒受损的免疫系统。近年来,肿瘤免疫治疗在HNSCC等恶性肿瘤的治疗中获得显著性进展[26]。阻断PD-1可复苏耗竭的T细胞,并使其恢复细胞毒性作用[27]。而对于PD-L1来说,其表达水平的高低与其抑制剂的疗效及HNSCC间质表型有关[28]。阻断PD-L1可增强TILs对肿瘤细胞的作用,将阻断PD-L1的活化T细胞移植入患者体内,与仅移植活化T细胞的患者相比,其生存率显著提高,提示使用PD-L1阻断剂可延缓HNSCC的发展[23]。
Nivolumab是PD-1抑制性抗体之一,其应用可提高晚期非小细胞肺癌(NSCLC)患者5年OS,且12例5年生存者(75%)没有接受后续治疗,在最后一次随访中也没有出现疾病进展的迹象(CA209-003)[29]。经铂类化疗后病情进展的复发或转移性(R/M)HNSCC患者,改行Nivolumab治疗者比接受传统治疗者有更长的OS及更高的生活质量[13]。
作为高度特异性的PD-1阻断性单克隆抗体,Pembrolizumab可以抑制PD-1和PD-L1的结合,解除由PD-1引发的免疫应答抑制机制。FDA已批准应用该两种药物治疗铂类抵抗的复发或转移性HNSCC,美国国家综合癌症网络(national comprehensive cancer network,NCCN)已在治疗HNSCC的指南中纳入这两种药物[14]。
作为高特异性、亲和性的PD-L1抑制性抗体,Durvalumab可以抑制PD-L1和PD-1的结合。其Ⅲ期临床试验最新结论表明,应用Durvalumab单药治疗的R/M HNSCC患者较对照组有更高的OS,其中HPV阳性者的OS较阴性者高[15,30]。
应用PD-1/PD-L1抑制剂的免疫疗法会导致一系列免疫相关不良事件(immune-related adverse events, irAEs),常见的包括皮肤症状如瘙痒、皮疹、反应性毛细血管瘤(reactive capillary hemangiomas,RCH)[16];胃肠道和肝脏症状如恶心、腹泻、结肠炎、肝炎;呼吸道症状如肺炎[17];内分泌症状如甲亢、甲减、垂体炎、肾上腺功能不足等[5];心脑血管症状如心肌炎、脑炎等[18]。是否合并irAEs患者的OS比较,差异有统计学意义(P≤0.001),在报告3次及以上irAEs事件的患者中,OS显著提高(P≤0.001)。HNSCC中PD-1/PD-L1的表达是否与irAEs的发生的相关性仍待进一步研究[5]。因免疫检查点抑制剂针对的是免疫系统而不是肿瘤组织本身,故应考虑患者自身免疫反应能力,兼顾治疗的安全性和有效性,监测患者自身免疫性疾病恶化导致的潜在风险。此外,应鼓励患者在出现irAEs症状早期及时就诊。2级及以上irAEs患者可应用皮质类固醇治疗,具体适应证和应用剂量取决于irAEs的类型[5]。
4 总结与展望
综上所述,PD-1/PD-L1参与组成多种肿瘤免疫逃逸的分子信号通路,在HNSCC肿瘤细胞免疫逃逸过程中起到关键作用。对PD-1/PD-L1参与肿瘤免疫逃逸机制的深入研究有助于发现HNSCC免疫治疗新的靶点并开发针对性药物,制定新的治疗方案。目前采用定向抗体阻断PD-1/PD-L1信号通路的治疗方法已经取得较为持久的抗癌应答效果,并逐步应用于HNSCC的治疗且可有效改善患者预后[14,31]。然而现有PD-1/PD-L1抑制剂仍可能导致不同程度的免疫不良事件,且表现出部分耐药、免疫原性高、成本高、稳定性差、产量低等缺点[32]。待未来解决这些问题后,可为患者提供更加安全、高效的免疫抑制剂,达到治疗HNSCC的目的,使患者收获更好的预后。
参考文献
[1]杨利洒,石从郁,梁宇豪,等.头颈部鳞癌程序性死亡配体-1的共表达基因及调控网络的生物信息学分析[J].华西口腔医学杂志,2019,37(5):516-520.
[2] Cancer Genome Atlas Network.Comprehensive genomic characterization of head and neck squamous cell carcinomas[J].Nature,2015,17(7536):576-582.
[3]祁佳佳,孙艳,袁昌青,等.CD44和CD133在口腔潜在恶性病变和口腔鳞状细胞癌中的表达及其临床意义[J].华西口腔医学杂志,2017,35(3):311-316.
[4] Ohaegbulam K C,Assal A,Lazar-Molnar E,et al.Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J].Trends Molecular Medicine,2015,21(1):24-33.
[5] Boutros C,Tarhini A,Routier E,et al.Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination[J].Nature Reviews Clinical Oncology,2016,13(8):473-486.
[6] Hofmeyer K A,Jeon H,Zang X X.The PD-1/PD-L1 (B7-H1) pathway in chronic infection-induced cytotoxic T lymphocyte exhaustion[J].Journal of Biomedicine and Biotechnology,2011,2011(11):1-9.
[7]王月華,胡志远.PD-1/PD-L1在肿瘤免疫逃逸中的作用机制及其临床应用[J].中国肿瘤生物治疗杂志,2017,24(7):784-790.
[8]张鹏,欧阳少波,王军,等.程序性死亡分子1及其配体在口腔鳞状细胞癌患者外周血中的表达及临床意义[J].华西口腔医学杂志,2015,33(5):529-533.
[9] Barsoum I B,Smallwood C A,Siemens D R,et al.A Mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells[J].Cancer Research,2014,74(3):665-674.
[10] Stephen T L,Rutkowski M R,Allegrezza M J,et al.
Transforming growth factor β-mediated suppression of antitumor T cells requires Foxp1 transcription factor expression[J].Immunity,2014,41(3):427-439.
[11] Stephen T L,Payne K K,Chaurio R A,et al.SATB1 expression governs epigenetic repression of PD-1 in tumor-reactive T cells[J].Immunity,2017,46(1):51-64.
[12] Taylor A,Harker J A,Chanthong K,et al.Glycogen synthase kinase 3 inactivation drives T-bet-mediated down regulation of co-receptor PD-1 to enhance CD8+ cytolytic T cell responses[J].Immunity,2016,44(2):274-286.
[13] Ferris R L,Blumenschein G,Fayette J,et al.Nivolumab for recurrent squamous-cell carcinoma of the head and neck[J].New England Journal Medicine,2016,375(19):1856-1867.
[14] Adelstein D,Gillison M L,Pfister D G,et al.NCCN guidelines insights:head and neck cancers,version 2.2017[J].Limnology and Oceanography,Method,2017,15(6):761-770.
[15] Licitra L F,Haddad R I,Even C,et al.Eagle:a phase Ⅲ,randomized,open-label study of durvalumab (D) with or without tremelimumab (T) in patients (pts) with recurrent or metastatic head and neck squamous cell carcinoma (R/M HNSCC) [J].Journal Clinical Oncology,2019,37(15):6012.
[16] Chen X,Ma L,Wang X,et al.Reactive capillary hemangiomas:a novel dermatologic toxicity following anti-PD-1 treatment with SHR-1210[J].Cancer Biology Medicine,2019,16(1):173-181.
[17] Bowyer S,Prithviraj P,Lorigan P,et al.Efficacy and toxicity of treatment with the anti-CTLA-4 antibody ipilimumab in patients with metastatic melanoma after prior anti-PD-1 therapy[J].British Journal Cancer,2016,114(10):1084-1089.
[18]郭偉.晚期头颈恶性肿瘤程序性细胞死亡蛋白1免疫治疗的临床研究述评[J].华西口腔医学杂志,2020,38(5):489-494.
[19] Champiat S,Dercle L,Ammari S,et al.Hyperprogressive disease is a new pattern of progression in cancer patients treated by Anti-PD-1/PD-L1[J].Clinical Cancer Research,2017,23(8):1920-1928.
[20] Yu G,Bu L,Huang C,et al.PD-1 blockade attenuates immunosuppressive myeloid cells due to inhibition of CD47/SIRPα axis in HPV negative head and neck squamous cell carcinoma[J].Oncotarget,2015,6(39):42067-42080.
[21] Badoual C C,Hans S,Merillon N,et al.PD-1-expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer[J].Cancer Research,2013,73(1):128-138.
[22] Lyford-Pike S,Peng S,Young G D,et al.Evidence for a role of the PD-1:PD-L1 pathway in immune resistance of HPV-associated head and neck squamous cell carcinoma[J].Cancer Research,2013,73(6):1733-1741.
[23]邹波,许凯,刘宪斌,等.PD-L1的表达与口腔鳞癌预后及临床病理特征相关性的Meta分析[J].上海口腔医学,2018,27(1):100-105.
[24] Wu P,Wu D,Li L,et al.PD-L1 and survival in solid tumors:A Meta-Analysis[J].PLoS One,2015,10(6):1-15.
[25] Yearley J H,Gibson C,Yu N,et al.PD-L2 expression in human tumors:relevance to anti-PD-1 therapy in cancer[J].Clinical Cancer Research,2017,23(12):3158-3167.
[26] Dogan V,Rieckmann T,Munscher A,et al.Current studies of immunotherapy in head and neck cancer[J].Clinical Otolaryngology,2018,43(1):13-21.
[27] Chen L,Han X.Anti-PD-1/PD-L1 therapy of human cancer:past,present,and future[J].Journal Clinical Investigation,2015,125(9):3384-3391.
[28] Herbst R S,Baas P,Kim D,et al.Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer (KEYNOTE-010):a randomised controlled trial[J].Lancet,2016,387(10027):1540-1550.
[29] Gettinger S,Horn L,Jackman D,et al.Five-year follow-up of Nivolumab in previously treated advanced non-small-cell lung cancer:results from the CA209-003 study[J].Journal Clinical Oncology,2018,36(17):1675-1684.
[30] Zandberg D P,Algazi A P,Jimeno A,et al.Durvalumab for recurrent or metastatic head and neck squamous cell carcinoma:results from a single-arm,phase Ⅱ study in patients with≥25% tumour cell PD-L1 expression who have progressed on platinum-based chemotherapy[J].European Journal Cancer,2019,107:142-152.
[31] Zheng P,Zhou Z.Human cancer immunotherapy with PD-1/PD-L1 blockade[J].Biomarkers in Cancer,2015,7(S2):15-18.
[32] Gilboa E,Berezhnoy A,Schrand B.Reducing toxicity of immune therapy using aptamer-targeted drug delivery[J].Cancer Immunol Research,2015,3(11):1195-1200.
(收稿日期:2021-01-26) (本文編辑:张明澜)

