玉木耳络氨酸酶基因的克隆及表达分析
苏文英,杨和川,谭一罗,惠林冲,秦裕营,李 晓
(1.连云港市农业科学院,江苏 连云港 222006;2.吉林农业大学 食药用菌教育部工程中心,吉林 长春 130118)
酪氨酸酶(Tyrosinase)是一种含铜糖蛋白,一般也称为多酚氧化酶,归类于酪氨酸酶相关蛋白家族(Tyrosinase-related Protein)[1]。酪氨酸酶广泛存在于微生物、动植物及人体中,并发挥着重要的生理功能[2]。在真菌中,双孢蘑菇的酪氨酸酶较早受到关注,在20世纪70年代,Turner 等就提出酪氨酸酶可能在双孢蘑菇(Agaricusbisporus)黑色素的合成中发挥相当重要的作用[3];络氨酸酶在氧气的参与下,将酪氨酸氧化为多酚类化合物(如L-多巴)及多巴醌,多巴醌在一系列反应后最终生成黑色素[4]。2016年宾夕法尼亚大学的杨亦农教授利用基因编辑技术对双孢蘑菇中控制褐变的多酚氧化酶基因进行了基因编辑,并将该酶的活性降低了30%,使其抗褐变[5]。此外,真菌络氨酸酶还与孢子的形成及稳定性相关。有研究表明,络氨酸酶在真菌菌丝无性生长时期发挥重要的作用,其表达量在菌丝生长期间逐渐上升,至子实体形成时开始下降[6]。目前,香菇(Lentinusedodes)[7]、漏斗多孔菌(Polyporusarcularius)[8]等真菌中的络氨酸酶基因已被克隆鉴定,为其在真菌内的表达模式分析及功能研究提供了方便。
玉木耳(AuriculariacorneaEhrenb.),隶属于木耳科木耳属,是毛木耳的白色变种[9],其质地脆嫩,美味可口,营养丰富,且具有抗肿瘤等活性[10-11]。目前关于玉木耳的研究集中在栽培、生理活性及成分分析方面,对其分子遗传学的研究还鲜有报道。鉴于此,我们在克隆玉木耳络氨酸酶基因(Actyr)的基础上,还测定了玉木耳菌丝由营养生长到生殖生长整个过程中关键时期络氨酸酶基因的相对表达量,从而对所有络氨酸酶基因的功能进行了系统分析,以期为深入研究络氨酸酶基因在玉木耳子实体发育过程中的生物学功能提供科学依据。
1 材料与方法
1.1 供试菌株
玉木耳菌丝材料由吉林农业大学食药用菌教育部工程研究中心提供;大肠杆菌(E.coli)DH5α购自北京全式金生物技术有限公司。
1.2 试剂
UNlQ-10柱式Trizol总RNA抽提试剂盒(生工公司,上海); Phanta Max Super-Fidelity DNA Polymerase(诺唯赞生物科技股份有限公司,南京); SYBR PrimeScript TM RT-PCR Kit荧光定量试剂盒[宝生物工程(大连)有限公司,大连]; Peasy-T1 cloning vector(北京全式金生物技术有限公司,北京); AxyPrep DNA凝胶回收试剂盒(爱思进生物技术有限公司,杭州)。
1.3 试验方法
1.3.1 玉木耳总RNA的提取及cDNA第一链的合成 用总RNA提取试剂盒提取玉木耳的RNA,具体操作参照说明书进行。采用凝胶电泳及微量测定仪NanoDrop ND-1000对提取获得的RNA的浓度和纯度进行检测。在检测合格后于-80 ℃保存备用。根据试剂盒说明书进行反转录,所得cDNA于-20 ℃冰箱中保存备用。
1.3.2 玉木耳Actyr基因全长序列的克隆 以逆转录获得的cDNA为模板,利用RT-PCR技术扩增得到Actyr基因的全长cDNA序列。PCR引物序列如下:Actyr-F, ATGCCACAAGGTCACAGG;Actyr-R, TCAATCGTACTCGTAGCAC。引物由金唯智生物技术有限责任公司合成。PCR反应体系为: ddH2O 17 μL、2 × Phanta Max Buffer 25 μL、dNTP Mix (10 mmol/L each) 1 μL、模板cDNA 2 μL、上下游引物各2 μL、Phanta Max Super-Fidelity DNA Polymerase (1 μg/μL) 1 μL。PCR扩增反应条件为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火15 s,72 ℃延伸1 min,共30个循环。在PCR反应结束后,将PCR产物经1%琼脂糖凝胶电泳检测正确后,利用凝胶回收试剂盒回收PCR产物,具体操作参照试剂盒说明书。
1.3.3 扩增产物的克隆及测序 将回收纯化的产物连接T-vector,连接反应体系为: Peasy-T1 cloning vector 1 μL、回收产物4 μL,反应条件为25 ℃ 20 min。获得的连接产物直接用于大肠杆菌转化,转化方法为热激法。将转化产物涂布于平板,在37 ℃过夜培养;挑取单菌落于5 mL LB(含Amp+)液体培养基中,在200 r/min、37 ℃条件下震荡培养过夜。对重组克隆载体进行菌液PCR鉴定。委托生工公司进行菌液PCR测序。
1.3.4 基因序列的分析 根据克隆获得的Actyr的核酸序列以及对应的氨基酸序列,通过在线分析软件在理论上对其进行基因信息分析。
利用DNAMAN软件对测序所得序列与Actyr基因序列进行序列同源性分析;通过NCBI Conserved Domains进行保守功能域分析;应用PredictProtein软件对Actyr蛋白质的二级结构进行分析;应用Protparam (http://expasy.org/tools/protparam.htmL)对其进行分子量和等电点的预测;应用TMpred软件(http://www.isrec.isb-sib.ch/software/tmpred_from.html)分析预测蛋白序列的跨膜区;应用SignalP 4. 1 (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;应用Swiss-MODEL在线工具软件对蛋白质的三级结构进行成像分析。
1.3.5 基因表达量的测定 收集耳芽期、原基期、耳片期(耳片直径2、3、4 cm)5个时期的材料,提取RNA,反转录后形成cDNA,保存于-20 ℃待用。以ACTIN基因为内参基因,采用SYBR PrimeScript TM RT-PCR Kit荧光定量试剂盒在ABI StepOne Plus型荧光定量PCR仪上进行荧光定量检测。扩增条件: 95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 20 s,循环40次;在72 ℃下单点检测信号。对每个样品设3次技术重复,采用2-△△Ct法对各基因进行相对定量分析。
2 结果与分析
2.1 目的基因的扩增与克隆鉴定
以玉木耳的基因组cDNA为模板,扩增得到Actyr基因的全长cDNA序列,经1%琼脂糖凝胶电泳,所得结果与预期大小相符(图1)。将PCR扩增获得的反应产物经电泳、回收、连接、转化DH5α后,对获得的单菌落进行菌液PCR及测序,测序结果表明,克隆获得的Actyr基因cDNA序列长度为1113 bp,编码371个氨基酸(图2 );同时,NCBI数据库的Conserved Domains分析结果(图3)表明,Actyr属于Tyrosinase基因家族。

M: DNA分子量标准DNA marker DL2000。1~2: PCR产物。
2.2 Actyr基因的生物信息学分析
应用PredictProtein软件对Actyr蛋白质进行分析,二级结构分析结果见图4a,具有α螺旋、β折叠、无规则卷曲;氨基酸组成分析结果见图4b,其中亮氨酸含量最多,缬氨酸含量最少;亚细胞定位预测结果表明该基因定位于细胞质,见图4c;通过Protparam软件预测分析结果显示,Actyr的等电点为7.64,分子量MW=41.11 kDa。在体外的半衰期为30 h;不稳定指数为48.2,表明该蛋白是不稳定的。通过SWISS-MODEL软件对Actyr蛋白质的三级结构进行预测,结果如图4d所示,为下一步对该基因功能的研究奠定了基础。TMpred软件的分析结果显示, Actyr蛋白不存在跨膜区(图5)。信号肽分析发现不存在信号肽结构(图6)。

图2 Actyr基因的cDNA序列及推导的氨基酸序列

图3 CDS分析结果
把本试验所克隆的Actyr基因编码的氨基酸序列与其他物种络氨酸酶基因编码的氨基酸序列进行同源性比较分析,发现其在两个铜离子结合区(CuA和CuB)高度保守(图7)。

图4 Actyr基因的生物信息学分析结果

图5 跨膜结构域分析结果

图6 信号肽预测结果
2.3 不同发育时期Actyr基因表达的分析
以ACTIN基因为内参基因,对玉木耳不同发育时期Actyr基因的表达量进行分析,发现在玉木耳菌丝生长时期,几乎检测不到Actyr基因的表达量;随着玉木耳的生长发育,其表达量不断上升,到子实体直径为3 cm时,Actyr基因的表达量达到最高;随着玉木耳的进一步发育,其转录表达水平逐渐下降(图8)。
3 讨论与结论
本实验采用基因克隆的手段,获得了玉木耳的Actyr基因,明确了该基因的基本结构和氨基酸序列。通过生物信息学分析,发现该蛋白属于络氨酸酶基因家族成员,具有其典型特征,即在活性中心含有两个铜离子结合区。此外,通过对其理化性质、结构和功能等方面进行分析预测,结果表明,Actyr基因编码的蛋白无跨膜区,不存在信号肽;细胞定位预测结果表明其存在于细胞质中,与大部分真菌的络氨酸酶性质一致[12]。络氨酸酶广泛存在于真菌中,在真菌中具有不同的功能,如参与孢子的形成及稳定、防御和毒性机理,参与子实体褐变及色素沉着[1-3,13-15]。此外, Kitamoto等的研究表明,双核菌丝在黑暗条件下培养时,络氨酸酶的活性较可见光条件下培养时低[16]。本研究通过分离、克隆玉木耳络氨酸酶基因,分析其基因表达特征,为进一步明确络氨酸酶基因在玉木耳中的功能及遗传育种奠定了基础。
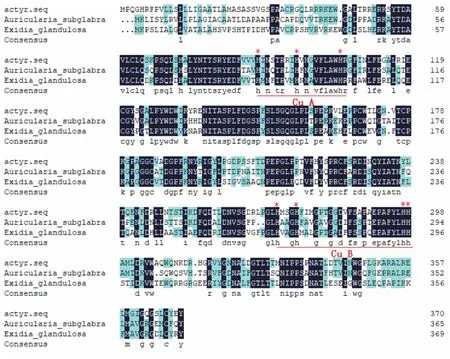
“*”表示保守的组氨酸(His)残基。

图8 玉木耳不同生长发育阶段Actyr基因的相对表达量

