早期肠内营养支持对胃肠道肿瘤术后患者免疫功能及营养状况的影响
杨文慧,王建国
(内蒙古林业总医院1.临床药剂部;2.普外三疗区,内蒙古 呼伦贝尔 022150)
胃肠道肿瘤是一种消耗性疾病,患者常伴有营养不良、贫血等症状,还会影响患者消化功能,且手术治疗时间较长,手术前需禁食,增加了胃肠道肿瘤术后患者营养不良发生概率,长期营养不良会影响手术效果,延缓切口愈合[1]。肠内营养具有操作简单、费用低廉等优点,易于患者接受,有效改善术后患者预后。在尽可能的短时间内给予患者肠内营养支持可保证患者机体对营养的需求,加快患者恢复,但是时间过短可能会增加不良反应发生率,合适的起始干预时间点对患者预后恢复至关重要[2]。本研究旨在探讨早期肠内营养支持起始时间对胃肠道肿瘤术后患者免疫功能及营养状况的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年5月至2020年4月内蒙古林业总医院实行手术治疗的62例胃肠道肿瘤疾病患者,按照随机数字表法将其分为两组,各31例。本研究经院内医学伦理委员会批准,且患者或家属对本研究知情并同意。对照组患者年龄25~74岁,平均(55.38±2.13)岁;其中女性12例,男性19例;结肠癌9例,胃癌12例,直肠癌5例,其他胃肠道肿瘤疾病5例。研究组患者年龄26~75岁,平均(55.12±2.49)岁;其中女性10例,男性21例;结肠癌11例,胃癌10例,直肠癌6例,其他胃肠道肿瘤疾病4例。两组患者一般资料经比较,差异无统计学意义(P>0.05),组间具有可比性。纳入标准:符合《中国常见恶性肿瘤诊治规范标准》[3]中的相关诊断标准者;均为手术成功者等。排除标准:合并内分泌疾病者;合并严重脏器损伤者;术前经化疗治疗者等。
1.2 方法 对照组患者于术后48 h进行肠内营养,研究组患者于术后12 h进行肠内营养。肠内营养支持干预方式具体如下:将鼻肠管送进胃肠远处25 mm位置或幽门下20 mm位置,肠内营养的第1天给予患者肠内营养制剂:肠内营养混悬液(纽迪希亚制药有限公司,国药准字H20030011,规格:1.5 kcal/mL),注入速率为20~30 mL/h,用量为300 mL,再通过鼻肠管注入500 mL~1 000 mL等渗葡萄糖氯化钠溶液,注入速率为30~50 mL/h,1次/d,1 d后采取输液泵注入500 mL~1 200 mL肠内营养制剂,参考患者实际能够耐受的程度,对注入速率实施适宜调节,1次/d。两组患者均干预5 d。
1.3 观察指标 ①比较两组患者营养支持干预后肠道蠕动恢复时间、术后肛门第1次排气时间、经口进食时间、术后排便时间。②抽取两组患者营养支持干预前后外周血3 mL,采用流式细胞仪检测外周血CD3+、CD4+、CD8+百分比及淋巴细胞数目。③抽取两组患者营养支持干预前后静脉血3 mL,抗凝后3 000 r/min离心10 min,取血浆,采用血细胞分析仪检测血浆前白蛋白(PA)、白蛋白(ALB)、血红蛋白(Hb)水平。④比较两组患者并发症情况,主要包含切口感染、腹腔感染、吻合口瘘、排空障碍。
1.4 统计学方法 采用SPSS 23.0统计软件分析数据,计数资料用[例(%)]表示,采用χ2检验;计量资料用(±s)表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胃肠恢复情况 研究组患者术后肠道蠕动恢复时间、术后肛门第1次排气时间、经口进食时间、术后排便时间均短于对照组,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者胃肠恢复情况比较(±s, 分)
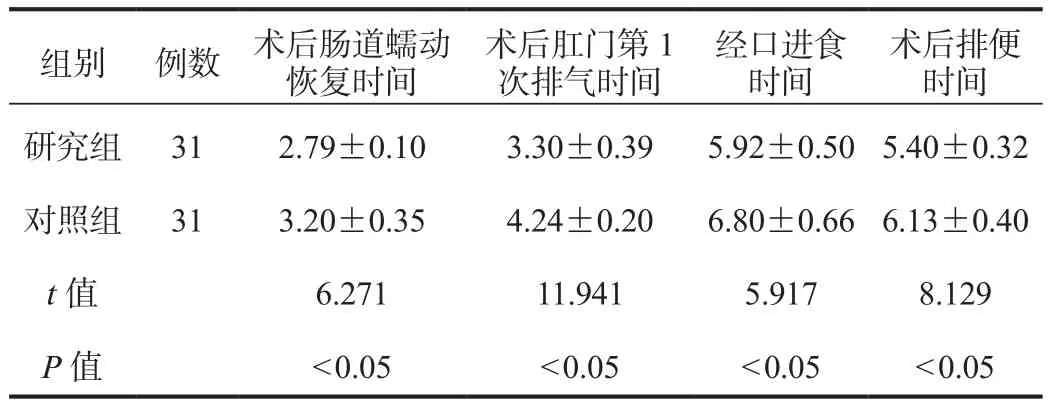
表1 两组患者胃肠恢复情况比较(±s, 分)
组别 例数 术后肠道蠕动恢复时间术后肛门第1次排气时间经口进食时间术后排便时间研究组 31 2.79±0.10 3.30±0.39 5.92±0.50 5.40±0.32对照组 31 3.20±0.35 4.24±0.20 6.80±0.66 6.13±0.40 t值 6.271 11.941 5.917 8.129 P值 < 0.05 < 0.05 < 0.05 < 0.05
2.2 免疫功能 干预后两组患者外周血CD3+、CD4+百分比均提升,而外周血CD8+百分比、淋巴细胞数目均下降,研究组患者外周血CD3+、CD4+百分比、淋巴细胞数目均高于对照组,而外周血CD8+百分比低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者免疫功能比较(±s)

表2 两组患者免疫功能比较(±s)
注:与干预前比,*P<0.05。
组别 例数 CD3+(%) CD4+(%)干预前 干预后 干预前 干预后研究组 31 53.62±1.10 62.30±3.45*32.63±0.30 43.40±0.68*对照组 31 54.20±1.23 59.81±2.30*32.50±0.37 39.12±0.50*t值 1.957 3.343 1.519 28.233 P值 > 0.05 < 0.05 > 0.05 < 0.05组别 例数 CD8+(%) 淋巴细胞数目(×109/L)干预前 干预后 干预前 干预后研究组 31 21.92±0.50 18.32±0.20*4.45±0.30 3.14±0.20*对照组 31 22.10±0.47 20.50±0.34*4.50±0.33 2.46±0.10*t值 1.460 30.770 0.624 16.931 P值 > 0.05 < 0.05 > 0.05 < 0.05
2.3 营养状况 干预后两组患者血浆ALB、PA、Hb水平均较干预前提升,且研究组高于对照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者营养状况比较(±s)

表3 两组患者营养状况比较(±s)
注:与干预前比,*P<0.05。PA:前白蛋白;Hb:血红蛋白;ALB:白蛋白。
组别 例数 PA(mg/L) Hb(g/L)干预前 干预后 干预前 干预后研究组 31 127.36±2.20 152.36±0.60*101.70±2.68 131.24±0.80*对照组 31 128.10±2.13 150.60±0.34*102.45±2.50 128.50±0.74*t值 1.345 14.209 1.139 13.999 P值 > 0.05 < 0.05 > 0.05 < 0.05组别 例数 ALB(g/L)干预前 干预后研究组 31 25.21±1.50 38.60±1.14*对照组 31 25.40±1.56 37.52±1.20*t值 0.489 3.633 P值 > 0.05 < 0.05
2.4 并发症 研究组患者并发症总发生率低于对照组,差异有统计学意义(P<0.05),见表4。
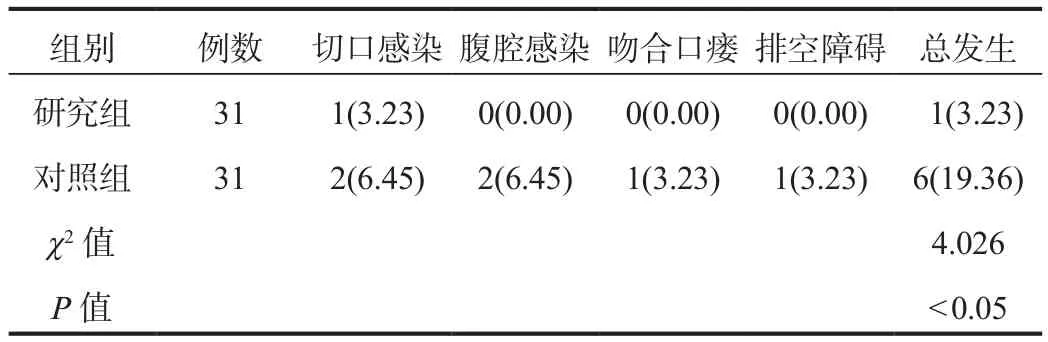
表4 两组患者并发症发生率比较[例(%)]
3 讨论
胃肠道肿瘤疾病患者常需接受手术治疗,患者手术之后需予以营养支持,可促进其机体早期康复,促进其体内营养状况获得改善,维持其生理功能,利于加快患者术后机体恢复[4]。
术后肠内营养的干预应以恢复患者的胃肠功能、促进营养成分吸收、减少术后并发症等为主要原则。术后12 h进行肠内营养支持较术后48 h进行肠内营养支持可缩短肠内营养耐受起始时间,可快速达到肠内营养目标点,同时刺激肠胃激素和机体免疫球蛋白的分泌、预防肠道内菌群移位,有利于术后肠道功能的恢复,降低术后并发症的发生率[5]。本研究结果显示,研究组患者术后肠道蠕动恢复时间、术后肛门第1次排气时间、经口进食时间、术后排便时间均短于对照组;干预后研究组患者外周血CD3+、CD4+百分比、淋巴细胞数目高于对照组,而外周血CD8+百分比低于对照组;研究组患者并发症总发生率低于对照组,表明术后12 h进行肠内营养支持可有效加快胃肠道肿瘤患者胃肠功能恢复,改善患者免疫功能,对淋巴细胞数目影响较小,且安全性较好。
PA是一种营养蛋白,当机体患有肿瘤时,其血浆水平会大幅度下降;ALB属机体内的非专一性运输蛋白,是人体内重要的营养物质,并对胃壁具有保护作用,其血浆水平降低,表明胃肠道肿瘤术后患者营养状况较差;Hb能很好地反映胃肠道肿瘤术后患者贫血情况,其血浆水平过低,表明患者处于营养不良状态。术后12 h进行肠内营养支持所使用的营养液可被小肠所吸收,越早进行干预,对机体营养状况改善程度越好,并能刺激肠道蠕动,改善和维持患者良好的营养状况[6]。本研究结果显示,干预后研究组患者血浆ALB、PA、Hb水平均高于对照组,表明术后12 h进行肠内营养支持可改善患者营养状况。但是术后肠内营养实施时机还需要结合患者术后实际情况,保证治疗的安全性及科学性。
综上,术后12 h进行肠内营养支持可有效加快胃肠道肿瘤患者胃肠功能恢复,改善患者免疫功能及营养状况,且安全性较好,值得进一步研究。

