ARTP诱变选育γ-聚谷氨酸高产菌株快速筛选方法的建立
刘丹丹,臧毅鹏,王 利,王梦梦,岳文瑾,余晨锐,陈俊柳,聂光军
(安徽工程大学 生物与食品学院,安徽 芜湖 241000)
γ-聚谷氨酸(γ-Polyglutamic acid,γ-PGA)是一种由谷氨酸单体聚合而成的高分子多聚物,具有无毒和可降解性,被广泛应用于食品行业。如作为益生菌的低温保护剂,提高益生菌在生产过程中的存活率;在面粉加工过程中,γ-PGA可以减缓淀粉老化,提高面制品的弹性和韧性等。目前,γ-PGA主要通过微生物发酵生产,但目前菌株生产效率满足不了市场对γ-PGA的需求,导致γ-PGA的价格居高不下。为提升菌株生产效率,各种诱变方法被使用,其中物理射线诱变相对于化学诱变具有简单、环境污染小等特点。常用的物理诱变主要通过紫外线、X射线等射线辐照微生物,以改变DNA,但这些方法存在诱变效率低以及可控性差等问题。近几年兴起的常压室温等离子体(Atmospheric and Room Temperature Plasma,ARTP)诱变技术因具有突变率高,对人体和环境无毒害,易操作等优点,常被用于微生物菌种诱变。
然而,基于ARTP诱变选育γ-PGA高产菌株的过程中,阻碍诱变选育效率的可能是其筛选方法的低效。面对大量诱变菌株,使用传统方法逐一测定每个菌株的产量则需要耗费过多的精力与时间。γ-PGA产生菌在生长过程中,由于各种蛋白酶的作用,往往在其周围的培养基上形成一个透明圈,透明圈的大小则反映了蛋白酶的活性,而γ-PGA在生产过程中又与蛋白酶存在着偶联关系。为此,在筛选一株γ-PGA高产菌株并在对其进行鉴定的基础上,分析酪蛋白平板初筛、多孔板复筛(24孔板与48孔板)和摇瓶复筛之间的关系,尝试建立透明圈与菌落面积的比例(圈径比)与γ-PGA产量之间的关系,简化筛选流程,通过圈径比大小直观快速筛选γ-PGA高产突变株,快速提升ARTP诱变选育γ-PGA高产菌的效率。
1 材料与方法
1.1 材料与试剂
生产γ-PGA的出发菌株(市售纳豆粉中筛选获得,命名为MA1);L-谷氨酸(国药化学试剂有限公司);γ-聚谷氨酸(四川拙诚日化科技有限公司,纯度大于95%);细菌基因组提取试剂盒、Taq酶、引物和相关PCR试剂(上海生工生物工程有限公司)。
1.2 菌株鉴定
通过对菌株的形态学研究、菌落形态观察、菌株的生理生化实验3个方面对菌株进行鉴定。将MA1接种到固体培养基(牛肉膏5 g/L、胰蛋白胨5 g/L、NaCl 5 g/L、琼脂15 g/L、pH 7.0),37 ℃培养24 h,观察菌落形态。将MA1接种到种子培养基(牛肉膏3 g/L、葡萄糖5 g/L、胰蛋白胨5 g/L、NaCl 5 g/L、pH 7.0),37 ℃培养24 h,革兰染色镜检观察菌株形态。将MA1接种到酪蛋白培养基(脱脂奶粉50 g/L、琼脂15 g/L、pH 7.0),37 ℃培养24 h,观察菌落形态。将MA1接种到液体发酵培养基(蔗糖28.87 g/L、胰蛋白胨17.56 g/L、L-谷氨酸15.26 g/L、pH 7.0),37 ℃培养24 h后,将发酵液滴入纤维蛋白平板(2%琼脂糖、20 IU凝血酶溶液、0.3 mg纤维,总体积为10 mL)中,观察发酵液的纤维降解能力。
基于SDS-碱裂解法原理,应用细菌基因组提取试剂盒提取MA1基因组,应用引物(27F/1492R)扩增16S rDNA,并对其进行测序(合肥通用生物),测序结果通过blast比对,应用MEGA 7.0制作进化树,从分子水平鉴定MA1。应用引物NK-F(GGGGTACCGTATGAAAATAGTTATTTCGAGTCTCTACG)和NK-R(AACTGCAGTCCGGTGCTTGTGAAGATTTC)PCR扩增aprN(纳豆激酶编码基因),并测序比对,鉴定MA1与纳豆菌(Bacillus Subtilis Natto)的关系。
1.3 菌株筛选方法的研究
(1)初筛方法:选用混浊、易被菌种分解利用的酪蛋白平板接种MA1,每4 h测量菌体直径及水解圈直径,计算圈径比(水解圈与菌体直径之比),分析圈径比与MA1的γ-PGA产量之间的变化关系。
(2)复筛方法:分别采用24孔板、48孔板接种对数期的种子液,孔板接种量和装液量比例同100 mL摇瓶发酵(7.5%接种量/30 mL发酵培养基),37 ℃、200 rpm发酵培养,每4 h取样检测γ-PGA产量,以研究孔板体积对γ-PGA产量的影响,确定多孔板类型。在此基础上,进一步应用24孔板发酵(37 ℃、200 rpm),每4 h取样检测γ-PGA产量,考察其与相同条件下摇瓶发酵之间的相关性,确定最佳复筛方法。
1.4 ARTP诱变选育
(1)诱变菌悬液的制备:种子液37 ℃、200 rpm培养至对数期,取l mL菌液4 500 rpm离心去上清液,加入等量生理盐水重悬菌体,OD在0.8~1.0之间待用。
(2)生长及发酵曲线的测定:将对数期的种子液以7.5%的接种量接入装液量为30 mL的发酵培养基中(100 mL锥形瓶),37 ℃、200 rpm震荡培养,每4 h取样测菌浓和γ-PGA产量。
(3)ARTP诱变:将8个装有990 μL生理盐水的EP管依次置于ARTP诱变仪(无锡源清天木生物科技公司)相应凹槽的底部,紫外灭菌20 min,将8个铺满10 μL菌液的ARTP载片依次置于ARTP诱变仪相应凹槽中,诱变时间依次为0 s、15 s、30 s、45 s、60 s、90 s、120 s和160 s(诱变条件:99.99%的高纯氦气,电源功率120 W、气体流量10 SLM、照射距离2 mm、温度<30 ℃)。诱变结束后,震荡洗脱EP管2 min,使载片上的菌体完全混于生理盐水中,再将EP管置于4 ℃冰箱中,保存2 h,避免自省对突变损伤进行修复。最后将诱变液稀释一定倍数(原液菌浓度约为1.08×10cfu/mL),取100 μL分别涂布于固体培养基和酪蛋白平板,每组3个平行,37 ℃培养,记录固体培养基平板上的菌落数量,根据下式计算致死率,并绘制致死率曲线。测量酪蛋白板上的圈径,并计算圈径比。
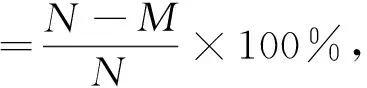
N
为诱变固体平板上的菌落数;M
为诱变处理后平板上的菌落数。(4)遗传稳定性研究:将筛选的突变株传代培养5次,检测γ-PGA的产量以考察其遗传稳定性。
1.5 γ-PGA产量测定
参照Zeng等报道的方法。10 000 rpm离心发酵液10 min,取上清液;加入4倍体积冰乙醇,置于4 ℃冰箱中过夜,10 000 rpm离心10 min取沉淀;将沉淀55 ℃下烘干至恒重,加入与发酵液等体积的蒸馏水复溶;溶解完全后,10 000 rpm离心10 min去除不溶物,将上清适当稀释后测定OD216(TU-1810PC紫外可见光分光光度计,北京普析通用仪器有限责任公司),根据γ-PGA标准曲线计算γ-PGA产量。
2 结果与分析
2.1 菌株的鉴定
对菌株MA1进行形态学鉴定如图1所示。图1a显示菌株MA1是一种类圆形,边缘呈锯齿状,表面褶皱不透明,在菌体中央有粘液并且可产孢子的菌种;对菌株MA1的菌落形态进行革兰氏染色显微观察。图1b为杆状紫色,证明菌株MA1为革兰氏阳性细菌;对菌株MA1进行生理生化实验的鉴定。图1c显示在酪蛋白板上出现水解圈,说明该菌株含有蛋白酶,对酪蛋白有降解能力。图1d显示在纤维蛋白平板上有明显的水解圈形成,说明该菌株产生了纤溶蛋白酶可降解纤维蛋白原以及纤维蛋白。观察结果与枯草芽孢杆菌168(模式菌)生理生化特性基本相同,因而,初步推断菌株MA1属于可生产蛋白酶的芽孢杆菌。

图1 菌株鉴定
对菌株MA1进行分子生物学鉴定如图2所示。由图2可见,在约1 500 bp处有一条明显的条带,与预期16S rDNA的大小相符。经测序后得到菌株MA1的16S rDNA序列,通过与GenBank已报道的序列比对,利用MAGE 7.0软件绘制菌株MA1系统发育树(见图3),菌株MA1与枯草芽孢杆菌(Bacillus subtilis)的同源性高达99%,由此确定菌株MA1为枯草芽孢杆菌。进一步PCR扩增该菌株的aprN基因,图2b显示该扩增片段与已报道aprN基因序列(1473 bp)基本一致。测序结果显示,所得NK基因与Nakamura报道的aprN基因序列(GI:262756)相同。因为aprN基因序列具有高度的特异性,主要产生菌为纳豆枯草芽孢杆菌(Bacillus Subtilis Natto,简称纳豆菌)。因此,可以确定菌株MA1属于纳豆菌。
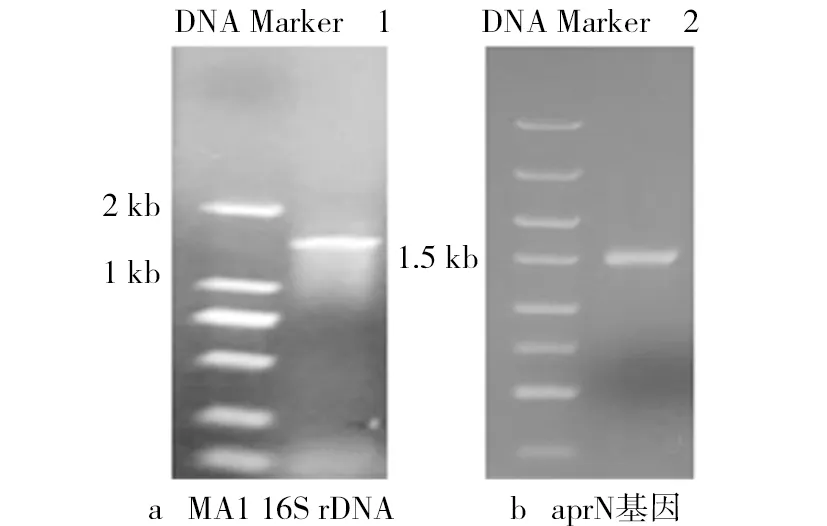
图2 MA1 16S rDNA和aprN基因PCR产物电泳图谱
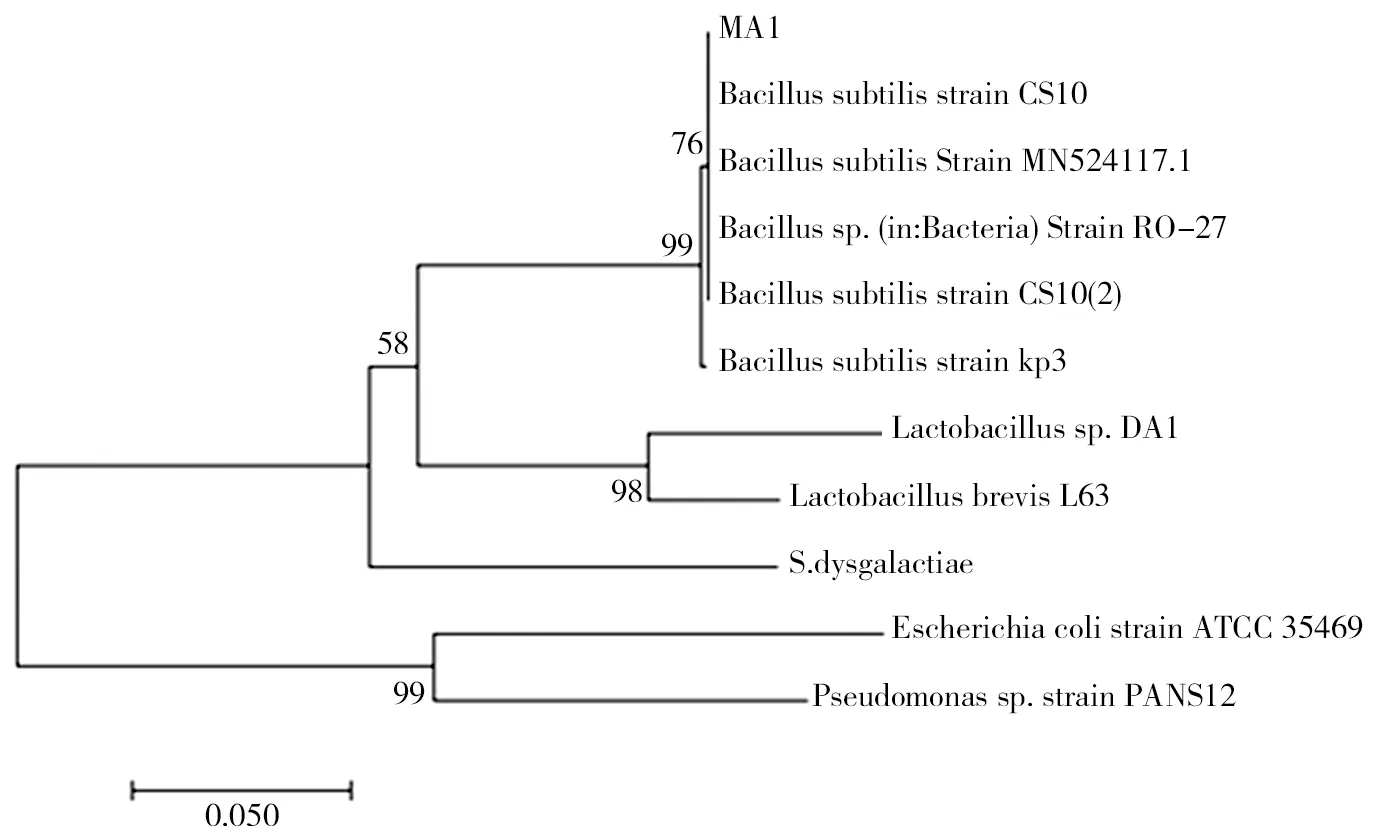
图3 菌株MA1 16S rDNA的系统发育树
2.2 筛选方法确定
对数生长期的纳豆菌代谢旺盛,菌体比生长速率最大,细胞的数量呈指数上升,且抗不利环境的能力最强。因此,微生物发酵和诱变选择对数生长期的菌株。发酵液与种子液中的培养基成分、接种量及菌龄都不相同,菌株在发酵液中的生长曲线就会受到一定的影响。通过测定菌体生长与γ-PGA产量,可以更直接地观察两者间的关系,对菌株筛选与分析发酵液中γ-PGA生产过程有重要的意义。
种子液菌株MA1的生长及发酵曲线如图4所示。由图4可知,菌株前4 h增殖缓慢,处于延滞期;4~12 h菌体急剧增殖,比生长速率最大,处于对数期;14~36 h菌体数量处于动态平衡,此时为稳定期;36 h后菌体数量开始下降,进入衰亡期。为了满足足够的接种量、旺盛的菌种生长活力及实验的统一性,后期诱变和发酵选择10~12 h的菌种液。相对于菌体生长,γ-PGA生产进程明显滞后。细胞生长处于延滞期时无γ-PGA产生,细胞对数期γ-PGA产量增加缓慢,稳定期γ-PGA生产明显加速。说明γ-PGA生产与菌体增殖存在一定关联,这种次级代谢产物与初级产物联系更为紧密。之前的研究结果显示,随菌体的生长纳豆激酶的含量增加,菌体细胞处于对数期,纳豆激酶含量达到最大,菌体生长进程与纳豆激酶等蛋白酶的生产偶联,γ-PGA生产由蛋白酶水解底物产生的代谢物质,由此推断γ-PGA生产与蛋白酶的生产也可能存在一定关联。孔板对菌株γ-PGA产量的影响、24孔板与摇瓶发酵的相关性以及摇瓶发酵γ-PGA产量与菌株酪蛋白平板上的菌圏比之间的变化趋势如图5所示。由图5a显示,24和48孔板中γ-PGA产量变化趋势基本相同。其中,24孔板中的γ-PGA产量明显较高,这是由于纳豆菌是好氧菌,48孔板内菌液的表面接触氧气较24孔板小,从而影响菌株生长代谢过程中的溶氧量,因此,24孔板更有利于菌株 MA1的生长代谢,相对于孔板溶氧,摇瓶溶氧效果更好。由图5b显示,24孔板和同期摇瓶的γ-PGA产量相近(R=0.978 8),说明24孔板具有较好的溶氧量,满足γ-PGA生产对溶氧的需求。因此,为提升诱变复筛效率,可用24孔板培养替代摇瓶培养。
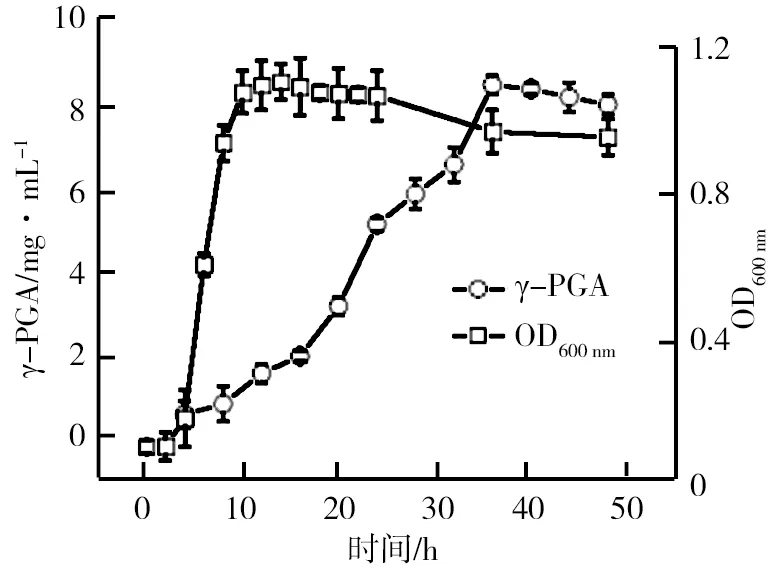
图4 种子液菌株MA1的生长及发酵曲线
面对诱变出现的大量菌株,使用快速有效的筛选方法是提高诱变选育效率的关键。纳豆菌发酵过程中会产生蛋白酶,在其水解酪蛋白后会在菌落周围形成一个酪蛋白水解圈,水解圈与菌落大小的比值可以间接表示蛋白酶活力的大小,这一方法被广泛用于产酶菌种的初筛。为了验证前文关于蛋白酶与γ-PGA生长之间存在关联的推断,菌液涂布于酪蛋白平板后,观察圈径比与γ-PGA产量之间的变化关系,由图5c显示,圈径比随着菌体的生长在16~24 h迅速增加,与酪蛋白的生长高度偶联,因为次级代谢产物的生产一般滞后于初级代谢产物,因此γ-PGA生产曲线相对于酪蛋白生产同步后移,且生长趋势基本相同,间接证明了菌株MA1蛋白酶的生产与γ-PGA产量可能存在关联。

图5 孔板对菌株γ-PGA产量的影响、24孔板与摇瓶发酵的相关性以及摇瓶发酵γ-PGA产量与菌株酪蛋白平板上的菌圏比之间的变化趋势
2.3 ARTP诱变选育
致死率是获得优良突变株的关键参数。ARTP辐照MA1的致死曲线如图6a所示。由图6a可知,诱变致死率随诱变时间的增加在不断升高,诱变时间为90 s时,致死率达到88.16%。诱变300 s时,致死率为100%。由于突变具有随机性,正负突变与诱变时间无明确的规律可循,但因为诱变时间越长,会使DNA链和氢键断裂的程度、胸腺嘧啶二聚体形成的程度及宿主修复后造成的差错程度加大,从而造成菌株损伤加重,与出发菌株相比变化更大。因此,为提高突变株筛选效率,诱变时间选为270 s。经过5轮诱变(出发菌株为实验室前期筛选菌株MA1),在23株菌株中筛选获得8株相对高产的突变株(见图6b)。其中,3株为正突变株,m3的γ-PGA产量最高,达到9.22 g/L,较出发菌株提高了22.03%。诱变菌的产量提高率相较于张浩诱变菌产量提高的42.11%偏低,但其出发菌株的γ-PGA产量仅为本实验出发菌株产量的十分之一。对突变株m3进行连续5次发酵后,其产量在9.2 g/L左右(见图6c),说明突变体遗传稳定性较好。分析23株突变体的圈径比与其γ-PGA产量之间的关系,如图6d所示,样本量为24个(包括出发菌株),圈径比和γ-PGA产量之间R
值为0.64。一般而言,当样本量超过9个,R
值达到0.7,或当样本量超过25个,R
值达到0.4,都可认为两变量间存在相关性。据此,我们认为菌株圈径比和γ-PGA产量存在相关性,为基于酪蛋白透明圈筛选γ-PGA高产菌株提供了依据。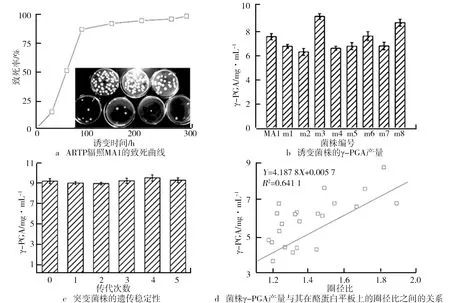
图6 ARTP辐照MA1的致死曲线、诱变菌株的γ-PGA产量、突变菌株的遗传稳定性以及菌株γ-PGA产量与其在酪蛋白平板上的圈径比之间的关系
3 结论
研究在筛选到一株高产γ-PGA纳豆菌的基础上,系统分析酪蛋白板初筛、多孔板复筛和摇瓶复筛,发现多孔板复筛与摇瓶复筛结果一致。其中,多孔板复筛与酪蛋白平板形成的纳豆菌的圈径比具有线性关联,这为直接应用酪蛋白平板初筛代替原用的平板初筛加多孔板复筛提供了依据。基于酪蛋白平板的透明圈快筛方法,从ARTP辐照的菌群中筛选出一株γ-PGA高产株,产量较出发菌株提升了22%,且遗传稳定性良好,表明酪蛋白平板的透明圈快筛方法有效,这大幅压缩了筛选的时间,显著提升了菌株诱变选育的效率。

