阿帕替尼联合DP方案化疗治疗晚期非小细胞肺癌患者的疗效评价
郑州大学附属郑州中心医院(450000)张小杰 邢国臣 谷见法 闫巧辉 姬丽萍 澎湃 郭晓丹 易善永
非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占肺癌类型中80%,由于早期症状无明显特异性,大部分患者就诊时已至晚期,错过最佳手术治疗时期,需通过化疗治疗[1]。目前临床治疗主要以延缓病情进展、延长患者生存期为目的,但铂类两联化疗易受患者耐药性等因素影响,降低治疗效果[2]。阿帕替尼是血管内皮生长因子受体-2(VEGFR-2)抑制剂,能有效阻断下游信号传导,阻止病情进展。因此,本研究选取我院收治的67例晚期NSCLC患者分组治疗,探讨阿帕替尼联合DP方案的临床效果,报道如下。
1 资料与方法
1.1 一般资料 选取2018年2月~2020年3月我院收治的67例晚期NSCLC患者,按照治疗方案分组,将采用DP方案化疗的32例作为DP组,将采用阿帕替尼联合DP方案化疗的35例作为联合组。DP组男15例,女17例,年龄55~73岁,平均(64.58±3.42)岁,病理类型:腺癌11例,鳞癌10例,腺鳞癌11例,临床分期:ⅢB期14例,Ⅳ期18例;联合组男16例,女19例,年龄53~72岁,平均(63.18±3.84)岁,病理类型:腺癌12例,鳞癌14例,腺鳞癌9例,临床分期:ⅢB期13例,Ⅳ期22例,两组基线资料(性别、年龄、病理类型、临床分期)均衡可比(P>0.05)。
1.2 纳入及排除标准 纳入标准:①经影像学检查、支气管镜检查、细胞学检查确诊为NSCLC;②ⅢB~Ⅳ期患者;③根据NCCN进行进行一线、二线治疗,包括全身化疗、治疗等,并接受过至少1个疗程以上治疗;④无大血管或中心性血管侵犯;⑤肝、肾、骨髓功能良好者;⑥患者知情并签署知情同意书。排除标准: ①预计生存时间<3个月;②凝血系统异常或咳血者;③合并其他原发性肿瘤;④依从性较差者;⑤Karnofsky评分<60分;⑥白细胞计数(WBC)<4×109L,血红蛋白(Hb)<80g·L,血小板计数(PLT)<80×109/L;⑦对本研究药物过敏者。
1.3 方法 DP组方案:75mg/m2多西他赛,静脉滴注,滴注时间大于1h,第1天;75mg/m2顺铂,静脉滴注,第1~3天。联合组在DP组基础上给予阿帕替尼,口服,500mg/次,1次/d,两组均治疗21d为1疗程,连续治疗2个疗程。
1.4 评估标准 完全缓解(CR):肿瘤完全消失,维持4周以上;部分缓解(PR):肿瘤缩小≥50%,维持4周以上;疾病稳定(SD):肿瘤面积减少<50%或增大<25%;疾病进展(PD):肿瘤面积增大≥25%或出现新病灶。CR、PR、SD计入疾病控制率。
1.5 观察指标 ①观察对比两组治疗效果。②统计对比治疗前后两组肿瘤标志物水平[癌胚抗原(CEA)、血管内皮生长因子(VEGF)、血清细胞角蛋白19片段(CYFRA21-1)]。分别于治疗前后抽取患者静脉血5ml,离心取血清,采用磁微粒化学发光法(试剂盒为北京利德曼生化股份有限公司)检测CEA,采用化学发光免疫法(试剂盒为武汉伊莱瑞特生物科技股份有限公司)检测VEGF,采用酶联免疫法(罗氏公司)检测CYFRA21-1。③统计对比两组生活质量。采用肺癌患者生存质量测定量表(FACT-L):总分38~190分,分值越高生活质量越好。④统计对比两组不良反应发生率(白细胞减少、恶心呕吐、血小板减少)。
1.6 统计学分析 采用SPSS22.0对数据进行分析,计量资料以(±s)表示,t检验;计数资料以n(%)表示,χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 治疗效果 联合组疾病控制率88.57%(31/35)高于DP组的68.75%(22/32),差异显著(P<0.05),见附表1。
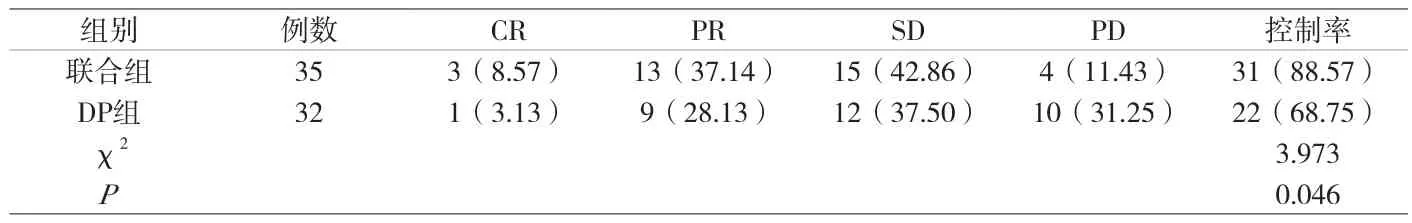
附表1 两组治疗效果比较[n(%)]
2.2 肿瘤标志物 治疗前,两组肿瘤标志物比较差异无统计学意义(P>0.05);治疗后,联合组CEA、VEGF、CYFRA21-1水平低于DP组,差异显著(P<0.05),见附表2。
附表2 两组肿瘤标志物指标比较(±s)
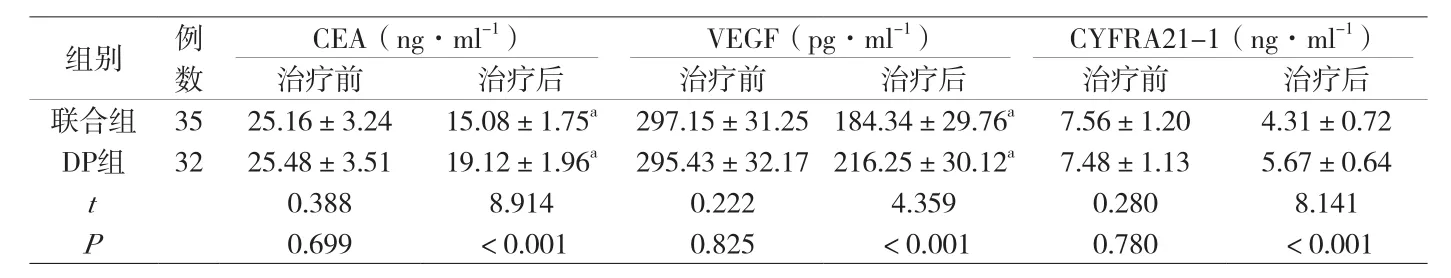
附表2 两组肿瘤标志物指标比较(±s)
注:CEA—癌胚抗原;VEGF—血管内皮生长因子;CYFRA21-1—血清细胞角蛋白19片段;与同组治疗前比较,aP<0.05。
组别 例数CEA(ng·ml-1) VEGF(pg·ml-1) CYFRA21-1(ng·ml-1)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后联合组 35 25.16±3.24 15.08±1.75a 297.15±31.25 184.34±29.76a 7.56±1.20 4.31±0.72 DP组 32 25.48±3.51 19.12±1.96a 295.43±32.17 216.25±30.12a 7.48±1.13 5.67±0.64 t 0.388 8.914 0.222 4.359 0.280 8.141 P 0.699 <0.001 0.825 <0.001 0.780 <0.001
2.3 FACT-L评分 治疗前,两组FACT-L评分比较差异无统计学意义(P>0.05);治疗后,联合组FACT-L评分高于DP组,差异显著(P<0.05),见附表3。
附表3 两组FACT-L评分比较(±s,分)

附表3 两组FACT-L评分比较(±s,分)
组别 例数 治疗前 治疗后联合组 35 103.65±5.29 163.18±12.86 DP组 32 102.13±5.17 135.28±12.07 t 1.188 9.133 P 0.239 <0.001
2.4 不良反应发生率 联合组出现白细胞减少2例,恶心呕吐1例,血小板减少1例;DP组出现白细胞减少1例,恶心呕吐1例。联合组不良反应发生率11.43%(4/35)与DP组6.25%(2/32)比较,差异无统计学意义(χ2=0.550,P=0.458)。
3 讨论
肿瘤新生血管形成基础为内皮细胞增殖,调节内皮细胞增殖最主要因子为VEGF,VEGF可增强肿瘤存活与入侵能力,并能抑制机体内抗肿瘤免疫反应,因此,近年抗血管生成靶向药物成为目前治疗晚期NSCLC的热点[3]。
多西他赛可通过抑制微管蛋白解聚、增强微管蛋白聚合形成稳定微管束,从而抑制肿瘤细胞分裂,且药效时间长,与顺铂不会产生交叉耐药[4]。阿帕替尼属小分子抗血管生成靶向药物,可选择性与VEGFR-2结合,促使依赖VEGFR-2通路的血管内皮生长因子生成减少,降低丝裂原活蛋白激酶活化,从而降低VEGF水平,阻断VEGF传导,抑制酪氨酸激酶活性、血管内皮细胞增殖,起到抗肿瘤作用[5]。本研究结果显示,联合组疾病控制率高于DP组,提示阿帕替尼联合DP方案治疗晚期NSCLC患者疗效显著。分析原因:阿帕替尼能有效抑制肿瘤血管生成,缓解肿瘤进展与转移,从而发挥抗肿瘤作用。
CEA是非器官特异性肿瘤相关抗原,存在于胚胎组织与癌组织中,可促进肿瘤细胞与机体内正常细胞结合;VEGF可通过与靶细胞结合,抑制内皮细胞凋亡,促进血管内皮细胞增长,致使肿瘤不断新生血管,从而加重患者病情;CYFRA21-1为细胞角蛋白19的2个单克隆抗体,为细胞骨架标志物,主要分布于机体乳腺上皮、肺,正常时机体含量较低,发生癌变时,灵敏度较高[6]。本研究结果显示,治疗后联合组CEA、VEGF、CYFRA21-1水平低于DP组,提示阿帕替尼联合DP方案化疗可有效降低晚期NSCLC患者机体内肿瘤标志物水平。分析原因:阿帕替尼能靶向性抑制VEGF释放与内皮细胞增殖,产生生物调控机制,促进血管通透性增强,通过影响肿瘤血管产生抗肿瘤作用,且二者联合能加强抗肿瘤药效,降低患者机体内肿瘤标志物表达水平。晚期NSCLC患者确诊后需实施化疗、放疗等,但由于不良反应较多,多数难以忍受,影响患者生活质量[7-11]。本研究结果显示,治疗后联合组FACT-L评分高于DP组(P<0.05),表明二者联合可提升患者生活质量。化疗中使用阿帕替尼可有效控制病情进展,并且阿帕替尼所特有的抗肿瘤作用可减轻药物、化疗中所产生的不良反应,因此,阿帕替尼联合DP方案治疗晚期NSCLC安全性高。
综上所述,阿帕替尼联合DP方案治疗晚期NSCLC能有效改善患者肿瘤标志物水平,提高患者生活质量,疗效显著,不良反应少。

