经皮超声引导下穿刺活检诊断胰腺病变的临床应用价值
苏林娜,李涛,周敏,王建宏
胰腺癌(pancreatic cancer,PC)是一种预后不良的致死性疾病,近年来发病率不断增加[1]。早期PC因无特异性症状诊断较困难,且易侵犯毗邻的大血管,所以大多数人发现时已无法手术切除[2]。对于不可切除或可切除但不宜手术的PC患者在放疗和(或)化疗之前,以及临床上难以鉴别的胰腺占位病变患者,都需要活检明确诊断。超声引导下(ultrasound-guided,US-guided)经皮穿刺活组织检查(percutaneous needle biopsy,PNB)是获取组织的方法之一,具有实时监测、操作简单、成本低、无放射性等优势[3]。然而,胰腺为腹膜后器官,PNB潜在的并发症限制了该技术的广泛开展。现回顾本中心US-guided PNB应用于胰腺病变患者的临床资料,探讨该技术广泛应用于诊断胰腺病变的临床价值。
1 资料与方法
1.1 研究对象
回顾性分析2009年1月至2018年6月在第四军医大学西京消化病医院超声诊疗中心行US-guided PNB的胰腺病变住院患者285例,其中男性174例,女性111例;年龄12~83岁,平均年龄(56.8±10.1)岁。所有患者术前影像学检查均提示胰腺占位性病变,包括局灶性病变276例(最大径为1.2~11.3 cm,平均4.3±1.3 cm;病灶位于头颈部162例、体部33例、尾部44例,同时累及头体部或体尾部37例),弥漫性病变9例;实性病灶268例,囊、实性病灶17例。由2名从事介入超声工作5年以上的医师实施穿刺活检。手术并发症情况通过查阅病程记录、影像随访和实验室检查获得。本研究患者纳入标准:①影像学检查(包括上腹部增强CT、核磁共振MRI、腹部B超、超声造影等)提示胰腺存在明确的占位性病变;②超声引导线实时引导下存在安全的穿刺路径,穿刺过程中通过调整角度、探头加压等方法确保能够避开胃肠道和血管。排除标准:①发热患者;②有严重出血倾向,如血小板低于50×109/L,和(或)存在难以纠正的凝血功能障碍患者;③同时合并心、肺、脑等重要器官严重疾病,无法耐受手术者;④因过度肥胖或腹部胀气等原因超声不能清晰显示病变者;⑤因其它各种原因患者难以配合者。本研究获得伦理委员会批准。
1.2 设备与器械
采用Philips IU22和GE LOGIQ E9彩色多普勒超声诊断仪,凸阵探头频率3.5~5.0 MHz并配备穿刺引导架;美国Bard公司Magnum®全自动活检枪,Bard Magnum 18 G和20 G活检针。
1.3 穿刺前准备
术前查血常规、凝血功能,并评估心、肺功能等,排除穿刺禁忌证及麻醉药物过敏史等;禁食、水8 h以上;术前谈话尽量缓解患者紧张和恐惧心理,取得患者配合并签署手术知情同意书。
1.4 穿刺活检
常规二维超声显示病变的大小、位置、与毗邻脏器及结构的关系,彩色及能量多普勒观察病变内部血流及与周围血管的关系。一般采取平卧位,经前腹壁路径进行经皮穿刺,要求避开胃肠道及重要脏器等结构,存在胃肠道梗阻者可行胃肠减压及药物治疗后再择期穿刺。一般选取胰腺病变径线最大处或回声明显异常处作为穿刺靶目标,必要时可通过变换体位、探头加压、呼吸配合等方法尽量清晰地显示病变,并标记皮肤穿刺点。常规消毒、铺巾,局部浸润麻醉后,超声实时监测下插入活检针,抵达病灶表面时触发活检枪。常规穿刺2针,样本长度>5 mm为取材满意,取材不满意者可加做1~3针,仍不满意者视为穿刺失败。所取组织样本置于10%甲醛溶液固定后送病理学分析。术后局部加压包扎,平卧休息并继续禁食4~6 h,给予止血、抗感染及抑制胰液分泌药物,密切观察生命体征和腹部体征。
1.5 最终诊断标准
经外科手术治疗者,以术后病理结果作为最终诊断;未经外科手术治疗者,经临床随访1年以上结果为最终诊断:1年内病情进展死亡,或未死亡但影像学提示病灶增大、增多或有新病灶出现者视为恶性,随访1年病灶无进展且患者一般情况良好者视为良性[3-5]。
1.6 统计学方法
2 结果
2.1 穿刺取材
所有患者均成功取材,头颈部取材169例,体部60例,尾部56例;18G活检针取材70例,20G活检针取材215例;1针取材5例,2针取材143例,3针取材119例,4针取材16例,5针取材2例,平均每例穿刺(2.53±0.59)针。285例患者中269例取材满意,取材满意率94.4%。
2.2 活检病理学诊断
本组285例患者中,诊断为良性病变56例,其中包括慢性炎症45例,急性炎症4例,自身免疫性胰腺炎3例,实性-假乳头状瘤2例,胰腺囊肿1例,结核1例,恶性病变198例,其中包括导管腺癌177例,神经内分泌肿瘤10例,转移癌6例,黏液腺癌2例,腺鳞癌1例,髓系白血病累及胰腺1例,肌纤维母细胞肉瘤1例。因组织过少无明确诊断13例,仅提示未见恶性证据18例,病理明确诊断的诊断率为89.1%。
2.3 诊断性能
272例超声引导下经皮穿刺活检诊断胰腺恶性病变的准确率92.7%,灵敏度90.8%,特异度100%,阳性预测值100%,阴性预测值为72.9%,见表1。本组中体尾部取材的诊断准确率和灵敏度均略高于头颈部,差异具有统计学意义(P<0.05),而两组的阴性预测值比较无统计学差异(P>0.05),见表2。

表1 272例胰腺病变超声引导下穿刺活检病理学诊断与临床最终诊断比较 (n)
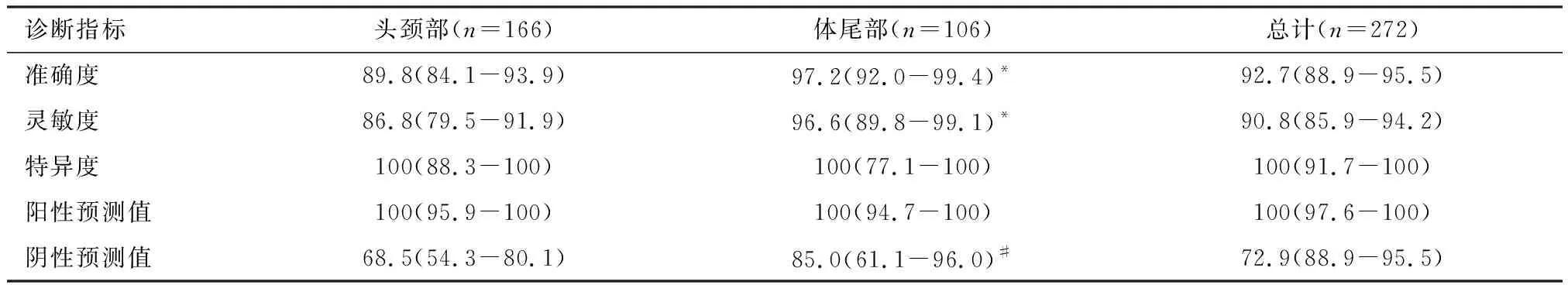
表2 头颈部和体尾部活检取材的诊断性能比较 [%(95%可信区间)]
2.4 并发症
术后发生急性胰腺炎3例,血清淀粉酶升高,最高分别达到1 425、1 732和1 200 U/L,经药物治疗恢复正常,其中合并胰腺周围积液1例,经穿刺置管引流后消失。术后24 h内出现轻-中度腹痛73例,均未经处理自行缓解,头颈部取材后出现腹痛54例,体尾部取材后出现腹痛19例,头颈部取材后出现腹痛的患者多于体尾部,差异具有统计学意义(P<0.05)。本组中未出现肠穿孔、腹腔出血、肿瘤针道种植和死亡等其它严重并发症。
3 讨论
胰腺病变活体组织检查技术包括外科手术活检、PNB和超声内镜下细针抽吸活检(endoscopic ultrasonography-guided fine needle aspiration,EUS-guided FNA)[3, 6]。外科手术活检发病率与死亡率较高,已很少使用,通常作为最后的方法[7]。EUS-guided FNA的应用虽然越来越广泛,但是该技术既昂贵又耗时,并不适用于所有中心。CT或US引导下的PNB技术是获得病理学诊断的可靠、安全、有效的方法[8-10],尤其US引导下的PNB具备操作简单、成本低、无辐射、实时监视等优势[11-12],有利于更多中心的开展。
PNB根据标本采集方式分为针吸活检(fine needle aspiration,FNA)和核心活检(core needle biopsy,CNB)。FNA一般采用20~25 G的细针取材,仅能提取细胞进行细胞病理学诊断,而CNB则采用14~20 G组织切割针取材,所获标本量充足,可进行组织学评估[3, 8, 11]。本中心在US引导下经皮穿刺对胰腺病变进行活检,常选用18 G或20 G切割活检针。一般经前腹壁路径取材,位于胰头和钩突的病变可能被结肠、胃或十二指肠所遮盖,在这种情况下一些研究者会采用经肝、经胃肠途径[3-4, 12-13],而本中心为尽量避免并发症,会通过探头加压或改变体位等方法避免穿刺针经过胃肠道,无法避开则会采取内镜下活检等其它方法。
诊断率的高低取决于所获得标本的质量和病理医生的诊断水平,本组中272例患者获得明确诊断,诊断率为95.4%,这与Bhatti等[3, 7]研究结果相近。庄博文等[12]对104例胰腺病变患者进行超声引导下经皮穿刺活检,其诊断准确率、灵敏度和特异度分别为91.8%、90.1%和100%。Huang 等[6]回顾分析13项研究表明US引导下经皮穿刺活检诊断胰腺病变具备较高的灵敏度(平均:94.4%,范围:90%~100%)和特异度(平均:97.9%,范围:94.7%~100%),平均诊断准确率为95.8%,平均阴性预测值为76.3%。本研究中的诊断准确率、灵敏度和特异度分别为92.7%、90.8%和100%,阳性预测值和阴性预测值分别为100%和73.0%,均与上述研究结果相近。一些研究者认为胰头部病变进行穿刺活检的诊断率、敏感性、特异性、阴性预测值及准确率均高于胰体部及尾部[6-7],而Brandt等[14]认为胰腺体部或尾部病变活检准确率略高于胰头部病变,另有Yang等[15]认为头颈部和体尾部取材在所获得任何参数上都没有统计学意义。本研究结果显示体尾部活检取材的准确度和灵敏度略高于头颈部,而两组的阴性预测值比较无统计学差异。我们认为产生不同研究结果是因为这些诊断参数除了受到取材样本和病理诊断者影响外,病变的大小、成分和患者病程阶段都有可能会对结果产生影响。
本组患者术后发生急性胰腺炎3例,发现胰腺周围积液1例,经过药物治疗和经皮置管引流术后治愈。24 h内出现轻-中度腹痛的73例患者中,头颈部取材者54例,明显多于体尾部取材者,原因可能是由于胰头颈部周围解剖结构较复杂,因此,在头颈部取材前需更加细致的识别穿刺路径上的各种组织结构,穿刺路径尽量短且要避开血管等重要结构。本组中未出现肠穿孔、出血、肿瘤针道种植、死亡等其它严重并发症。
本研究中存在选择性偏倚,为避免出现并发症,所纳入的患者在穿刺活检时均成功避开胃肠道,会对诊断结果和并发症产生一定影响;另外,研究中采用18G和20G两种型号的切割活检针,需要进一步分组以排除不同粗细活检针对结果的影响。
综上所述,超声引导下经皮穿刺活检是诊断胰腺病变准确、安全的方法之一,其操作简单、快捷,有利于更加广泛的开展[16]。

