茶多酚抗炎和促外伤愈合作用及其机制
赵航晔,夏琛,2,何普明,屠幼英*
(1.浙江大学农业与生物技术学院茶学系,杭州310058;2.杭州英仕利生物科技有限公司,杭州310015)
活体动物开放性伤口的愈合是一个由多种生理生化反应所组成的复杂过程,一处伤口的愈合往往同时涉及整个生物机体的多个器官与组织和多种细胞、酶、激素等的生理反应。其过程大致可以划分为炎症反应阶段与新组织形成阶段。在炎症反应阶段,主要是机体产生多种免疫细胞来清除伤口处的各种杂质,防止病原体通过开放性伤口进入机体的循环系统;在新组织形成阶段,伤口处产生大量的肉芽组织,直至伤口处完全愈合,肉芽组织的增殖与迁移速率直接影响伤口愈合的速率。
目前,促进伤口愈合药物的作用机制主要有以下2 方面:其一,药物在炎症反应阶段的作用,部分药物可直接刺激机体免疫系统产生更多的免疫细胞,从而加速炎症反应的进行。其二,药物在新组织形成阶段的作用,部分药物能够促进伤口处肉芽组织的形成与转移,或提高肉芽组织细胞的活力与分化能力,以加速伤口处新组织的形成。目前,已有研究报告证实,一些具有抗氧化、抗自由基功能的化合物及天然产物具有促进伤口愈合的功效,如马黛茶提取物[1]、表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)[2]、木蝴蝶提取物[3]、单环氧生育三烯酚-α[4]、维生素C[5-6]等。茶多酚作为一种从茶叶中提取的天然抗氧化剂,近年来,国内外多项研究成果表明其在体外细胞培养条件下,能够有效促进人和动物成纤维细胞的增殖以及迁移[7-8],促使胶原蛋白的产生[9],对开放性伤口的愈合具有促进和加速作用;同时,茶多酚能够有效清除自由基[10]并且抑制伤口处多种致病菌的生长繁殖,即能够有效预防伤口出现感染性炎症[11-12];此外,茶多酚也能够于伤口愈合后期在基因层面上抑制MMP-1和IL-1β基因的表达,防止伤口处过度的炎症反应[13-14]。然而,以上相关研究多停留在体外细胞试验阶段,茶多酚在活体动物伤口愈合过程中是否有效以及相关的作用机制并不清楚。为此,本文通过建立小鼠伤口模型,涂抹茶多酚后观测伤口愈合情况并检测相关指标变化,旨在探究茶多酚在活体动物外伤愈合过程中的作用并阐明其相关机制。
1 材料与方法
1.1 材料
试验动物:5周龄雄性ICR小鼠48只,购于浙江省实验动物中心。
1.2 试剂
试验药品:96% 茶多酚复合物(含茶多酚96.02%,咖啡碱1.60%),购于杭州英仕利生物科技有限公司;肝素钠、氯化钠、无水乙醚、无水乙醇、组织固定液(4%多聚甲醛)、人工细胞愈合膜,购于杭州积好脂质体有限公司。
试剂盒:小鼠超氧化物歧化酶(superoxide dismutase, SOD)酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒、小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(ELISA)试剂盒和小鼠白细胞介素-2(interleukin-2,IL-2)酶联免疫吸附测定(ELISA)试剂盒,均购于武汉基因美生物科技有限公司。
1.3 仪器设备
Infinite M200 PRO 酶标仪(瑞士Tecan 公司)、AUX 理发器B8(浙江省宁波市奥克斯集团有限公司)、5804R高速离心机(德国Eppendorf公司)、恒温培养箱(美国Shellab制造公司)。
1.4 试验方法
1.4.1 试验分组及造模
茶多酚溶液按如下方法配置:准确称取5.21 g 96%茶多酚复合物,加入适量蒸馏水并通过温水浴(40~50 ℃)加热至完全溶解后,定容于500 mL 容量瓶中,配置成1.0%茶多酚溶液。以1.0%茶多酚溶液为母液,按照不同稀释倍数分别配置成0.3%、0.5%、0.8%茶多酚溶液。
创伤模型按如下方式制作:首先对小白鼠进行麻醉,让其俯卧,选取小白鼠背部靠近臀部一段,以脊柱作为中轴线,使用理发器对小鼠背部进行剃毛处理,剃毛范围2 cm×3 cm;使用消毒处理后的铅笔、镊子、手术刀、剪刀于小鼠背部剃毛处制造大小为1 cm×1 cm 的伤口,伤口深度至筋膜层。具体操作方法为将小鼠麻醉后使用铅笔在其背部进行标记,描绘边长为1 cm 的正方形,然后用镊子夹起外层皮肤,用剪刀沿铅笔标记处小心剪开,最后用手术刀将皮肤切下。使用该操作方法时应尽可能保证小鼠背部皮下筋膜层完整,肌肉和骨骼不受伤害[1,15-16],参考《实验动物 福利伦理审查指南》(GB/T 35892—2018)的规定进行试验。
给药方法如下:阳性对照组涂抹药物为人工细胞愈合膜,使用消毒后的卫生棉签进行给药,给药时需保证伤口被药物完全覆盖。空白对照组为伤口模型制作后,不进行任何处理。茶多酚试验组给药量为每次50 μL,即使用移液枪吸取相应含量的茶多酚溶液50 μL,小心滴至伤口处,使用消毒后的卫生棉签将茶多酚溶液完全涂抹均匀(卫生棉签已在相应含量的溶液中完全浸润)。各组给药时间均为晚上8:00,每天一次,持续9 d,每3 d观测伤口大小并拍照。给药期间,每天早、中、晚进行观察,同时对伤口处沾染的异物进行清理[17]。处理9 d后,用乙醚将小鼠麻醉取血、处死,留存小鼠血清及伤口处皮肤,备用。
1.4.2 肉眼观察
分组试验开始后,每3 d 对各组小鼠伤口大小进行测量并拍照,粗略计算各组小鼠伤口的缩小比例,计算公式如下:小鼠背部伤口缩小比例/%=(初始时小鼠伤口面积/cm2-处死时小鼠伤口面积/cm2)÷初始时小鼠伤口面积/cm2。在计算以上小鼠伤口面积时,均将小鼠伤口近似地看作矩形,根据长×宽的方式进行计算,并求各组平均值作为感观的伤口愈合速率比较指标。
1.4.3 小鼠血清中TNF-α 及IL-2 含量测定
分组试验9 d后,将小鼠处死并取血,小鼠血液收集于预先加入肝素钠的离心管中,在4 ℃、2 500 r/min 条件下离心10 min,收集上清液,保存于4 ℃冰箱中,于1周内完成测样。
工地上开展了全面质量管理活动,从坡口、组对点焊到无损探伤,每个工序都严格把关,经过自检、互检和专业人员检查,对照质量标准取得数据,然后绘制质量管理系统表和分析表,使每个焊工一目了然,都能及时了解和掌握自己每天的焊接速度和质量,从而调动了大家提高质量的自觉性与劳动积极性。
使用小鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒、小鼠白细胞介素-2(IL-2)酶联免疫吸附测定(ELISA)试剂盒对小鼠血清进行测定,通过测定所得数据,分析茶多酚处理对受伤小鼠免疫系统的影响。试验具体操作方法按试剂盒说明书进行。
1.4.4 小鼠血清SOD 水平测定
使用SOD 酶联免疫吸附测定(ELISA)试剂盒测定小鼠血清中SOD含量,研究茶多酚对小鼠伤口处自由基的清除情况。试验具体操作方法按试剂盒说明书进行。
1.4.5 伤口处皮肤苏木精-伊红(hematoxylin-eosin,HE)染色切片
将小鼠处死并取血后,以伤口为中心取2 cm×2 cm 表皮,置于组织固定液(4%多聚甲醛)中固定24 h以上,随后对样品进行脱水、包埋、切片,在光学显微镜下观察伤口情况,主要观察肉芽组织中成纤维细胞的生长、增殖情况以及胶原纤维、新毛细血管的生成情况,并使用目镜网格计数法对成纤维细胞、毛细血管进行计数。
1.5 数据统计与分析
试验所得数据均使用SPSS 25.0 软件进行统计与分析,使用t 检验进行组间显著性分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 茶多酚对伤口愈合效果的观察
使用不同含量的茶多酚对各组小鼠处理9 d后观察其伤口宏观变化,结果如图1 所示。试验结果表明,阳性对照组以及空白对照组伤口颜色较浅,而茶多酚处理组伤口颜色较深。其中:在试验3 d后,阳性对照、0.3%和0.5%茶多酚处理组的伤口变化较明显,伤口面积明显减小;在试验6 d 后,空白处理组的伤口面积也明显减小,而0.8%和1.0%茶多酚处理后的伤口变化并不明显。
处理9 d 后,各处理组伤口面积变化如表1 所示。从中可知:当茶多酚处理的质量分数在0.3%及0.5%时,茶多酚能够较为明显地提升伤口的愈合速率,其对伤口的早期止血结痂具有明显的加速作用,优于阳性对照组和空白对照组。在伤口形成3 d 后,0.3%及0.5%茶多酚处理组伤口面积均减小约50%,表明较低含量的茶多酚在伤口愈合早期对伤口处的血液凝结以及炎症反应具有一定的促进作用,但较高含量茶多酚会减缓小鼠伤口愈合速率。
2.2 茶多酚对血清中TNF-α 及IL-2 含量的影响

图1 小鼠背部伤口肉眼观察结果Fig.1 Eye observation results of the back wound in mice
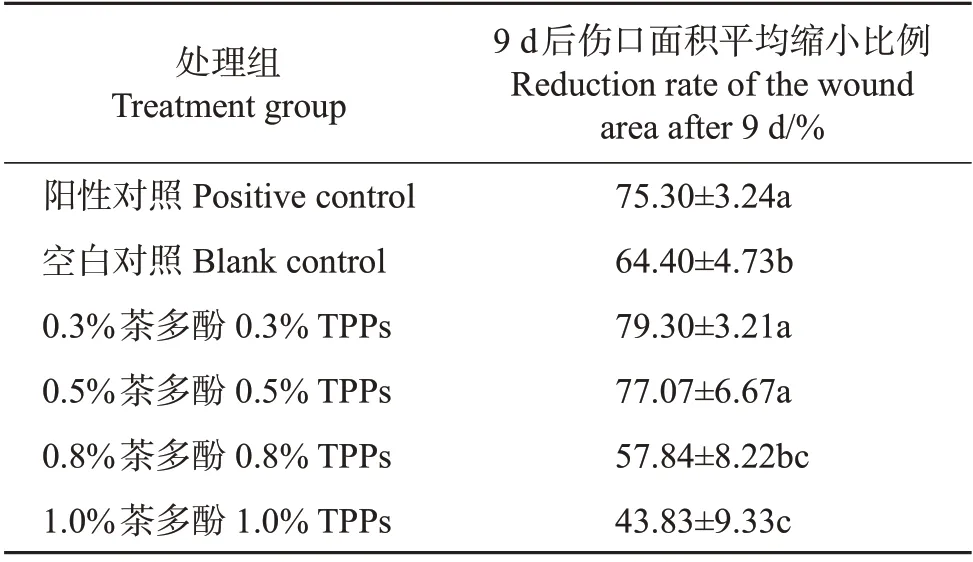
表1 各处理组伤口面积缩小比例Table 1 Reduction rates of the wound area in each treatment group
肿瘤坏死因子(TNF-α)是生物体内重要的免疫调节因子,在免疫调节过程中,TNF-α 作为一个“启动环节”,对生物体内的各项免疫应答都起到了重要的调节作用[18]。生物体血清内的TNF-α 浓度可以比较直观地显示出该生物体的免疫应答状态。IL-2 主要来源于活化的T 淋巴细胞,它能够保证T淋巴细胞在体液中维持正常的形态与功能,同时,也能够激活其他多种免疫细胞,增强机体的免疫反应,是一种在炎症反应阶段发挥重要作用的细胞因子[19]。本试验测定的小鼠血清中TNF-α 及IL-2 含量如表2所示。
阳性对照组的TNF-α 及IL-2 含量显著低于空白对照组,说明该组小鼠体内针对创伤的应激免疫反应已恢复至正常水平。各茶多酚处理组中,与空白对照组相比,0.5%茶多酚处理组的TNF-α和IL-2含量显著降低,0.3%、0.8%、1.0%茶多酚处理组的TNF-α 含量下降不明显,IL-2 含量显著降低,说明一定质量分数的茶多酚(1.0%TPPs)能在炎症反应阶段后期显著地降低小鼠体内免疫因子的含量,防止小鼠出现免疫过度现象。与阳性对照组相比,较低质量分数(0.3%、0.5%)的茶多酚处理组中的TNF-α、IL-2 含量仍然较高。此外,与0.5%茶多酚处理组及阳性对照组相比,1.0%茶多酚处理组的TNF-α 含量显著升高;比较各组IL-2 含量也发现,0.3%与0.5%茶多酚处理组均与空白对照组之间差异极显著,0.5%与0.8%茶多酚处理组之间差异显著。以上结果表明,茶多酚对受伤小鼠炎症反应阶段后期体内炎症反应的抑制作用受到茶多酚含量的影响,在含量较低时(0.8%以下),其抑制效果较好,且0.5%茶多酚具有最好的抑制效果,之后随着茶多酚含量的升高,其抑制作用减弱。
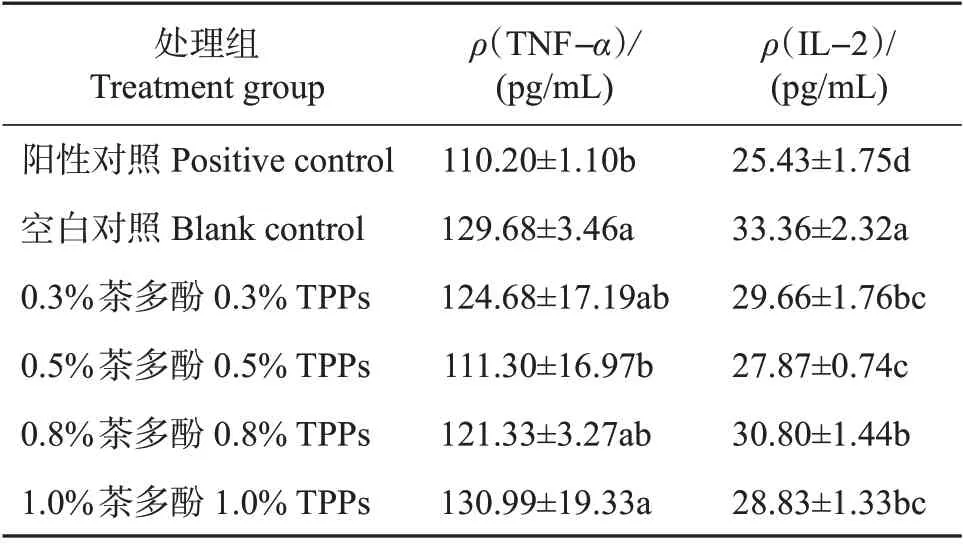
表2 各处理组小鼠血清中TNF-α和IL-2含量Table 2 Concentrations of TNF-α and IL-2 in mice serum of each treatment group
2.3 茶多酚对SOD 含量的影响
SOD 是一种生物体内的活性物质,简而言之,SOD 具有抗氧化作用,在体内可催化自由基的歧化反应,消除体内过量的自由基,以免其对机体造成损害,延缓机体衰老。小鼠在受到创伤后,由于炎症反应,受伤小鼠体内会产生大量的自由基,诱导机体产生更多的SOD 以消除体内过量的自由基[20]。
本试验测定的小鼠血清中SOD 含量如表3 所示。与空白对照组相比,阳性对照组机体内SOD含量并无显著性差异,这是由于人工细胞愈合膜主要作用于新组织形成阶段,对于清除伤口处的自由基并没有明显作用。而与空白对照组相比,茶多酚处理组试验小鼠体内SOD 含量均显著降低。一般来说,正常健康小鼠体内SOD 处于较低水平,而在受伤或应激小鼠体内,机体受自由基的刺激产生大量的SOD,可清除炎症过程中伴随产生的自由基,因此,在一般情况下机体内较高水平的SOD可相应地说明其体内丙二醛(malondialdehyde,MDA)等过氧化物含量较低。在本试验中,茶多酚作为一种外源物质直接施用于伤口处,而茶多酚作为一种天然产物具有良好的清除自由基的功能,因此,推测这一试验结果可能是由于茶多酚能够在一定程度上直接清除伤口处自由基,从而使得机体内SOD仍维持在较低水平。
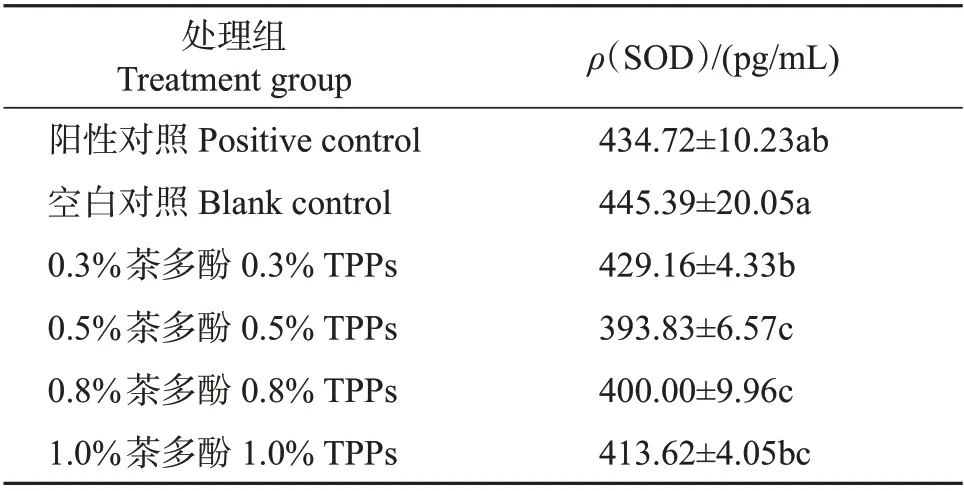
表3 各处理组小鼠血清SOD含量Table 3 Concentrations of SOD in mice serum of each treatment group
2.4 HE 染色切片结果
HE 染色切片结果如图2 所示。除空白对照组及1.0%茶多酚处理组外,其余各组切片均显示小鼠伤口处肉芽组织内有大量毛细血管生成。同时也可以观察到,各组小鼠肉芽组织内均能够产生大量的成纤维细胞及胶原纤维束,且各组的数量并没有太大差别,说明各组处理均不会影响生物体在新组织形成阶段的正常生理功能。但可以发现,在完全不敷药的情况下,伤口处肉芽组织新血管形成较为缓慢,且胶原纤维束较细;而在1.0%茶多酚处理情况下,也出现了类似的状况,即肉芽组织新血管形成较少。不过,在本次试验所得的HE 染色切片中并未发现明显的中性粒细胞,这可能是由于试验时间过长,小鼠伤口处炎症反应阶段已基本结束,中性粒细胞浸润速率降低。
使用目镜网格计数法对成纤维细胞与血管进行计数,结果如图3所示。结果表明:与空白对照组相比,用0.3%及0.5%的茶多酚处理伤口,对伤口处成纤维细胞的增殖没有显著影响,而在0.8%、1.0%较高质量分数的TPPs处理下,成纤维细胞的增殖受到显著抑制。在本试验中,计数血管为真皮层静脉血管,且HE切片为纵切面,视野中的血管分布不均匀,主要靠近表皮层和皮下组织的两侧,因此,按4 μm厚度切片,对每厘米真皮层中所含有的血管数量进行计数,结果发现:与空白对照组相比,0.3%和0.5%茶多酚处理组血管数量有所增加,茶多酚对血管的形成有一定的促进作用,然而各组数据与空白对照组相比并无显著性差异。以上结果表明,用较低含量的茶多酚对伤口进行处理,可加速伤口处肉芽组织的增殖,加快新毛细血管的形成,从而加速伤口愈合。

图2 肉芽组织HE染色切片Fig.2 HE staining sections of granulation tissue
3 讨论与结论
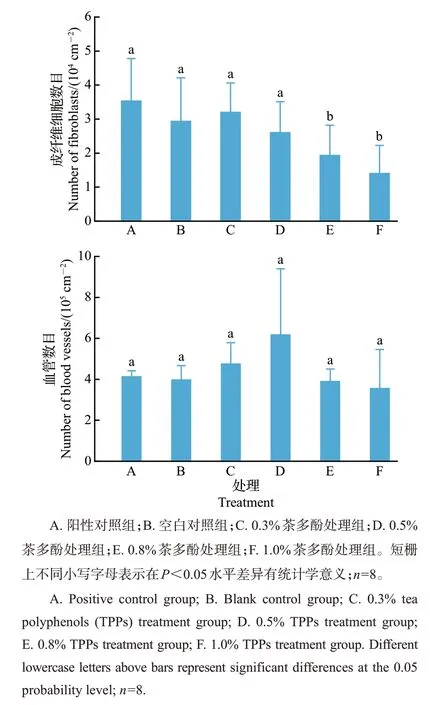
图3 成纤维细胞与血管数目计数结果Fig.3 Number of fibroblasts and blood vessels
综上所述,可以从如下几点来阐明茶多酚促外伤愈合的部分机制:1)茶多酚可以加速伤口处炎症反应,并在炎症反应后期抑制部分免疫细胞因子(如IL-2)的生成,防止炎症反应过度;2)茶多酚可能具有清除伤口处因炎症反应而生成的大量自由基的作用,以防止自由基对伤口处新生组织的破坏;3)茶多酚可能具有加速伤口处肉芽组织的增殖和组织内部新血管生成的作用。同时,研究发现,茶多酚对小鼠外伤愈合的促进效果受到茶多酚质量分数的影响,0.5%茶多酚处理下效果最好,而当质量分数过高(0.8%以上)时,则会减缓外伤愈合。本试验测定的TNF-α 含量在茶多酚各处理组中普遍较低。TNF-α作为一种“启动因子”,影响伤口愈合阶段成纤维细胞的增殖以及其他细胞因子例如IL-2、IL-6等的表达与释放,因此,推断茶多酚处理可加速小鼠受伤后的免疫应答,在较短时间内即可使TNF-α恢复至正常水平。
我国是茶叶生产大国,在一些产茶地区,流传着使用茶渣、浓茶水外敷处理伤口的偏方,国内也有研究表明,茶多酚中的EGCG 在一定浓度下可影响受创伤小鼠体内一些白细胞介素的表达[14];ER等[7]指出,茶多酚可促进成纤维细胞的增殖。以上研究均表明茶多酚在促进伤口愈合方面有一定的研究价值和应用潜力。2013年,ASADI等的研究指出,0.6%绿茶乙醇提取物(主要功效成分为茶多酚)在混合凡士林后敷于小鼠外科手术伤口处,可加速伤口处毛细血管生成及伤口愈合[21];该团队同时还指出,凡士林混合0.6%绿茶乙醇提取物对小鼠烧伤伤口的愈合有一定的帮助[22],但他们未对不同浓度绿茶提取物进行相关试验,因而茶多酚促进伤口愈合的适宜浓度范围并未确定。由于茶多酚具有一定的生物毒性,在较高浓度条件下对人体正常细胞有一定的毒副作用,其对正常细胞的半抑制浓度(IC50)一般在200 μg/mL左右,但鲜有茶多酚作为皮肤外敷药的适宜浓度的探究。本试验所选取的茶多酚浓度是在前人研究的成果上进行的探究,可作为该研究结果的补充和深入。在试验过程中发现,茶多酚处理组小鼠伤口处颜色较深,推测其可能的原因为接触较高浓度茶多酚溶液导致外层细胞坏死或茶多酚在伤口处堆积并氧化后变成褐色。试验整体结果进一步探寻了茶多酚作为创伤药物的适宜浓度以及作为外敷药时对机体的生物毒性,为将来可能的医学应用提供了一定的理论基础。
对目前市场上各类创伤药物进行调研可以发现,市售各类药物均以复合药物为主,单一功效成分的药物存在较大的局限性,并不能发挥最大的治疗功效。如QIN等[23]利用茶多酚及EGCG与壳聚糖复合治疗创伤伤口并取得了较好的功效,该研究表明,茶多酚及EGCG 在与壳聚糖复合后均能显著提升伤口愈合效果。本试验在QIN 等的研究基础上进一步探索茶多酚作为单独药物使用时对伤口愈合的作用机制,以期排除壳聚糖等干扰因素,为将来更多样化的药物复合选择提供一定的理论依据。因此,在今后研究中可考虑探究茶多酚与其他相关药物(例如大黄、乳香、儿茶、血竭等中草药)之间的相互影响及联合作用,制作以茶多酚为主,其他药物为辅的复合药物,提高该类药物的治疗效果。值得注意的是,茶多酚并不是一种单一的化合物,而是茶叶中多酚类物质的总称,因此,探究茶多酚中某些单体(例如EGCG 等)的愈伤作用也可作为研究重点,从而进一步提高相关药物的愈伤效率。除此之外,活体动物伤口的愈合除考虑愈合速率外,还需考虑愈后的伤口美观度,伤口愈合美观度与伤口处各类型胶原蛋白的产生量及其比值有关。有研究者认为,若Ⅰ型胶原蛋白和Ⅲ型胶原蛋白在机体内生成的比例不当,容易在伤口愈合后形成较大面积的瘢痕[24]。本次试验初步证明了茶多酚在伤口愈合后期具有加速伤口处新组织形成的功效,且伤口处宏观观察结果显示,茶多酚处理组小鼠愈后美观度较好,新生毛发生长情况正常。该试验结果为后续茶多酚作为一种创伤药物的祛疤功能研究提供了一定的理论基础。
总之,在如今茶叶产能逐渐过剩的背景下,研究茶多酚对于伤口愈合的影响具有一定的现实意义。通过本次试验,初步证明了适宜含量茶多酚可宏观上加速伤口愈合,减轻愈伤后期伤口处免疫应答的激烈程度,同时对伤口处真皮层肉芽组织的增殖和血管的形成有一定的积极影响。

