盐酸安罗替尼治疗非小细胞肺癌的临床研究
文 璐,刘元明
(四川省彭州市人民医院呼吸与危重症医学科,四川 成都 611930)
非小细胞肺癌(non-small cell lung cancer,NSCLC)侵袭性强,进展迅速,多数患者已无法手术治疗,只能保守治疗[1]。化疗是NSCLC保守治疗的重要选择,该疗法尽管可缩减病灶体积,延长患者生命,但一二线治疗疗效并不显著,且常易导致严重的不良反应[2]。分子靶向药物可特异性结合肿瘤细胞致癌位点,导致细胞特异性凋亡,毒副作用小,患者接受度高[3]。资料显示,作为分子靶向药物,盐酸安罗替尼在NSCLC治疗上优势明显[4]。我院将盐酸安罗替尼应用于NSCLC的临床治疗,以评价其疗效及安全性,为该病的临床治疗提供参考。
1 资料与方法
1.1 一般资料2015年1月至2018年12月在我院治疗NSCLC患者146例,纳入标准:经影像学诊断,根据其特点确定为NSCLC;无法行手术治疗;接受≥2种系统化疗后进展或复发;排除标准:间变性淋巴瘤激酶(ALK)、表皮生长因子受体(EGFR)检测阳性;中央型肺鳞癌;本研究药物不耐受;预期生存<3个月;合并其他癌症;肝肾功能异常;依从性差。按照随机数字表法分为试验组与对照组各73例,两组基线资料比较,差异无统计学意义(P>0.05),见表1。经医院医学伦理委员会批准,患者知情同意。

表1 两组患者基线资料比较
1.2 方法对照组行NP方案化疗:长春瑞滨(商品名:诺维本;生产厂家:法国皮尔法伯制药公司;批号:20141026053)25 mg/m2,静脉滴注,d1、d8;顺铂(商品名:铂龙;生产厂家:齐鲁制药有限公司;批号:20141007057)75 mg/m2,静脉滴注,d1、d2.21 d为1个化疗周期。试验组在对照组基础上行盐酸安罗替尼治疗。盐酸安罗替尼胶囊(商品名:福可维;生产厂家:正大天晴药业集团股份有限公司;批号:2014114509):口服,12 mg/次,1次/天,连续口服14 d后停用7 d,共42 d。若患者出现3~4级出血、蛋白尿及肝功能异常暂停盐酸安罗替尼,待不良反应降低至2级以下后,下调一个剂量后继续治疗。两组均行3个化疗周期治疗。
1.3 观察指标①治疗前后,观察两组氧饱和度(SpO2)、血氧饱和度(SaO2)及最大通气量(MVV)等肺功能指标;②T细胞水平;③血清血清细胞角蛋白19片段(Cyfra21-1)、癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(Pro-GRP)等肿瘤标志物水平;④肺空洞;毒性反应等指标;⑤中位无进展生存期(mPFS)、总生存期(OS)。肺功能指标以肺功能检测仪进行检测。抽取清晨空腹静脉血5 ml,离心后静置取上层血清置入冰箱备用,T细胞水平以流式细胞仪检测,Cyfra21-1、CEA、NSE、Pro-GRP以ELISA法检测。肺空洞行胸部平片检查,若肺野见空洞性病灶,则评价为肺空洞。毒性反应依据CTCAE V4.03[5]评价。⑥疗效评价标准[6]包括完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)等内容。客观缓解率(ORR)为CR率与PR率之和。
1.4 统计学方法采用SPSS 19.0统计软件分析数据。计量资料以均数±标准差表示,组间比较采用t检验;计数资料以n(%)表示,组间比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 两组肺功能指标比较治疗后,两组肺功能指标均较治疗前增加(P<0.05);且试验组各指标大于对照组,差异有统计学意义(P<0.05)。见表2。
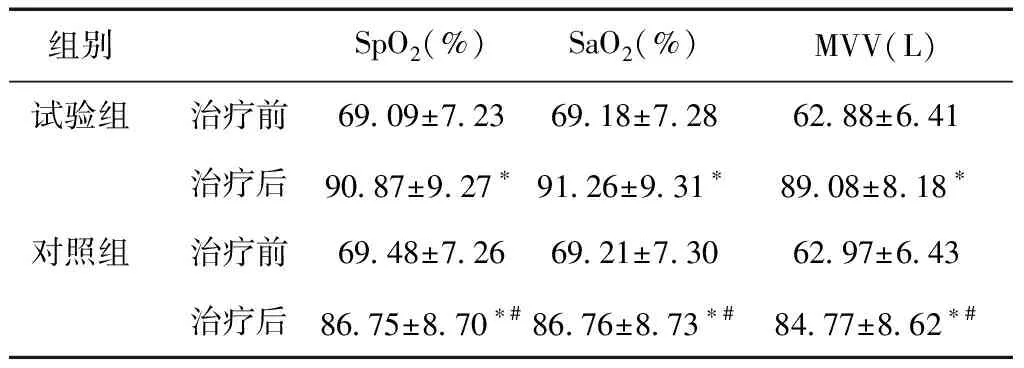
表2 两组肺功能指标比较
2.2 两组T细胞比较治疗后,除CD8+降低外,两组T细胞均治疗前升高(P<0.05);试验组除CD8+低于对照组,其他T细胞均高于对照组,差异有统计学意义(P<0.05)。表3。

表3 两组T细胞比较
2.3 两组肿瘤标志物比较治疗后,两组Cyfra21-1、CEA、NSE、Pro-GRP均较治疗前减小,且试验组小于对照组(P<0.05)。见表4。
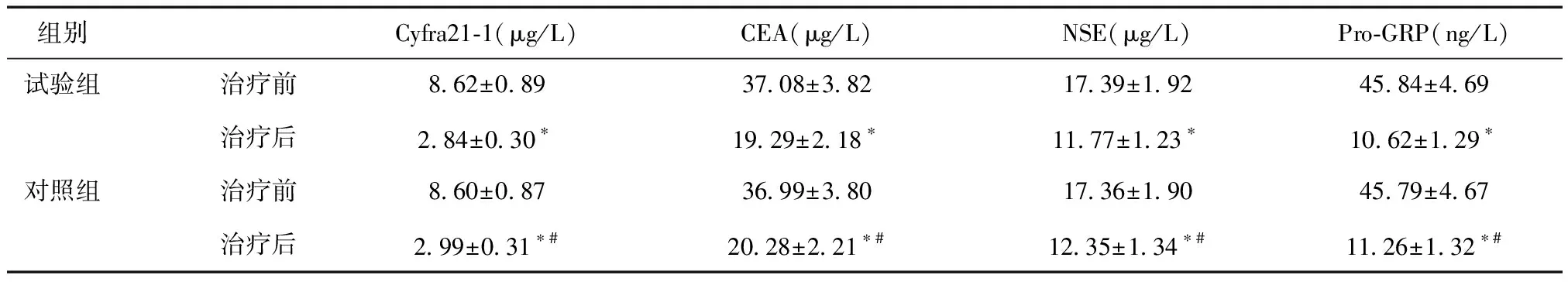
表4 两组肿瘤标志物比较
2.4 两组毒性反应及肺空洞比较两组毒性反应及肺空洞发生率比较,差异无统计学意义(P>0.05)。表5。

表5 两组毒性反应比较 [n(%)]
2.5 两组治疗结局比较试验组ORR、mPFS及OS高于对照组(P<0.05)。表6。
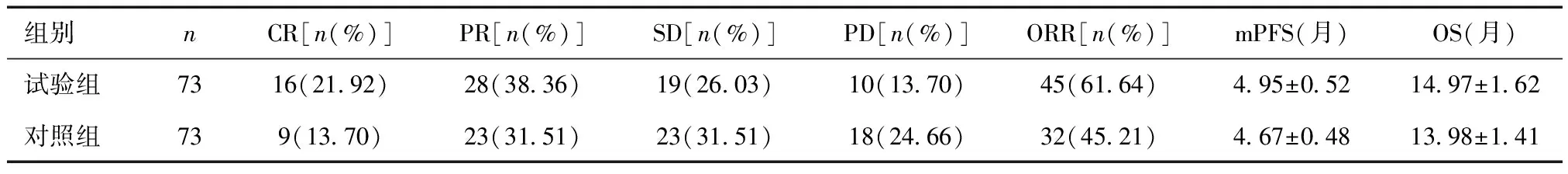
表6 两组治疗结局比较
3 讨论
降低肿瘤负荷,避免其远处转移是NSCLC治疗的关键[7]。作为标准化疗方案,NP方案三线化疗可使部分NSCLC患者获益。长春瑞滨可经多种路径对微管蛋白聚合进行干预,并在抑制形成微管的同时,加快其解聚进程,影响肿瘤细胞增殖,使其有丝分裂停滞于中期,并最终凋亡[8]。长春瑞滨可干预血管内皮细胞或促进其凋亡,诱导血管内源性抑制剂生成,降低血小板反应蛋白水平,抑制生成肿瘤新生血管,抑制病灶生长[9]。长春瑞滨可还可调节机体免疫,并经影响内皮祖细胞、缺氧诱导因子-1α等路径发挥抗癌活性[10]。联合使用长春瑞滨、顺铂,能够发挥二者共同优势,在优势互补的基础上,互相协调,提高抗肿瘤效应[11]。NP方案化疗细胞毒性较强,可诱发氧化应激,释放氧自由基,损伤正常细胞,抑制机体免疫功能,并出现多种毒性反应,且随着治疗时间延长,机体免疫功能抑制及毒性反应也逐渐加重[12]。
盐酸安罗替尼为酪氨酸激酶抑制剂,可多靶点作用于血小板源性生长因子受体(PDGFR)、血管内皮生长因子受体(VEGFR)等受体,影响其下游信号通道,抑制内皮细胞增殖,降低其迁移能力,干预管腔形成,抑制生成肿瘤血管,减少肿瘤血供[13]。盐酸安罗替尼可经c-Kit激酶影响肿瘤细胞多种生理进程,干预其正常生理活动,从而促进其凋亡。盐酸安罗替尼可特异性高表达于肿瘤细胞,不表达或极少表达于正常细胞,故其细胞毒性较低[14]。本研究治疗后,试验组肺功能、ORR、mPFS及OS均优于对照组,提示盐酸安罗替尼可降低肿瘤负荷,改善患者肺功能,提高疗效。
免疫功能紊乱是NSCLC发生发展的重要因素,肿瘤细胞可激发免疫逃逸机制,进攻免疫系统,诱导免疫功能紊乱[15]。T细胞是机体免疫的关键组成,其水平改变直接影响免疫功能。因任何一个T细胞均可在其细胞膜上对CD3+进行表达,故CD3+数目与T细胞数目互相对应,二者总数目相等。CD4+可经诱导细胞因子产生,趋化因子激活及募集靶细胞等路径调控细胞免疫[16]。CD8+可特异性识别内源性抗原肽,杀伤靶细胞,并可经参与抑制CD4+活性,调节细胞免疫[17]。通常CD4+/CD8+维持动态平衡,其水平降低预示机体免疫失常,无法有效对恶性肿瘤构成威胁,致使其迅速进展。本研究治疗后,试验组CD3+、CD4+、CD4+/CD8+、CD8+均较对照组显著改善,说明盐酸安罗替尼可杀灭NSCLC细胞,改善机体免疫。
肿瘤标志物是肿瘤诊断、疗效监测的重要指标。Cyfra21-1通常少量表达于气道鳞状上皮,该上皮癌变后,即可启动蛋白酶激活效应,使活性蛋白酶作用于细胞角蛋白,使其迅速降解,降解后其片段可快速入血,提高血清Cyfra21-1水平[18]。作为糖蛋白,CEA可诱导肿瘤细胞间互相黏附,促进其进展及转移[19]。NSE为酸性蛋白酶,通常高表达于神经内分泌、神经外胚层组织肿瘤[20]。Pro-GRP多表达于神经内分泌细胞,其癌变可促进GRP大量生成,诱导肿瘤进展[21]。本次研究中,经治疗,试验组各肿瘤标志物血清水平均较对照组低,说明盐酸安罗替尼可控制病情,抑制肿瘤标志物产生,使其血清水平显著降低。本研究两组各毒性反应发生率均无差异,提示盐酸安罗替尼毒性反应小。两组肺空洞发生率均无差异,说明与NP方案相比较,盐酸安罗替尼治疗NSCLC在促进肺空洞修复方面作用并不显著。
总之,盐酸安罗替尼可改善患者机体免疫,抑制肿瘤标志物生成,提高肺功能,疗效显著,且未显著增加毒副作用。

