左束支区域起搏与右心室低位间隔部起搏对永久性心脏起搏器植入术患者心功能影响的对比研究
黄於娟,孙立平,蒋芳勇,朱川萌
永久性心脏起搏器植入术是目前临床治疗缓慢型心律失常最常用的技术手段,右心室心尖因电极易固定、电极脱位发生率低而成为术中最常选择的心室电极植入部位[1]。有研究表明,长时间右心室起搏(RVP)患者的心室激动传导顺序与生理状态相反,心肌间以缝隙直接传导为主,可先后在左心室游离壁、基底部及心尖部出现矛盾运动及瘤样膨出,导致心房的初级泵血功能降低,进而造成心排血量(CO)下降[2]。有研究表明,左、右心室收缩不同步患者右房室瓣反流及心功能不全发生率较高[3]。右心室间隔部起搏患者心室激动是经室间隔传导,可使左、右心室达到同步激动、同步机械收缩,其左心室射血分数(LVEF)高于右心室心尖部起搏者[4-5]。目前关于右心室间隔的最佳起搏位置尚不确定,因此探寻更符合人体生理性起搏顺序的起搏方式成为近年学术界的热点话题。2017年HUANG等[6]首次提出了左束支区域起搏(LBBP),并指出LBBP理论上可直接激动左束支阻滞区域,其心脏激动顺序、心室同步性均更接近人体,可保护患者心功能[7]。近年越来越多的学者逐渐关注LBBP,且目前国内外关于LBBP远期疗效的研究及相关文献相对较少。因此,本研究旨在比较LBBP与右心室低位间隔部起搏对永久性心脏起搏器植入术患者心功能的影响,以为LBBP作为更理想的生理性起搏方式提供依据。
1 资料与方法
1.1 一般资料 选取2019年7月—2020年3月柳州市人民医院心血管内科收治的30例行永久性心脏起搏器植入术患者作为研究对象。纳入标准:(1)符合2018年美国心脏病协会(ACC)/美国心脏协会(AHA)/美国心律协会(HRS)发布的《心动过缓和心脏传导延迟患者的评估和管理指南》[8]中的永久性心脏起搏器植入术适应证;(2)Ⅱ~Ⅲ度房室传导阻滞、病态窦房结综合征、慢心室率心房颤动患者。排除标准:(1)严重凝血功能异常或血小板计数<50×109/L者;(2)需持续服用抗凝和/或抗血小板药物者;(3)纽约心脏病协会(NYHA)分级为Ⅲ~Ⅳ级且无法耐受手术者;(4)因脊柱畸形、创伤或其他原因导致无法平卧者。根据心脏起搏电极植入部位不同将所有患者分为对照组和观察组,各15例。对照组中男7例,女8例;年龄46~76岁,平均年龄(66.3±8.5)岁;平均LVEF(58.0±11.1)%;疾病类型:病态窦房结综合征5例,房室传导阻滞5例,心肌病3例,持续性心房颤动2例。观察组中男8例,女7例;年龄44~74岁,平均年龄(65.5±8.3)岁;平均LVEF(58.8±10.2)%;疾病类型:病态窦房结综合征6例,房室传导阻滞6例,心肌病2例,持续性心房颤动1例。两组患者性别(χ2=0.133)、年龄(t=0.261)、LVEF(t=0.206)、疾病类型(χ2=0.715)比较,差异无统计学意义(P>0.05)。本研究经柳州市人民医院伦理委员会审核批准,患者对本研究知情并签署知情同意书。
1.2 方法 患者术前均进行心脏彩色超声检查、N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)检测以评估心功能;而后行永久性心脏起搏器植入术,其中对照组患者于右心室低位间隔部起搏,即于患者锁骨下静脉进行穿刺,将主动螺旋电极置于右心室低位间隔部,其中电极头端垂直于心室间隔部,在后前位透视下将电极置于右房室瓣与心尖部之间、距离心影底部1.5~2.0个椎体,并向右前斜30°;使用“J”形钢丝调整右心室低位间隔部,使其与电极头端垂直,若起搏电极位于右心室低位间隔部,则患者心电图表现为QRS波,下壁导联呈QS形,Ⅰ导联呈R型,时限较宽,电轴偏左;待患者右心室有效起搏后,测试起搏参数以确保心室电极稳定,再退出引导钢丝,将心房电极导线植入右心耳,结束手术。观察组患者于LBBP,即于患者左腋下静脉进行穿刺,经C315鞘管送入心脏起搏电极导线,将心房电极置于右心室心尖部备用,植入心室3830电极并标测出希氏束电位,将电极头端向远端心尖方向移动1~2 cm,再将电极垂直旋入室间隔,至起搏时患者心电图表现为V1导联QRS波后半部分为R波,呈现窄的QRS波形,完成左束支区域电极植入后,测试起搏参数以确保心室电极稳定,再将心房电极置入右心耳,结束手术。
1.3 观察指标 (1)应用心脏多普勒彩色超声测量两组患者术前及术后1、6、12个月各心腔大小(包括右心房横径、右心房长径、右心室前后径、右心室横径、左心房前后径、左心房横径、左心房长径、左心室舒张末期前后径、左心室舒张末期横径)、瓣膜反流面积〔包括左、右房室瓣反流束的缩流颈(VC)〕、LVEF。(2)比较两组患者术前及术后1、6、12个月NT-proBNP水平:分别于术前及术后1、6、12个月取患者空腹外周静脉血,应用电化学发光免疫法检测血清NT-proBNP水平。(3)观察两组患者术后12个月内因心力衰竭再入院情况及死亡情况。
1.4 统计学方法 应用SPSS 17.0统计学软件进行数据处理。计量资料以(± s)表示,重复测量数据比较采用双因素重复测量方差分析,组间两两比较采用SNK-q检验,组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各心腔大小 方法与时间在右心房横径、右心房长径、右心室前后径、右心室横径、左心房前后径、左心房横径、左心房长径、左心室舒张末期前后径、左心室舒张末期横径上不存在交互作用(P>0.05)。方法在右心房横径、右心房长径、右心室前后径、右心室横径、左心房长径上主效应不显著(P>0.05);方法在左心房前后径、左心房横径、左心室舒张末期前后径、左心室舒张末期横径上主效应显著(P<0.05)。时间在右心房横径、右心房长径、右心室前后径、右心室横径、左心房横径、左心房长径、左心室舒张末期横径上主效应不显著(P>0.05);时间在左心房前后径、左心室舒张末期前后径上主效应显著(P<0.05)。观察组患者术后6、12个月左心室舒张末期前后径小于对照组,术后1、6、12个月左心室舒张末期横径大于对照组,差异有统计学意义(P<0.05)。对照组患者术后1、6、12个月左心房前后径、左心室舒张末期前后径分别大于术前,左心室舒张末期横径分别小于术前,差异有统计学意义(P<0.05),见表1。
表1 两组患者不同时间点各心腔大小比较(±s,mm)Table 1 Comparison of the size of each cardiac cavity between the two groups at different time points
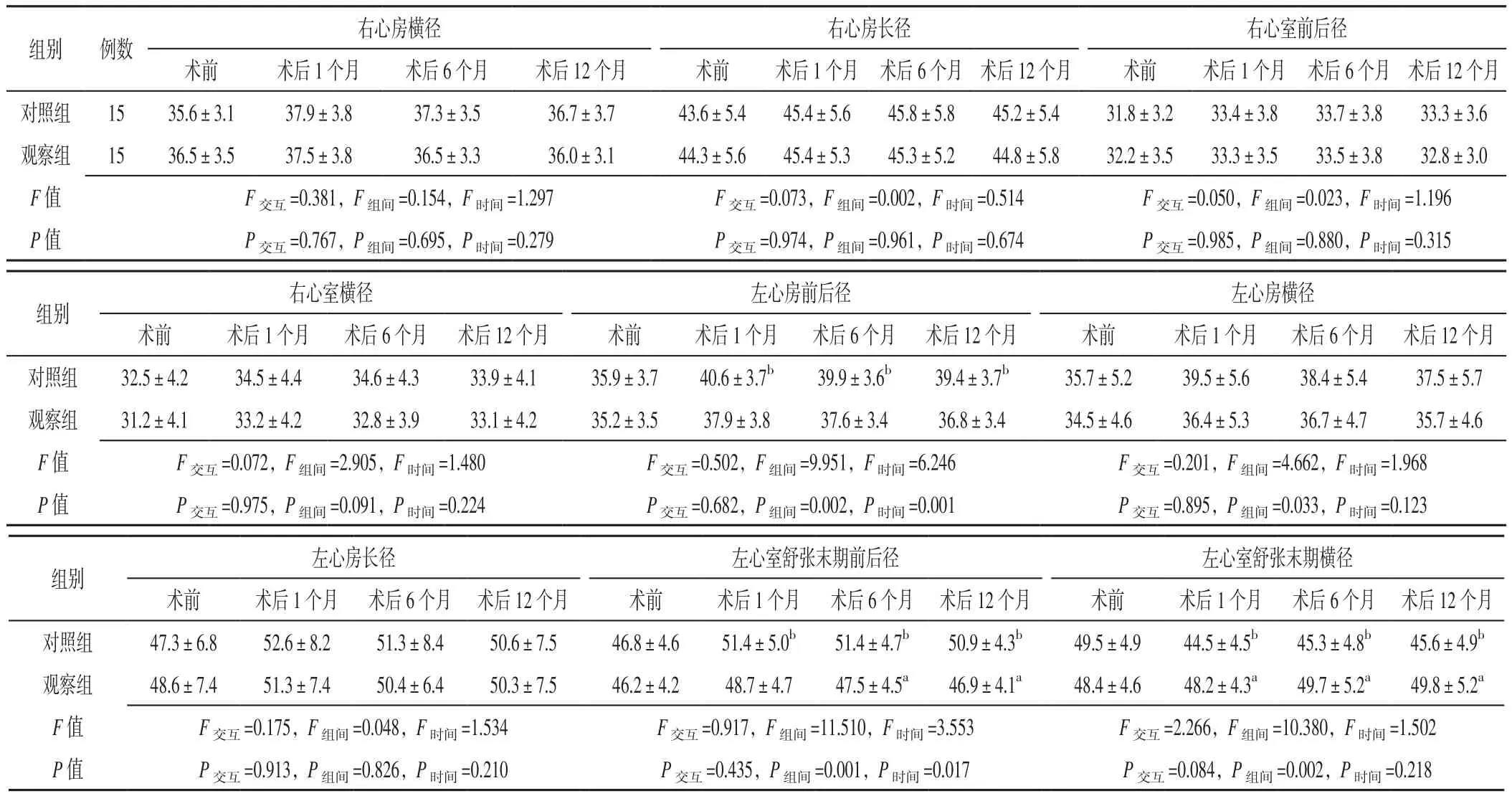
表1 两组患者不同时间点各心腔大小比较(±s,mm)Table 1 Comparison of the size of each cardiac cavity between the two groups at different time points
注:与对照组比较,aP<0.05;与本组术前比较,bP<0.05
组别 例数右心房横径右心房长径 右心室前后径术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月对照组 15 35.6±3.1 37.9±3.8 37.3±3.5 36.7±3.7 43.6±5.4 45.4±5.6 45.8±5.8 45.2±5.4 31.8±3.2 33.4±3.8 33.7±3.8 33.3±3.6观察组 15 36.5±3.5 37.5±3.8 36.5±3.3 36.0±3.1 44.3±5.6 45.4±5.3 45.3±5.2 44.8±5.8 32.2±3.5 33.3±3.5 33.5±3.8 32.8±3.0 F值 F交互=0.381,F组间=0.154,F时间=1.297 F交互=0.073,F组间=0.002,F时间=0.514 F交互=0.050,F组间=0.023,F时间=1.196 P值 P交互=0.767,P组间=0.695,P时间=0.279 P交互=0.974,P组间=0.961,P时间=0.674 P交互=0.985,P组间=0.880,P时间=0.315左心房横径术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月对照组 32.5±4.2 34.5±4.4 34.6±4.3 33.9±4.1 35.9±3.7 40.6±3.7b 39.9±3.6b 39.4±3.7b 35.7±5.2 39.5±5.6 38.4±5.4 37.5±5.7观察组 31.2±4.1 33.2±4.2 32.8±3.9 33.1±4.2 35.2±3.5 37.9±3.8 37.6±3.4 36.8±3.4 34.5±4.6 36.4±5.3 36.7±4.7 35.7±4.6 F值 F交互=0.072,F组间=2.905,F时间=1.480 F交互=0.502,F组间=9.951,F时间=6.246 F交互=0.201,F组间=4.662,F时间=1.968 P值 P交互=0.975,P组间=0.091,P时间=0.224 P交互=0.682,P组间=0.002,P时间=0.001 P交互=0.895,P组间=0.033,P时间=0.123右心室横径 左心房前后径组别组别左心房长径 左心室舒张末期前后径 左心室舒张末期横径术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月 术前 术后1个月 术后6个月 术后12个月对照组 47.3±6.8 52.6±8.2 51.3±8.4 50.6±7.5 46.8±4.6 51.4±5.0b 51.4±4.7b 50.9±4.3b 49.5±4.9 44.5±4.5b 45.3±4.8b 45.6±4.9b观察组 48.6±7.4 51.3±7.4 50.4±6.4 50.3±7.5 46.2±4.2 48.7±4.7 47.5±4.5a 46.9±4.1a 48.4±4.6 48.2±4.3a 49.7±5.2a 49.8±5.2a F值 F交互=0.175,F组间=0.048,F时间=1.534 F交互=0.917,F组间=11.510,F时间=3.553 F交互=2.266,F组间=10.380,F时间=1.502 P值 P交互=0.913,P组间=0.826,P时间=0.210 P交互=0.435,P组间=0.001,P时间=0.017 P交互=0.084,P组间=0.002,P时间=0.218
2.2 瓣膜反流面积 方法与时间在左、右房室瓣反流束的VC上不存在交互作用(P>0.05);方法、时间在左、右房室瓣反流束的VC上主效应均显著(P<0.05)。观察组患者术后1个月左房室瓣反流束的VC及术后1、6、12个月右房室瓣反流束的VC小于对照组,差异有统计学意义(P<0.05)。对照组患者术后1、6、12个月左、右房室瓣反流束的VC分别大于本组术前,差异有统计学意义(P<0.05),见表 2~3。
表2 两组患者不同时间点左房室瓣反流束的VC比较(±s,mm)Table 2 Comparison of VC of left atrioventricular regurgitation bundle between the two groups at different time points
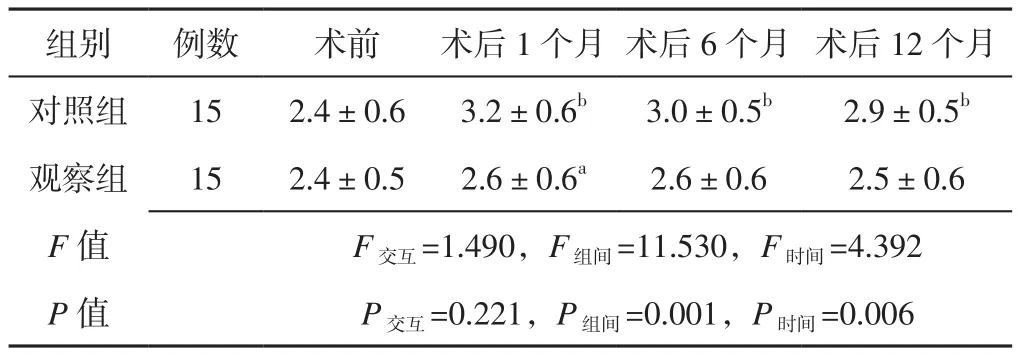
表2 两组患者不同时间点左房室瓣反流束的VC比较(±s,mm)Table 2 Comparison of VC of left atrioventricular regurgitation bundle between the two groups at different time points
注:与对照组比较,aP<0.05;与本组术前比较,bP<0.05
组别 例数 术前 术后1个月 术后6个月 术后12个月对照组 15 2.4±0.6 3.2±0.6b 3.0±0.5b 2.9±0.5b观察组 15 2.4±0.5 2.6±0.6a 2.6±0.6 2.5±0.6 F值 F交互=1.490,F组间=11.530,F时间=4.392 P值 P交互=0.221,P组间=0.001,P时间=0.006
表3 两组患者不同时间点右房室瓣反流束的VC比较(±s,mm)Table 3 Comparison of VC of right atrioventricular regurgitation bundle between the two groups at different time points
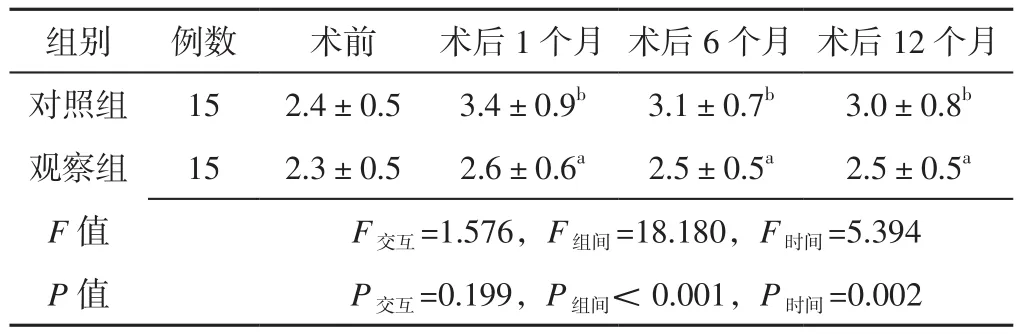
表3 两组患者不同时间点右房室瓣反流束的VC比较(±s,mm)Table 3 Comparison of VC of right atrioventricular regurgitation bundle between the two groups at different time points
注:对照组比较,aP<0.05;与本组术前比较,bP<0.05
组别 例数 术前 术后1个月 术后6个月 术后12个月对照组 15 2.4±0.5 3.4±0.9b 3.1±0.7b 3.0±0.8b观察组 15 2.3±0.5 2.6±0.6a 2.5±0.5a 2.5±0.5a F值 F交互=1.576,F组间=18.180,F时间=5.394 P值 P交互=0.199,P组间<0.001,P时间=0.002
2.3 LVEF 方法与时间在LVEF上不存在交互作用(P>0.05);方法、时间在LVEF上的主效应均显著(P<0.05)。观察组患者术后1、6、12个月LVEF高于对照组,差异有统计学意义(P<0.05)。对照组患者术后1、6、12个月LVEF分别低于本组术前,差异有统计学意义(P<0.05),见表4。
表4 两组患者不同时间点LVEF比较(±s,%)Table 4 Comparison of LVEF between the two groups at different time points

表4 两组患者不同时间点LVEF比较(±s,%)Table 4 Comparison of LVEF between the two groups at different time points
注:与对照组比较,aP<0.05;与本组术前比较,bP<0.05
组别 例数 术前 术后1个月 术后6个月 术后1 2个月对照组 1 5 5 7.4±3.0 5 2.6±3.7 b 5 4.8±3.2 b 5 5.1±3.0 b观察组 1 5 5 7.6±3.2 5 5.4±3.7 a 5 7.6±3.3 a 5 8.8±4.6 a F 值 F交互=1.3 9 9,F组间=1 3.8 3 0,F时间=5.7 9 1 P 值 P交互=0.2 4 7,P组间<0.0 0 1,P时间=0.0 0 1
2.4 NT-proBNP水平 方法与时间在NT-proBNP水平上存在交互作用(P<0.05);方法、时间在NT-proBNP水平上的主效应均显著(P<0.05)。观察组患者术后6、12个月NT-proBNP水平低于对照组,差异有统计学意义(P<0.05)。对照组患者术后6、12个月及观察组患者术后1、6、12个月NT-proBNP水平分别低于本组术前,差异有统计学意义(P<0.05),见表5。
表5 两组患者不同时间点NT-proBNP水平比较(±s,ng/L)Table 5 Comparison of NT-proBNP level between the two groups at different time points
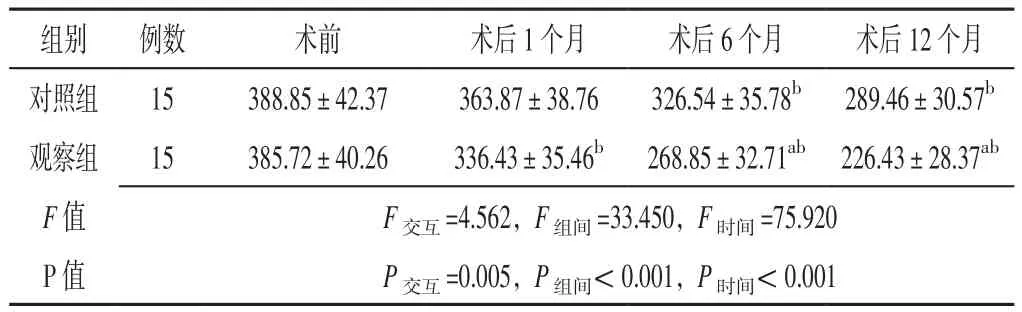
表5 两组患者不同时间点NT-proBNP水平比较(±s,ng/L)Table 5 Comparison of NT-proBNP level between the two groups at different time points
注:与对照组比较,aP<0.05;与本组术前比较,bP<0.05
组别 例数 术前 术后1个月 术后6个月 术后12个月对照组 15 388.85±42.37 363.87±38.76 326.54±35.78b 289.46±30.57b观察组 15 385.72±40.26 336.43±35.46b 268.85±32.71ab 226.43±28.37ab F值 F交互=4.562,F组间=33.450,F时间=75.920 P值 P交互=0.005,P组间<0.001,P时间<0.001
2.5 安全性 随访1年,对照组患者因心力衰竭再入院7例,死亡1例,不良预后发生率为53.3%(8/15);观察组患者因心力衰竭再入院2例,不良预后发生率为13.3%(2/15)。观察组患者不良预后发生率低于对照组,差异有统计学意义(χ2=5.400,P=0.025)。
3 讨论
永久性心脏起搏器植入术是目前临床治疗缓慢型心律失常最常应用的技术手段。右心室间隔部或右心室流出道起搏是经室间隔传导激动,可使左、右心室达到同步激动、同步机械收缩,两种起搏方式均可获得较好的近、远期效果[9-10]。但目前仍无法确定何种起搏位置是永久性心脏起搏器最佳植入部位[11]。因此,寻找更符合生理性起搏顺序的起搏方式成为学术界的热门话题。已有研究证实,双心室起搏可改善左心室功能减退伴左束支传导阻滞(LBBB)患者左、右心室的同步性[12],但双心室起搏仍非理想的生理性起搏方式,且其心房颤动发生率高[13]。因此,双心室起搏对非LBBB的心力衰竭患者疗效有限。以希氏束起搏(HBP)为代表的生理性顺序起搏近年开始应用于临床。司晓云等[14]证实了左心室HBP的可行性及安全性,并提出其可作为生理性起搏方式。但术中进行HBP具有一定难度,且10%~20%的患者无法标测希氏束并完成电极植入[15]。另有研究表明,HBP阈值较高,增加电池消耗,导致电池寿命缩短[16-17]。此外,HBP电极位于房室交界处,可导致心房过感知、心室感知偏低及心房夺获等情况发生[18]。HBP不适用于部分非近端阻滞患者,常需要将备用电极植入右心室[19]。2017年HUANG等[6]首次提出了LBBP的概念,指出其是将3830电极拧入左心室间隔至左侧心内膜下左束支区域,可纠正左束支传导阻滞,使QRS波变窄,减少心脏收缩不同步,进而改善患者症状。与普通右心室心尖部或右心室间隔部起搏相比,LBBP能够减少对心功能的影响,其弥补了HBP的不足,并且将HBP的临床适用范围扩大,可降低电极脱位、心律失常发生率,且操作简单,起搏参数好,可重复性高,手术成功率接近100%,极有可能替代RVP成为主流的心脏起搏电极的最佳植入位点[20]。但由于临床对LBBP的操作经验少,可能会造成室间隔穿孔而引起血流动力学改变等问题,LBBP仍面临一定的潜在风险,其安全性、有效性仍需更多的前瞻性研究证实。
本研究结果显示,观察组患者术后6、12个月左心室舒张末期前后径小于对照组,术后1、6、12个月左心室舒张末期横径大于对照组;观察组患者术后1个月左房室瓣反流束的VC及术后1、6、12个月右房室瓣反流束的VC小于对照组;观察组患者术后1、6、12个月LVEF高于对照组;观察组患者术后6、12个月NT-proBNP水平低于对照组;且观察组患者不良预后发生率低于对照组,表明针对永久性心脏起搏器植入术患者,LBBP较右心室低位间隔部起搏对患者各心腔大小、瓣膜反流面积、LVEF的影响更小,且LBBP可较好地降低NT-proBNP水平及不良预后发生率,进一步提示LBBP对永久性心脏起搏器植入术患者心功能的影响较小,且具有较好的安全性,与董士铭等[21]研究结果相似。分析原因可能为:(1)LBBP可跨越阻滞部位,尤其是在LBBB、HBP以下阻滞的房室传导阻滞(AVB),因此LBBP夺获阈值低且稳定,避免了房侧希氏束导线出现交叉感知的情况;(2)对于需要进行房室结消融的患者,LBBP可提供足够的消融靶点空间,保障消融安全性;(3)LBBP电极固定在病变下方,不易受传导束病变随时间向室侧发展的影响;(4)LBBP的起搏部位更靠近室间隔,局部存在较多心肌细胞,可夺获周边心肌细胞,作为自身心室起搏的备份,故更加安全。此外,目前LBBP植入的心室电极多为3830电极,该电极仅4.1 Fr,更加柔软,不易断裂,且术后右房室瓣反流的程度及血栓形成风险较普通导线低[22]。故3830电极植入对于重度右房室瓣反流或原有心功能较差的心室起搏依赖患者具有一定优势。有研究表明,3830主动固定电极在永久性心脏起搏器植入术中具有一定的安全性及可行性[23]。赵辉等[24]发现,与普通电极相比,3830电极可能会延长起搏器的预期寿命。张新才等[25]研究表明,采用3830电极行右心室间隔部起搏较传统翼状电极右心室心尖部起搏时的QRS波群时限更短,安全、有效,且对患者心功能的影响更小,更加符合生理性传导模式。因此,LBBP可能是此类患者更好的选择。
综上所述,与右心室低位间隔部起搏相比,LBBP对永久性心脏起搏器植入术患者心功能的影响更小,且预后更好,因此LBBP可作为更为理想的生理性起搏方式。由于本研究为单中心研究,纳入样本量较小,且未考虑可能影响结果的手术因素,因此结论可能存在一定偏倚,仍需进行多中心的大样本量研究进一步证实结论。
作者贡献:黄於娟、蒋芳勇进行文章的构思与设计及论文的修订,并对文章整体负责、监督管理;黄於娟、孙立平进行研究的实施与可行性分析;孙立平、朱川萌进行数据收集、整理、分析;黄於娟、朱川萌进行结果分析与解释;黄於娟撰写论文,负责文章的质量控制及审校。
本文无利益冲突。

