异质金属调控下医用镁的氢气释放对 肿瘤细胞的影响
姜浩淼,昝睿,彭宏州,孙钰,张小农,锁涛,王坚
(1.上海交通大学 材料科学与工程学院 金属基复合材料国家重点实验室,上海 200240; 2. 复旦大学附属中山医院,上海 200032; 3.上海交通大学附属第六人民医院 肝胆胰外科,上海 200233)
癌症已经成为一个世界性的重大公共卫生问题,近年来,由于检测手段的成熟,甲状腺癌的检测发病率在全球范围内持续上升。这已经成为女性中第六常见的癌症,所有人类中第十常见的癌症,在过去一年中,新增超过52 000 例新病例[1]。在临床上,甲状腺癌有多种表现形式,包括较低概率产生恶行病变的甲状腺结节,转移能力较差的甲状腺乳头状癌,能够通过血行转移到肺和骨头的低分化甲状腺癌,生长极为快速的未分化甲状腺癌。因此,目前治疗甲状腺癌患者的最大挑战是:找到治疗良性甲状腺肿瘤患者的轻度方案和治疗晚期或高危甲状腺癌症患者的重度方案之间的平衡[2]。但是,目前对甲状腺癌的治疗方法通常为直接切除。为了改善这种相对“一刀切”的治疗方案,研发能够产生不同程度抑制肿瘤的药物或植入器械的方法就显得尤为必要。
近年来,由于镁优秀的生物相容性[3-6]、力学相容性[7]和生物可降解性[8-10],使其在生物医用可降解材料的研究中成为热点。镁器械开始逐渐通过批准,能够在市面上销售使用[11-12]。许多研究表明,镁的降解产物能够干扰多种肿瘤细胞系的生长。Zhang 等[13]和Chen 等[14]的体外研究表明,镁的腐蚀产物对骨肉瘤U2-OS 细胞系和MG-63 细胞系都有抑制增殖的作用。Qiao 等[15]研究了高纯镁丝的各种降解产物在一种卵巢癌SKOV3 细胞系体内和体外的生物学效应。体内成像结果表明,镁丝植入荷瘤小鼠体内,可显著减少肿瘤体积,并且小鼠体重维持正常。这种抗肿瘤效应与镁金属降解产生的氢气关系密切。早在1975年,高压的氢气气体就首次成功用于治疗癌症[16]。2007 年,Ohasawa 等[17]发现氢气能够在不显著影响细胞正常生命活动的前提下,选择性还原羟基自由基(—OH),这是活性氧(ROS)中攻击性较强且对人体危害较大的一种。于是通过调控镁的降解速度,使氢气释放速度不同,产生不同程度的抗肿瘤效果,就成为一个可行的思路。
由于镁金属材料电位较负,与其他金属材料接触时,在腐蚀电位差的驱动下,加速了腐蚀速率,即产生电偶腐蚀的现象。当电极电位有一定差距的两种金属材料在电解质溶液环境中相互接触,形成能够导电通路时,两种材料中自腐蚀电位较负的一方成为阳极,腐蚀显著加剧。而电位较正的一方成为阴极,其电位越高,腐蚀越轻微[18-19]。因此,文将高纯镁与三种不同的金属(镁合金AZ91、纯钛TA2 和不锈钢316L)直接连接,本研究这些异质金属对高纯镁析氢的影响及产生的抗肿瘤效应。
1 试验
以轧制态高纯镁板(纯度为99.98%,具体成分见表1)为原材料,线切割加工成12 mm×10 mm× 0.2 mm 的片状试样。将镁合金AZ91、纯钛TA2 和不锈钢316L 三种金属板材用线切割加工成10 mm× 10 mm×1 mm 的片状试样。将所有试样用800 目砂纸打磨,用无水乙醇超声清洗,干燥。将高纯镁试样与三种不同金属片分别用导线相连,形成电偶对后,一并冷镶处理,分别为Mg&AZ91、Mg&TA2 和Mg& 316L 组。固定两种金属之间的距离,并保证两种金属暴露在溶液中的面积一致。高纯镁片单独进行冷镶,作为Mg 组。冷镶液的各种化学成分比例如表2所示。室温下,约12 h 后,冷镶液完全固化,用800目砂纸再次将表面打磨干净,用无水乙醇超声清洗并干燥后,进行下一步的电化学测试和浸泡试验。

表1 高纯镁板化学成分 Tab.1 Chemical compositions of high-purity magnesium plates wt %

表2 冷镶嵌溶液(25 g)中的化学成分 Tab.2 Chemical compositions in cold mounting and embedding solution of 25 g
电化学测试和浸泡试验均采用PBS 缓冲溶液,具体配方为:氯化钠(NaCl)8.0063 g/L,氯化钾(KCl)0.2013 g/L,磷酸氢二钠(Na2HPO4)1.4196 g/L,磷酸二氢钾(KH2PO4)0.2722 g/L。
电化学测试过程为:将各组试样在37 ℃水浴的100 mL PBS 缓冲溶液中分别浸泡20 min 与12 h,取出后,再放入新鲜的PBS 缓冲溶液中。将Mg 试样作为工作电极,饱和Hg/HgCl 作为参比电极,Pt 作为对电极,构成三电极体系。利用电化学工作站(CHI660E,辰华),首先测量了开路电位(OCP),测量时间为300 s。然后对动电位极化曲线进行测量,扫描区间为–200~+800 mV(vs. OCP),扫描速度为0.5 mV/s。利用Tafel 外推法,在阴极极化区获得腐蚀电位Ec和腐蚀电流密度的对数lgJc。
浸泡试验过程中,将各组试样在同样的条件下浸泡48 h。通过排水法测量48 h 内氢气的释放量,利用水素计(ENH-1000,TRUSTLEX)测定48 h 内溶液中氢气浓度的变化情况。在每一个样品对应的溶液中,都人为设定了三个测量点,以比较全面地反映溶液中的溶氢量,分别在高纯镁样品表面上方2 mm 处,阴极金属片样品表面上方2 mm 处和溶液50 mm 深处。
异质金属作用下的高纯镁电化学腐蚀和氢气释放特性表征结束后,在37 ℃、5%CO2环境下,将1 mL 1×105个/孔浓度的人甲状腺肿瘤Cal-62 细胞悬液培养在六孔板细胞嵌入皿(PET Transwell Insert,JET Biofil)中。过夜贴壁后,进行换液处理,在下室中放入冷镶好的各组高纯镁及高纯镁连接金属片的电偶对样品,并加入5 mL PBS 缓冲溶液,将氢气单独作用于Cal-62 肿瘤细胞。为保证氢气持续释放,对下室PBS 溶液进行换液处理,每8 h 一次。待氢气作用后,分别进行细胞增殖、细胞凋亡和细胞周期试验。
在细胞增殖试验中,氢气作用24、48、72 h 后,在避光条件下,利用CCK-8 试剂(Dojindo),通过酶标仪(ELX-800,BioTek)测试每个细胞嵌入皿溶液在450 nm 波长处的吸光度(OD 值)。OD 值与该皿中的细胞数量成正比。
在细胞凋亡试验中,氢气作用48 h 后,用–4 ℃预冷的PBS 溶液洗涤细胞,将细胞用不含EDTA 的胰蛋白酶(TRYPSIN 0.25%, Corning Cellgro)消化后,利用FITC/Annexin V 和PI(Sony Biotechnology)进行双染,常温避光孵育后,通过流式细胞仪(CytoFLEX S, Beckman)分析细胞凋亡状况。
在细胞周期试验中,氢气作用48 h 后,用–4 ℃预冷的PBS 溶液洗涤细胞,将细胞消化后,用–20 ℃预冷的70%乙醇固定过夜。测试前,再次用预冷的PBS 溶液洗涤,重悬细胞。在室温、避光环境下,用PI/RNase 综合染剂(BD Pharmingen)进行单染,避光孵育后,通过流式细胞仪分析细胞周期。
2 结果与讨论
2.1 异质金属作用下高纯镁的电化学腐蚀特征
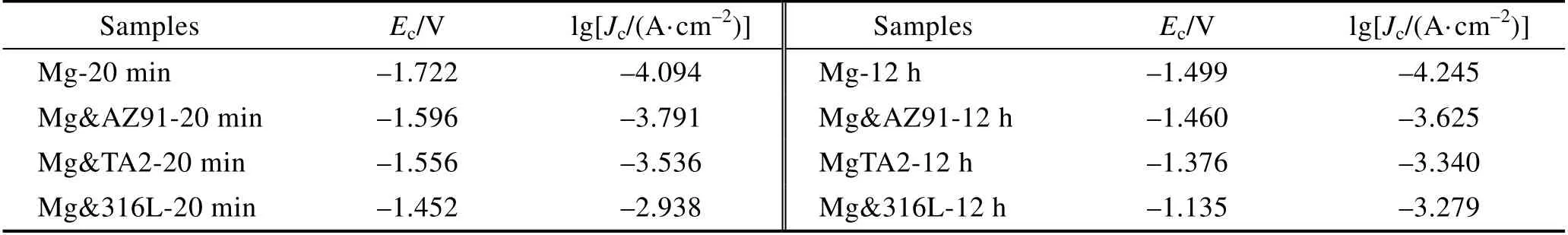
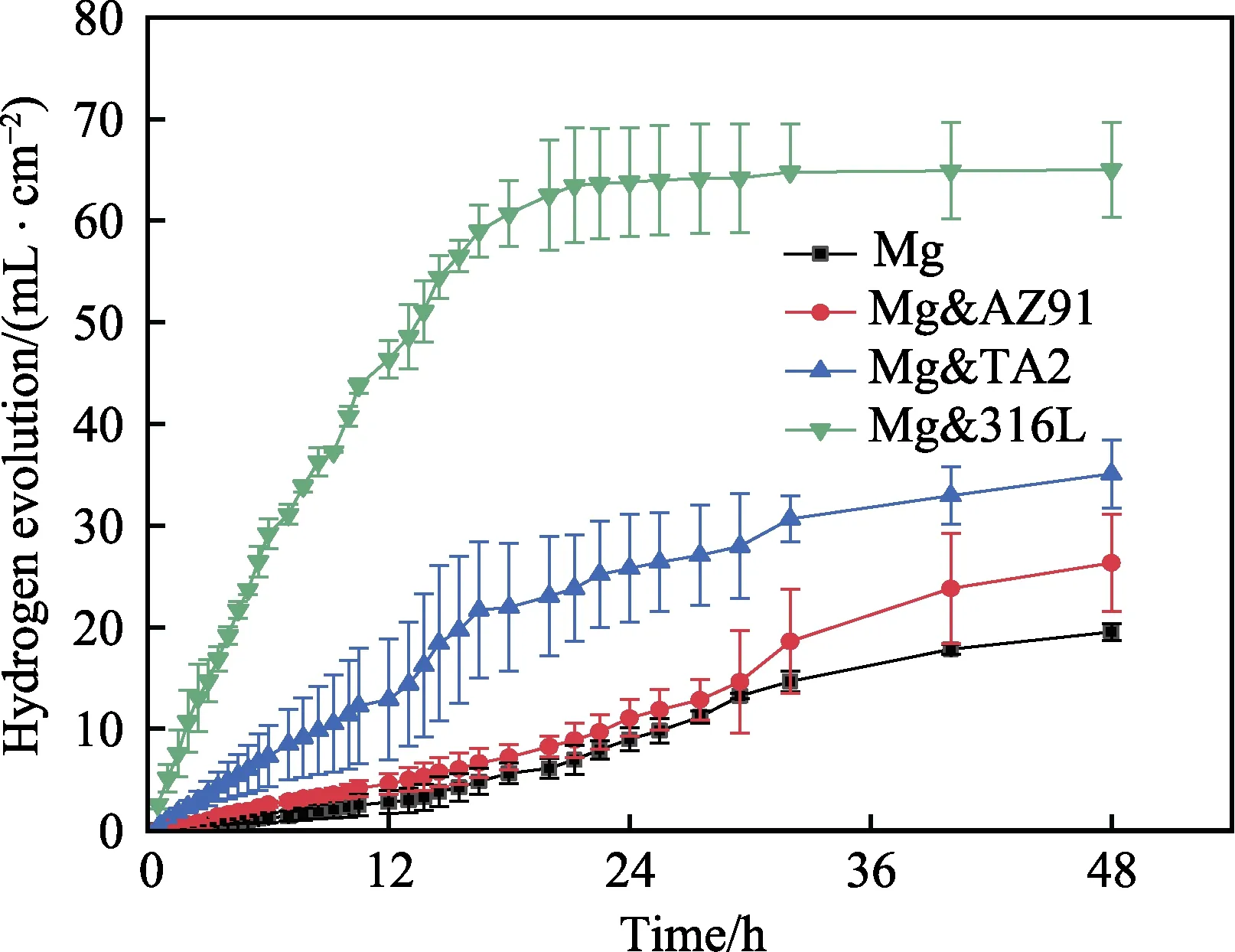
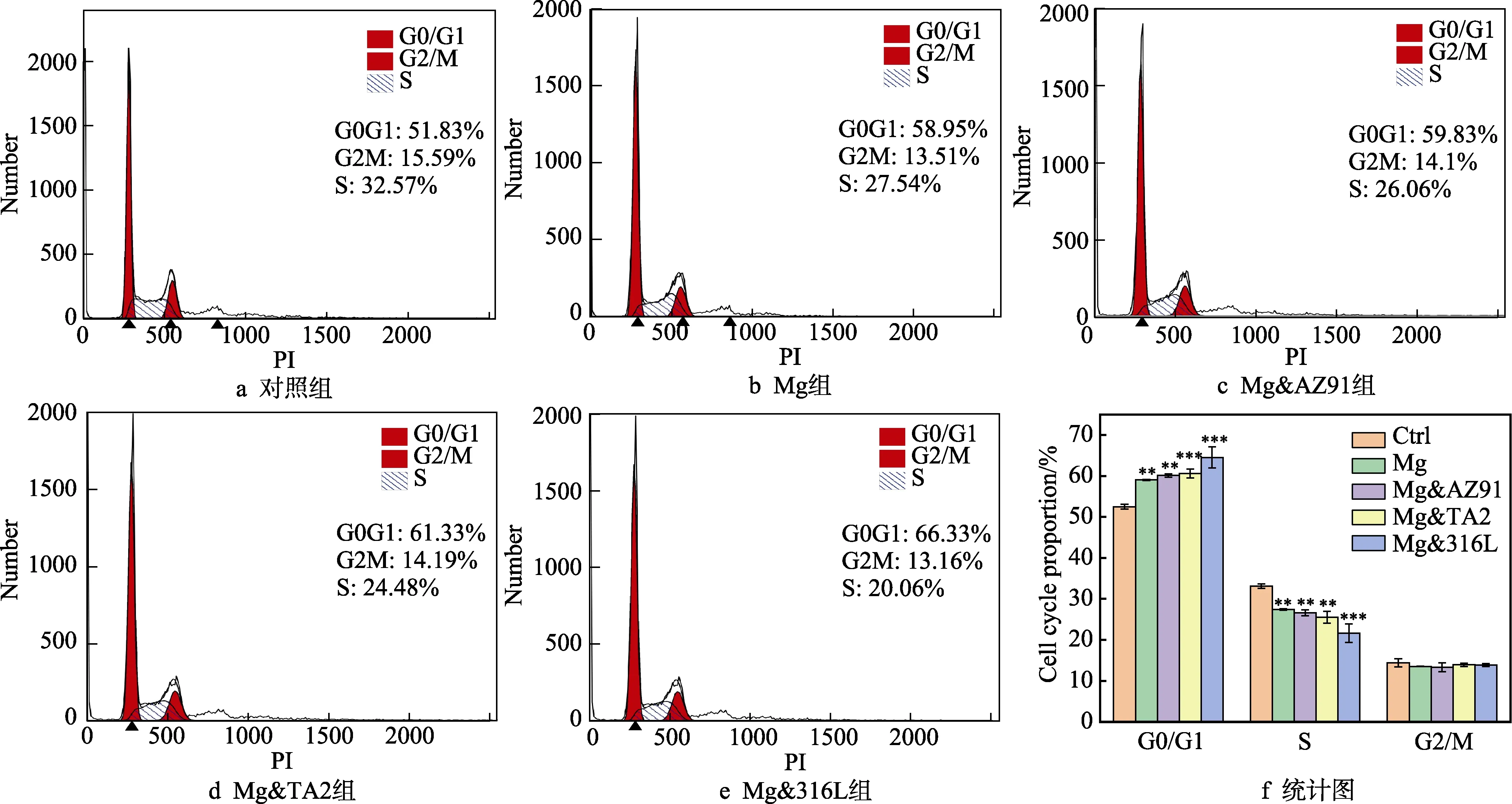
各组Mg 试样在PBS 溶液中浸泡20 min 和12 h后的OCP 曲线如图1 所示。可以发现,Mg 试样连接异质金属片后的OCP 发生了不同程度的提升,从20 min 到12 h,这种提升显著增大,且保持着Mg< Mg&AZ91 各组Mg 试样在PBS 溶液中浸泡20 min 和12 h后的极化曲线如图 2 所示。将扫描区间起点定为–200 mV(vs. OCP),主要是因为在强阴极极化条件下,很有可能生成氢化镁产物[20]。在这种状况下,不仅电流测量值会有额外增量,氢化镁的生成也会导致镁金属表面状态的变化,使测量值不够准确。 极化曲线上,lgJ 最小的点对应的纵坐标为Ec值。在阴极极化区曲线上纵坐标为–100 mV(vs. OCP)处作切线,获得阴极区的塔菲尔曲线。该切线上纵坐标为Ec值的点所对应的横坐标,表示该试样的腐蚀电流密度lgJc。通常情况下,塔菲尔外推法的过程为:在表观极化曲线上确定强阴极极化区和强阳极极化区,这两条曲线近似为直线,通过拟合这两条直线,交点代表阴阳极的电流密度绝对值相等,外测电流为零,其对应的纵坐标和横坐标分别为腐蚀电位和腐蚀电流密度。但是对于镁这种金属而言,当镁在阳极极化时,负差数效应会引起异常的析氢,影响测定真实阳极电流密度[21]。因此在本研究中,我们只用阴极极化相对较弱的区域拟合塔菲尔曲线。 各组Mg 试样在PBS 溶液中浸泡20 min 和12 h后的Ec和lgJc统计在表3 中。腐蚀电流密度的增大程度与腐蚀电位在极化作用下的增大程度一致,为Mg 图1 Mg 试样的OCP 曲线 Fig.1 OCP curves of Mg samples: a) soak for 20 min; b) soak for 12 h 图2 Mg 试样的极化曲线 Fig.2 Polarization curves of Mg samples: a) soak for 20 min; b) soak for 12 h 表3 Ec 和lgJc 的数值统计 Tab.3 Statistics of Ec and lgJc 图3 为各组试样在PBS 缓冲溶液中浸泡48 h 的氢气释放量随时间的变化趋势。Mg 在PBS 溶液中浸泡48 h 后,释放的氢气总量为23.44 mL,Mg&AZ91为31.61 mL,Mg&TA2 为42.13 mL,Mg&316L 为77.99 mL。由此可见,在48 h 内,四组试样的氢气释放量与电化学腐蚀试验中的腐蚀速率变化规律一致。在PBS 溶液中浸泡48 h 的过程中,Mg&316L 在24 h左右,氢气释放就开始大幅减少,从宏观腐蚀形貌 (图4)可以看出,这可能是由于腐蚀速率过快;在腐蚀后期,Mg&316L 中的镁片已经基本腐蚀完全。 图3 浸泡48 h 内的析氢曲线 Fig.3 Hydrogen evolution curves during 48 h immersion 各组试样在PBS 缓冲溶液中浸泡48 h 后,引起溶液中的氢气溶解浓度随时间的变化曲线如图5 所示。可以发现,三个测量位置的溶氢量差距较大。异质金属片表面的溶氢量显著大于其他两个位置,主要是因为在电偶电流的极化作用下,很大程度地促进了异质金属片表面的阴极析氢反应。相对而言,溶液中50 mm 深度处的氢气溶解浓度更能代表溶液中平均的氢气溶解量。腐蚀较快的试验组的氢气溶解曲线完全处于腐蚀较慢的试验组上方,且Mg&316L 的峰值为1.315 mg/L,Mg&TA2 的峰值为 0.981 mg/L,Mg&AZ91 的峰值为0.496 mg/L,Mg 的峰值为0.133 mg/L。基本能够说明,在48 h 过程中,不同试验组溶液中的氢气溶解量存在比较显著的差距,且与异质金属作用下的腐蚀速率变化规律保持一致。 图4 浸泡48 h 后各组试样宏观腐蚀形貌 Fig. 4 Macroscopic corrosion morphology of each group of samples after immersion for 48 h: a) carrying corrosion products; b) washing away corrosion products 图5 浸泡48 h 内PBS 溶液中的氢气溶解浓度 Fig.5 Hydrogen dissolution in PBS solution during 48 h immersion: a) above the surface of dissimilar metals; b) above the surface of Mg; c) 50 mm deep in the solution 图6 为不同氢气释放量对甲状腺肿瘤Cal-62 细胞增殖的试验结果。从图中看出,氢气处理肿瘤细胞24、48、72 h 时,有氢气释放的试验组相比于对照组基本上都具有统计学差异(其中*代表p<0.05,**代表p<0.01,***代表p<0.005,****代表p<0.001)。而且,随着氢气释放量及氢气溶解浓度的升高,这种抑制作用有着增强的趋势。关于氢气抗肿瘤的机制研究目前也已经展开,其核心在于氢气与ROS 的相互作用。由于人肿瘤产生ROS 的速度比正常细胞系快[22],且ROS 能够通过多种渠道促进肿瘤微环境中血管的生长,从而加快肿瘤细胞增殖和长大[23]。而氢气能通过清除ROS,干扰肿瘤细胞呼吸和新陈代谢,保护DNA、RNA 和蛋白质免受过量ROS 氧化,造成损伤,并且还可以抑制肿瘤侵袭和肿瘤血管生成[16,24]。培养48 h 后,需要对肿瘤细胞进行换液处理,导致48 h内溶解在嵌入皿中的氢气大量损失,使48 h 和72 h的氢气抑制作用差异不大,远不及在24 h 和48 h 之间的差异明显,因此在凋亡试验和周期试验中,只进行了48 h 的氢气释放。 图6 氢气对Cal-62 肿瘤细胞增殖的影响 Fig.6 Effect of hydrogen on the proliferation of Cal-62 tumor cells: a) treat for 24 h; b) treat for 48 h; c) treat for 72 h 图7 氢气处理48 h 对Cal-62 肿瘤细胞凋亡的影响 Fig.7 Effect of hydrogen on the apoptosis of Cal-62 tumor cells after treating for 48 h: a) control group; b) Mg group; c) Mg&AZ91 group; d) Mg&TA2 group; e) Mg&316L group; f) statistical chart 图7 为不同氢气释放量对Cal-62 甲状腺肿瘤细胞凋亡影响的试验结果。由于本研究采用了AnnexinV- FITC/PI 双染法,在细胞凋亡的统计图中,双阳区(Q2)代表晚期凋亡,FITC 单阳区(Q3)代表早期凋亡, Q2+Q3 之和为统计的细胞凋亡率。从统计结果可以看出,除Mg 组之外,其余有氢气作用的组的肿瘤细胞凋亡率均与对照组存在显著差异,氢气作用明显促进了细胞凋亡,且随着氢气释放量增加,凋亡率有上升趋势。对照组凋亡率为5.87%,Mg 组为5.49%,Mg&AZ91 组为10.63%,Mg&TA2 组为24.47%,Mg&316L 组为51.37%。事实上,有研究显示,氢气在体内和体外试验时,激活了结肠癌细胞中一系列的细胞凋亡通路(磷酸化单磷酸腺苷活化蛋白激酶(p-AMPK)、凋亡诱导因子(AIF)和胱天蛋白酶3型(Caspase3)等),促进了肿瘤细胞凋亡[25]。 图8 为不同氢气释放量试验组对Cal-62 甲状腺肿瘤细胞周期影响的试验结果。细胞周期分为DNA合成前期(G0/G1)、DNA 合成期(S)和DNA 合成后期与分裂期(G2/M),各个时期细胞中的DNA 含量具有对应的特征。结果显示,在氢气作用后,Cal-62细胞的G2/M 期无显著变化,但G0/G1 期大幅延长,S 期显著缩短,即Cal-62 肿瘤细胞被阻滞在G0/G1期,细胞增殖的过程也受到影响。同时,随着氢气释放量增加,对肿瘤细胞周期的阻滞作用也显现出增强的趋势。目前,已经存在氢气对肿瘤细胞周期产生影响的报道,但对于不同细胞,影响的细胞周期时段不同。例如,Saitoh 等[26]发现氢气和铂纳米胶体联合治疗肿瘤细胞后,G0/G1 期细胞比例下降,G2/M 期细胞增加。但Wang 等[27]的研究表明,氢气诱导的肺癌肿瘤A549 和H1975 细胞阻滞在G2/M 期,可能的原因是氢气抑制了一种细胞周期中染色体结合所需的复合物SMC3 的表达。 图8 氢气处理48 h 对Cal-62 肿瘤细胞周期的影响 Fig. 8 Effect of hydrogen on the cell cycle of Cal-62 tumor cells after treating for 48 h: a) control group; b) Mg group; c) Mg&AZ91 group; d) Mg&TA2 group; e) Mg&316L group; f) statistical chart 1)不同异质金属对Mg 试样产生了不同程度的极化作用,引起OCP、Ec和lgJc的升高。排序均为:Mg 2)异质金属引起腐蚀加速的同时,又加剧了氢气释放,各组之间氢气释放量存在明显差异,能够形成氢气溶解量差异明显的溶液,且这种差异与腐蚀加速规律保持一致。 3)增加氢气释放量能够显著增强氢气对甲状腺肿瘤Cal-62 细胞增殖的抑制作用,在氢气释放量最多的Mg&316L 组中,抑制率高达55%。这是由于氢气释放量增加,肿瘤细胞凋亡率和G0/G1 期的阻滞比例升高共同达成。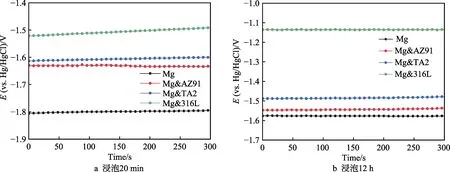

2.2 异质金属作用下高纯镁氢气释放的特征


2.3 异质金属作用下高纯镁氢气释放的抗肿瘤效应


3 结论

