铜与常见酸反应边界浓度的探究
韦永华 钱胜 周宗敏


摘要: 以铜与各种酸发生反应时所需浓度作为探究内容,通过系列实验,发现铜分别与盐酸、硫酸开始发生反应的起始浓度、铜与硝酸反应生成NO的浓度以及与硝酸反应生成NO2的浓度,并得出相应结论。对实验及结论进行了讨论。
关键词: 铜与酸反应; 边界浓度; 实验探究
文章编号: 1005-6629(2021)02-0067-04
中图分类号: G633.8
文献标识码: B
1 问题提出
金属与酸反应是中学化学教学的重要内容,我们从《无机化学》[1]中查阅到下面的一段文字: 例如硝酸和铁反应,随着硝酸浓度的增大,产物中NH3(酸性介质中为NH+4)的含量逐渐减少。当硝酸的浓度达到40%时,NH3已不存在,此时主要产物为NO,其次为NO2和微量的N2O。当硝酸的浓度增大到56%时,其还原产物主要是NO2。当硝酸浓度增大到68%时,则不再与铁反应而钝化。具体情况如图1所示。
由此引发思考: 在常见的金属中,铜扮演着重要的角色。相对于铁和铝易与浓硫酸(浓硝酸)发生钝化反应相比,它与非氧化性的稀酸不反应的事实更符合金属活动性顺序。所以,在各种版本的现行高中教材中都有铜与酸的相关反应。但这里的濃或稀是一种相对概念,浓到什么程度叫做“浓”,稀到什么程度又称之为“稀”?经查阅众多资料,对于铜能与多大浓度(我们称之为“边界浓度”)的各种酸反应,仍没有找到令人满意的答案。本文想从实验的角度,来研究铜能与何种浓度的盐酸、硫酸反应?铜与何种浓度的硝酸反应主要生成NO?能生成NO2的边界浓度又是多少?等等。需要说明的是,下面的实验均被反复重做多次,其重现性良好,故实验现象及相关结论是可靠的。
2 实验部分
2.1 实验药品及仪器
药品: 铜片、浓盐酸、浓硫酸、浓硝酸、蒸馏水、石蜡油、氨水
仪器: 试管、酒精灯、量筒、试管夹、铁架台、烧杯、石棉网
2.2 铜与不同浓度盐酸溶液反应的边界浓度
由于铜的活动性,使其通常情况下不能与稀盐酸反应。但若选用铜片或铜丝与浓盐酸混合并加热,则发生反应: 2Cu+8HCl2H3[CuCl4]+H2↑;若改用铜粉,则发生反应: 2Cu+4HCl2H[CuCl2]+H2↑[2]。原因是Cl-具有较强的配合作用,在一定条件下,浓盐酸中的Cl-与Cu+结合生成[CuCl2]-、 [CuCl3]2-、 [CuCl4]3-等,同时产生的氢气逸散,双重因素共同影响,使反应的平衡正向移动。上述文献从理论角度说明了铜能与浓盐酸反应的客观事实。为了验证多大浓度的浓盐酸能与铜反应,我们进行了如下探究实验。
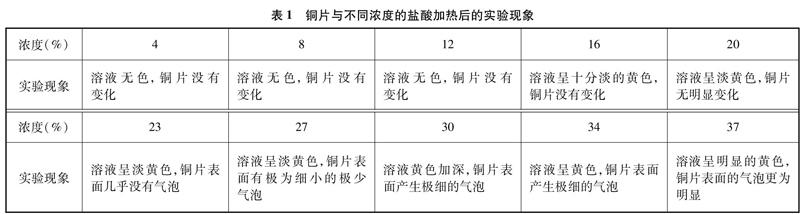
把市售浓度为37%、密度为1.18g/cm3的浓盐酸,与水分别按体积比为10∶0, 9∶1, 8∶2……0∶10混合,配制成各种浓度的盐酸。取10支试管,分别加入适量相同大小的光亮铜片,把配好的各种浓度的盐酸分别倒入试管,浸没铜片。为了减少HCl的挥发及空气中的O2可能对实验带来的影响,在混合物上加一层石蜡油液封。把酒精灯调至小火,小心持续加热,使盐酸处于微沸状态30min。然后,把观察到的实验现象记录于表1(注: 为了方便列表,空白实验没有在表中列出,后续硫酸和硝酸没有进行空白实验)。
为了尽可能减少HCl挥发对溶液浓度的影响,我们把加热方式改成沸水浴加热,产生气泡的现象虽不如直接加热明显,但溶液颜色的变化趋势与上表所述基本一致。为了找到更精确的反应边界浓度,我们又补做了介于12%~16%之间的14%的盐酸与铜加热后的反应,溶液几乎呈无色。取反应后的黄色溶液少许,逐滴加入过量浓氨水。开始滴加氨水的一瞬间,在溶液表面,液滴周围出现淡淡的蓝色,振荡后蓝色消失,继续滴加氨水至过量,溶液呈极浅的蓝色。
理论分析: 第一,当溶液中兼含Cu2+和Cu+与Cl-形成的配离子时呈酱色,当在较低浓度时显淡黄色至几乎无色,与实验中所观察到的现象一致。第二,以[CuCl4]3-为例(其他络离子类似),在溶液中存在如下的平衡[3]: [CuCl4]3-Cu++4Cl-, Cu+与氨水生成无水配合物[Cu(NH3)2]+,[Cu(NH3)2]+很快被空气中的氧气氧化生成深蓝色的[Cu(NH3)4]2+,反应如下:
4[Cu(NH3)2]++8NH3+O2+2H2O4[Cu(NH3)4]2++4OH-从而证明铜与浓盐酸发生了反应。
结论: 加热时,盐酸与铜反应的边界浓度为14%~16%。当盐酸的浓度小于14%时,通常认为不与铜反应,而浓度大于16%时,铜与盐酸可以反应生成氢气。从文献[4]中查到: 溶质质量分数超过20%的盐酸称为浓盐酸。如果以能否与铜在加热条件下反应来界定浓、稀盐酸,我们的实验数据与文献有一定差异,这应该是界定的方式不同所致。故教学中,也不宜死抠“浓盐酸”和“稀盐酸”的区别。
2.3 铜与不同硫酸溶液反应的边界浓度
铜与稀硫酸也不能反应,且SO2-4的配合能力远不及Cl-,所以不存在由于硫酸的浓度增大而与铜反应生成氢气的可能性。但铜能与一定浓度的硫酸反应是不可辩驳的事实。为研究铜与硫酸反应的边界浓度,我们延续了前面的实验思路。把市售浓度为98%、密度为1.84g/cm3的浓硫酸,与水分别按体积比为9∶1, 8∶2……0∶10混合,配制成各种浓度的硫酸溶液,并计算出其浓度。取大小相同的光亮铜片,依次加入配制好的各种浓度的硫酸中,用酒精灯充分加热,观察到的实验现象如表2所示。
从表2中可以看出,63%的硫酸溶液不与铜反应,而72%的硫酸溶液则能与铜反应。为了找到更精确的边界浓度,我们把63%~72%范围内的浓度又细分为65%、 67%和69%,重复上述实验,其结果如表3所示。
结论: 硫酸与铜片反应的边界浓度在63%~65%。即加热时,当硫酸的浓度大于65%时,铜片与浓硫酸能发生显著的反应,而硫酸的浓度小于63%时,则铜片不能与硫酸发生显著反应。
在文献[5]中查到: 浓硫酸是指质量分数大于或等于70%的硫酸,与本实验所得出的边界浓度接近。所以,70%的硫酸被认为是浓硫酸,在本实验中是可以接受的。
2.4 铜与硝酸反应的边界浓度
除镁、锌与一定浓度的稀硝酸反应生成少许氢气外,各种浓度的硝酸与其他金属反应,几乎没有氢气生成。又由于氮元素形成的化合物種类众多,使得硝酸与各种金属反应的还原产物很复杂。一般说来,浓硝酸与金属反应,不论金属活泼与否,它的主要产物是NO2,倘若是活泼金属(如锌、镁)与稀硝酸反应的主要产物是N2O,极稀的HNO3与活泼金属反应,则被还原为NH+4[6]。而铜与浓(稀)硝酸反应是中学十分常见的反应,为了探究生成NO等物质时硝酸的边界浓度,进行了如下实验。
同样,把市售浓度为68%、密度为1.4g/cm3的浓硝酸,与水分别按体积比为9∶1, 8∶2……0∶10混合,配制成各种浓度的硝酸。取大小相同的光亮铜片,依次加入配制好的各种浓度的硝酸中,静置,观察到的现象记录如表4所示。
依据上表,只能得出26%的硝酸与铜反应会生成NO2的结论,而在18%~26%之间仍有很大的浓度范围值得研究。与前面的探究思路相似,我们又精准地配制20%、 22%和24%的硝酸,重复上述实验(实验现象不再赘述),可得出如下结论:
当硝酸浓度小于或等于20%时,铜与硝酸溶液反应几乎只生成NO,而高于此浓度则可明显观察到有红棕色气体生成,随着硝酸的浓度增加,生成NO2的比例会越来越大,气体的颜色也更浓,但由于NO的无色易被NO2的红棕色所掩盖,故用本文的实验仍无法确定在产物中NO和NO2的比例,也无法确定只生成NO2的边界浓度,这也是本实验的局限性所在,愿意就此问题与同行们进行更为深入的探讨和交流。
参考文献:
[1][3][6]古国榜, 李朴主编. 无机化学(第二版)[M]. 北京: 化学工业出版社, 2003: 345~346, 252.
[2]姚守拙, 朱元保, 何双娥, 聂利华. 元素化学反应手册[M]. 湖南: 湖南教育出版社, 1998: 773.
[4]https://baike.baidu.com/item/%E6%B5%93%E7%9B%90%E9%85%B8/10341499?fr=aladdin.
[5]https://baike.baidu.com/item/%E6%B5%93%E7%A1%AB%E9%85%B8.

