气道和肺泡部位成纤维细胞的原代分离和培养
曾莹莹 胡蔚萍 左依慧 张静



摘 要 目的:建立小鼠氣道和肺泡部位原代成纤维细胞的分离、培养方法,为研究肺内成纤维细胞的区域性差异提供技术平台。方法:将小鼠双肺取出并固定后,在体视显微镜视野内分别分离气道和肺泡组织块,并应用组织块培养法分别进行细胞的体外原代和传代培养。通过细胞形态观察以及细胞表面标志物的免疫荧光检测对培养的成纤维细胞进行鉴定。此外,采用阿尔玛蓝法分别检测气道和肺泡部位成纤维细胞的增殖情况并进行比较。结果:12 h内可见分离的原代细胞贴壁生长,7 d可进行传代。在倒置显微镜下观察,细胞呈长梭状,胞体丰满,胞质均匀,符合成纤维细胞的特点,并且细胞在5代以内可保持良好的生长状态和稳定的性状。免疫荧光检测结果显示,抗波形蛋白染色和抗α-平滑肌肌动蛋白染色呈阳性,抗细胞角蛋白染色、抗血管性假血友病因子染色、抗结蛋白染色均呈阴性,由此表明该分离培养的细胞为成纤维细胞,且纯度高达99%。此外,气道部位的成纤维细胞增殖能力显著高于肺泡部位。结论:应用显微解剖加组织块法可成功分离培养小鼠气道和肺泡部位成纤维细胞,并且使细胞在5代以内生长状态良好,从而为探索小气道壁和肺泡成纤维细胞功能差异提供必要的细胞工具。
关键词 成纤维细胞 气道组织 肺泡 小鼠 显微分离 原代培养
中图分类号:Q813.11 文献标志码:A 文章编号:1006-1533(2021)03-0068-05
*基金项目:国家自然科学基金资助项目(81470231,81670030)
Isolation and culture of primary fibroblasts derived from airway and alveolar tissues*
ZENG Yingying, HU Weiping, ZUO Yihui, ZHANG Jing**
(Department of Pulmonary and Critical Care Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: To establish mice fibroblasts of airway and alveolar tissues isolation method for primary culture and research use and to provide the platform for the research of regional differences between fibroblasts from the airway and alveolar tissues. Methods: The 6-8 month old mice were sacrificed and the lung were got totally together with trachea. Then the airway tissues and the alveolar tissues were isolated under the stereomicroscope respectively. Primary fibroblasts were cultured by tissue block culture method and were identified by cell morphology and immunofluorescence staining. The proliferative ability of fibroblasts derived from airway and alveolar tissues was analyzed by Alamar blue assay. Results: The fibroblasts derived from airway and alveolar tissues were generally elongated and spindle shaped and were in line with the classic fibroblasts form. Moreover, the primary fibroblasts maintained the steady growing condition within the 5 passages. Further analysis using immunofluorescence revealed that the fibroblasts markers vimentin and α-SMA were positive, cytokeratin staining, desmin staining, and von Willebrand factor staining were negative, which showed that the primary fibroblasts were fibroblasts. In addition, the proliferative ability of fibroblasts derived from airway tissues was significantly higher than that from alveolar tissues. Conclusion: Primary fibroblasts derived from airway and alveolar tissues could maintain good condition within passage 5. And it provided a good cell tool to investigate the functional difference between this kind of fibroblasts.
KEY WORDS fibroblasts; airway; pulmonary alveolus; mice; microisolation; primary culture
慢性阻塞性肺病(慢阻肺)是一种常见的慢性进行性疾病,最新研究结果提示40岁以上人群中发病率达到 11.7%,构成了重大疾病负担[1-5]。慢阻肺的病理特征是小气道壁重构和肺气肿,这两个解剖上临近的部位却呈现截然相反的细胞外基质沉积特点[6-9],明确其机制可有助于发现慢阻肺干预的新靶点。成纤维细胞作为肺产生细胞外基质的主要细胞,有助于局部损伤修复[10-12]。因此,原代分离气道和肺泡两个独立部位的成纤维细胞是探索小气道壁和肺泡细胞外基质沉积差异的必要细胞工具。然而,已有研究多采用全肺成纤维细胞原代分离培养或者细胞系培养的方法[13-15]。因此,本研究应用显微解剖加组织块法,探索分离小鼠气道和肺泡两个独立部位的原代成纤维细胞的方法,观察并鉴定获取细胞的功能与性状特性。
1 材料和方法
1.1 材料
1.1.1 实验动物
6~8周(20~25 g)清洁级C57BL/6雄性小鼠,购于复旦大学附属中山医院实验动物中心。实验过程中对动物的处理获实验动物中心伦理审批,并符合2006年科技部《关于善待实验动物的指导意见》的相关要求。
1.1.2 主要试剂与仪器
DMEM/F12 (dulbeccos modified eagle medium/F12)培养基、青链霉素混合液、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶-乙二胺四乙酸钠(EDTA)和Hank平衡盐溶液(HBSS)均购自美国Gibco公司。无血清冻存液购自苏州新赛美公司。细胞培养瓶购自美国Corning公司。兔抗小鼠波形蛋白(vimentin)抗体、小鼠抗小鼠α-平滑肌肌动蛋白(α-SMA)抗体、兔抗小鼠角蛋白(cytokeratin)抗体、兔抗小鼠结蛋白(desmin)抗体、兔抗小鼠血管性假血友病因子(von Willebrand factor,vWF)抗体、FITC标记山羊抗鼠IgG二抗、FITC标记山羊抗兔二抗均购自美国CST公司;阿尔玛蓝(alamar blue)购自上海翊圣生物科技有限公司;麻醉药Avertin(2,2,2-三溴乙醇溶液)购自美国Sigma公司。
体视显微镜购自德国莱卡公司;荧光正置显微镜,含5% CO2、37 ℃恒温细胞培养箱,细胞超净台,低温离心机均购自美国Thermo公司;显微剪、显微镊购于上海金钟公司;硅胶、大头钉购于上海元象医疗器械有限公司。
1.2 细胞分离培养
1.2.1 原代气道和肺泡成纤维细胞分离、培养
原代气道部位成纤维细胞:取6~8周的C57BL/6小鼠,經腹腔快速注射过量麻醉药Avertin(1 000 mg/kg)将小鼠处死后,将其全身置于75%乙醇内消毒5 s,在无菌环境下剖胸,暴露心肺,将带有气管的完整双肺取出,迅速将其放在装有预冷1%双抗液的PBS中冲洗,用大头针将双肺水平固定于预先备好的装有硅胶的直径10 cm细胞培养皿上,向皿内倒入预冷HBSS使液面能覆盖两侧肺组织。在体视显微镜下沿气管树向下分离气道组织,将分离到的气道组织剪至1 mm ×1 mm×1 mm大小并将其放入预冷的无菌容器内,把每20~25块气道组织转移至25T的培养瓶内,使组织块均匀分布于培养瓶内。向培养瓶内加入1 ml含50% FBS的DMEM/F12培养液,将培养瓶放入细胞培养箱静置24 h。待组织块贴壁牢固后,再向培养瓶内补齐4 ml含20% FBS的DMEM/F12培养液,继续培养5 d并静置,从第3~4天开始陆续会有成纤维细胞从组织块周围爬出。第6天吸去原来的培养液,取出组织块,加入新鲜的含20% FBS的DMEM/ F12培养液4~5 ml,每2 d换液1次。
原代肺泡成纤维细胞:在体视显微镜下用显微剪和显微镊在肺组织的边缘剪下肺泡组织,将组织块剪至约1 mm×1 mm×1 mm大小后放入预冷的无菌容器内,每20~25块转移到25T培养瓶内,后续过程同上。此外,在体视显微镜下分离小鼠气道组织以及周围的肺泡组织并进行苏木精-伊红染色以证实所分离组织具备气道和肺泡组织的结构特征。
1.2.2 细胞的传代培养
原代成纤维细胞培养至12 d左右,细胞密度达到瓶底面积的80%~90%时,可进行首次传代。按细胞计数进行1∶2或者1∶3比例传代,传代后的细胞根据生长情况每2 d换液1次,可用无血清冻存液冻存第2~4代细胞,以备后续实验使用。
1.3 细胞鉴定
1.3.1 细胞形态学鉴定
在倒置显微镜下观察原代及传代细胞的形态特征。
1.3.2 成纤维细胞表面标志物鉴定
将培养的第2代细胞接种于置有盖玻片的24孔板内,待细胞密度长至盖玻片的70%~80%时取出盖玻片,用4%多聚甲醛固定、吹干,按常规方法进行vimentin、α-SMA、cytokeratin、desmin、vWF免疫荧光染色,并设立阴性对照(以PBS代替一抗),用4,6-二脒基-2-苯基吲哚(DAPI)复染细胞核,于荧光显微镜下观察所分离培养细胞的染色情况。
1.3.3 细胞增殖能力测定
用含10%FBS的培养液稀释对数生长期的气道和肺泡部位成纤维细胞后分别接种于96孔板内,每孔接种细胞数1 000个,设置5个时间点,各部位设置5个复孔,另外每个时间点均设置空白对照孔。将96孔板放于细胞培养箱内培养8 h以使细胞贴壁,贴壁后将第1组(0 h)孔内原来的培养液吸出,每孔加入含10%阿尔玛蓝的无血清DMEM/F12培养液100 μl,在细胞培养箱中孵育6 h后使用545 nm和590 nm双波长的酶标仪检测荧光值。其余4组分别在细胞接种后的24、48、72、96 h分别加阿尔玛蓝试剂后孵育6 h,并检测细胞各对应时间点的荧光值。
1.4 统计学处理

2 结果
2.1 细胞形态学表现
组织块贴壁后的第3~4 d,肺泡和气道组织块周边均出现新迁出的细胞(图1)。显微镜下细胞以长梭状排列生长,胞体丰满,胞质均匀,核呈圆形或卵圆形。气道部位成纤维细胞在第5代前细胞生长旺盛,状态良好,性状稳定(图2A);肺泡部位成纤维细胞传至第5代时生长缓慢,状态变差,但5代前状态良好(图2B)。两个部位的培养细胞冻存复苏后在第5代前生长状态均良好。
2.2 细胞免疫荧光鉴定结果
气道和肺泡部位成纤维细胞的抗vimentin免疫荧光染色结果(图3A、B)显示,细胞骨架呈绿色,细胞核呈蓝色;抗α-SMA免疫荧光染色结果(图3D、E)显示,细胞骨架呈红色,细胞核呈蓝色;而抗cytokeratin、desmin和vWF免疫荧光染色,仅细胞核呈蓝色,细胞质无荧光染色。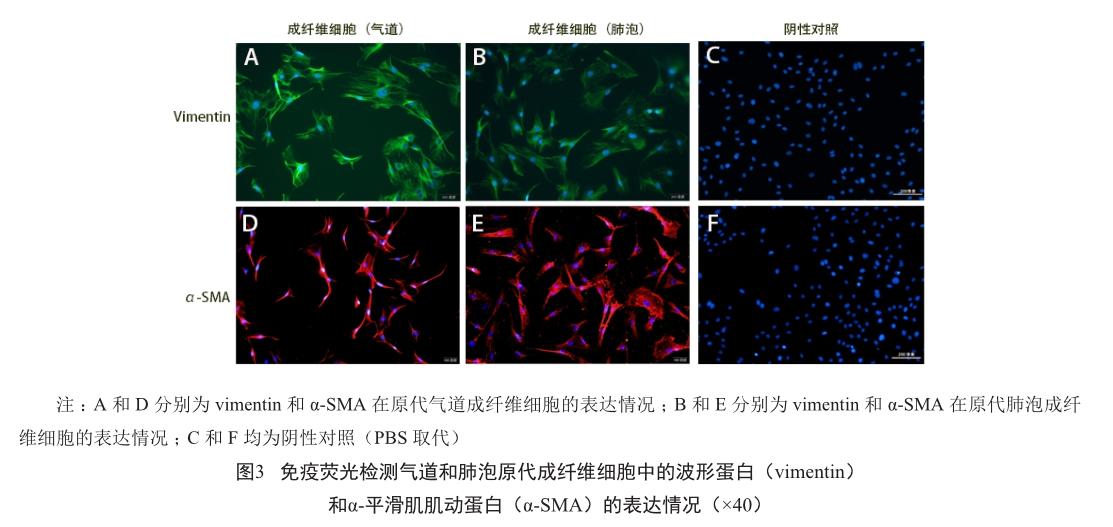
2.3 细胞增殖能力鉴定结果
采用阿尔玛蓝法检测气道和肺泡部位成纤维细胞增殖能力。增殖曲线结果(图4)提示,在细胞生长48 h后,气道成纤维细胞的增殖能力显著高于肺泡成纤维细胞(P<0.001),气道成纤维细胞倍增时间约为48 h,而肺泡成纤维细胞倍增时间为72~96 h。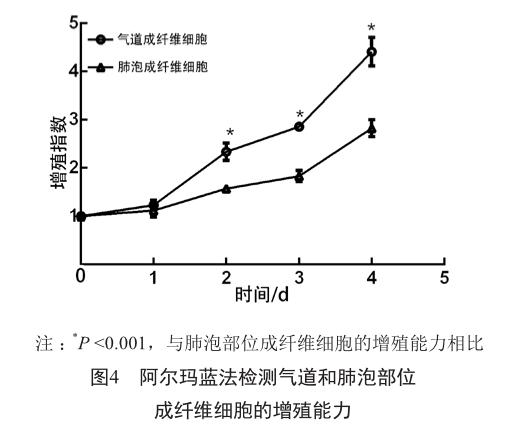
3 讨论
研究表明,肺组织气道和肺泡部位的细胞外基质蛋白的表达量存在很大的差异[8,11,16],成纤维细胞是肺组织中产生细胞外基质蛋白的主要细胞[7,17];同时慢阻肺的病理机制是小气道纤维化(即细胞外基质蛋白的沉积)和肺气肿(即细胞外基质蛋白的缺失)[18],因此,掌握分离、培养气道和肺泡部位的成纤维细胞技术对于明确慢阻肺的区域化病理差异有重要的意义。
现有的肺组织原代成纤维细胞培养的方法主要有组织块法、酶消化法两种[13,19],而且都是关于全肺肺组织的成纤维细胞的分离和培养,并未具体到肺内不同解剖部位,比如气道和肺泡部位成纤维细胞的分离、培养。加之在应用酶消化法提取原代成纖维细胞时,由于步骤烦琐,消化时间长且需要大量组织块,限制了分区域原代成纤维细胞的分离培养的应用,因此我们采用组织块法分离、培养气道和肺泡部位原代成纤维细胞。
本实验探索使用显微解剖技术分离小鼠气道和肺泡部位原代成纤维细胞的方法,并提出简单实用的操作流程:保留有气管的完整肺组织可使操作者沿气管树走行逐级向下分离气道组织;而且在取肺前没有用PBS冲洗肺部血管,使肺部血管保留有凝固的红色血块,可帮助操作者在显微视野内清晰辨认相伴而行的气管和血管,以保证分离的组织是气道而非血管。由于最终贴壁的组织块数量和大小是原代成纤维细胞能否爬出以及爬出数量的决定因素,为了防止组织块漂浮而导致培养失败,我们在将剪下的组织块接种于培养瓶后,向瓶内先加入含有50% FBS的1 ml培养液,并维持24 h培养,使组织块贴壁牢固。经过前期摸索,我们发现1 ml的液体量既不会使组织块漂浮,而且液体表面张力又不会使组织块干燥坏死,同时含有高浓度血清可以给组织块提供足够的营养。我们的研究结果也显示经过24 h的培养,80%的组织块均可贴壁并保持组织活性。虽然有研究通过翻瓶2~4 h培养来确保组织块附着在培养瓶上[13],但是肺泡组织内含有气体、质量轻、易于漂浮,2~4 h的时间或许不会使组织块贴壁牢固,再翻动培养瓶时依旧会使组织块漂浮。
在对两部位成纤维细胞进行传代培养的过程中发现:气道部位成纤维细胞可以稳定传至第5代,其性状依然保持稳定;但肺泡部位成纤维细胞传至第5代时,由于增殖能力的降低,细胞生长缓慢。该细胞生长形态观察结果和我们对两部位细胞增殖能力的测定结果一致,同时也从侧面验证了所分离的成纤维细胞来自两个不同的部位。因此,为了保证实验结果的可靠性,我们均采用第2~4代细胞进行后续研究。
综上所述,显微解剖联合组织块法分离培养肺组织气道和肺泡部位原代成纤维细胞,可以稳定保持组织块的活性,为细胞贴壁、增殖提供了良好的基础条件,能够特异、高效、简便地获得小鼠肺组织气道和肺泡部位成纤维细胞,并稳定传代。该技术为研究慢阻肺的细胞外基质在气道和肺泡部位的表达差异提供了重要的细胞工具,同时也为慢阻肺的发病机制提供了新的研究视角。
参考文献
[1] Wang C, Xu J, Yang L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study[J]. Lancet, 2018, 391(10131): 1706-1717.
[2] Pauwels RA, Rabe KF. Burden and clinical features of chronic obstructive pulmonary disease (COPD)[J]. Lancet, 2004, 364(9434): 613-620.
[3] Harb N, Foster JM, Dobler CC. Patient-perceived treatment burden of chronic obstructive pulmonary disease[J/OL]. Int J Chron Obstruct Pulmon Dis, 2017, 12: 1641-1652. doi: 10.2147/COPD.S130353.
[4] Panagioti M, Scott C, Blakemore A, et al. Overview of the prevalence, impact, and management of depression and anxiety in chronic obstructive pulmonary disease[J/OL]. Int J Chron Obstruct Pulmon Dis, 2014, 9: 1289-1306. doi: 10.2147/COPD.S72073.
[5] GBD 2015 Chronic Respiratory Disease Collaborators. Global, regional, and national deaths, prevalence, disability- adjusted life years, and years lived with disability for chronic obstructive pulmonary disease and asthma, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015[J]. Lancet Respir Med, 2017, 5(9): 691-706.
[6] Preobrazhenska O, Wright JL, Churg A. Regional heterogeneity in murine lung fibroblasts from normal mice or mice exposed once to cigarette smoke[J/OL]. PLoS One, 2012, 7(6): e39761. doi: 10.1371/journal.pone.0039761.
[7] Balestrini JL, Niklason LE. Extracellular matrix as a driver for lung regeneration[J]. Ann Biomed Eng, 2015, 43(3): 568-576.
[8] Hogg JC, Timens W. The pathology of chronic obstructive pulmonary disease[J]. Annu Rev Pathol, 2009(4): 435-459.
[9] Chung KF, Adcock IM. Multifaceted mechanisms in COPD: inflammation, immunity, and tissue repair and destruction[J]. Eur Respir J, 2008, 31(6): 1334-1356.
[10] White ES. Lung extracellular matrix and fibroblast function[J]. Ann Am Thorac Soc, 2015, 12(Suppl 1): S30-S33.
[11] Gu BH, Madison MC, Corry D, et al. Matrix remodeling in chronic lung diseases[J]. Matrix Biol, 2018, 73: 52-63.
[12] Burgstaller G, Oehrle B, Gerckens M, et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease[J]. Eur Respir J, 2017, 50(1): 1601805.
[13] 鄧佳慧, 肖军花, 王嘉陵. 成年小鼠肺成纤维细胞分离纯化及原代培养[J]. 基础医学与临床, 2012, 32(6): 713-714.
[14] 祝华平, 常立文, 李文斌, 等. 胎鼠肺细胞的分离纯化及原代培养[J]. 华中科技大学学报(医学版), 2003, 47(6): 597-600.
[15] 王晓华, 王扬, 蒋涛, 等. 人皮肤成纤维细胞原代培养及生物学特性[J]. 中国医科大学学报, 2010, 39(12): 1041-1044.
[16] Togo S, Holz O, Liu X, et al. Lung fibroblast repair functions in patients with chronic obstructive pulmonary disease are altered by multiple mechanisms[J]. Am J Respir Crit Care Med, 2008, 178(3): 248-260.
[17] Kendall RT, Feghali-Bostwick CA. Fibroblasts in fibrosis: novel roles and mediators[J]. Front Pharmacol, 2014(5): 123.
[18] Bonnans C, Chou J, Werb Z. Remodelling the extracellular matrix in development and disease[J]. Nat Rev Mol Cell Biol, 2014, 15(12): 786-801.
[19] 汤楚华, 施生根, 牛忠英, 等. 酶消化组织块法原代培养人牙周膜成纤维细胞的初步研究[J]. 中华医学杂志, 2004, 84(8): 44-46.

