不同浓度吗啡对小胶质细胞极化状态的影响
(1 青岛大学附属医院麻醉科,山东 青岛 266003; 2 青岛大学附属青岛妇女儿童医院麻醉科)
吗啡在缓解中重度疼痛中占有重要地位,但长期应用可导致患者吗啡耐受和(或)痛觉过敏,影响了其在临床上的应用[1-2]。近年来研究发现,小胶质细胞作为中枢神经系统的巨噬细胞,其不同的活化状态(M1/M2型)在吗啡耐受和痛觉过敏中发挥着重要作用[3-6]。吗啡能够导致小胶质细胞激活,使白细胞介素1(IL-1)等炎症因子产生增多,进而产生吗啡耐受,小胶质细胞活化为M1型时可使IL-1β等促炎因子表达明显增多[7]。当小胶质细胞活化为M2型时,细胞中的抗炎细胞因子脑源性神经营养因子(BDNF)等表达增多[6],BDNF能与酪氨酸激酶B(TrkB)受体结合使增强神经元兴奋性增高进而导致患者痛觉过敏[8]。但关于小胶质细胞极化状态在吗啡耐受和痛觉过敏中的具体作用机制尚不清楚。本研究拟通过不同浓度吗啡对小胶质细胞极化状态影响的研究,探讨吗啡耐受和痛觉过敏的产生及调节机制,以便指导临床实践。
1 材料与方法
1.1 材料来源
大鼠小胶质细胞HAPI株购自赛齐(上海)生物工程有限公司。
1.2 药品与试剂
Arg-1、iNOS、CD86、CD206和β-actin兔抗大鼠一抗购自美国Abcam公司;羊抗兔二抗购自中国Elabscience公司;胎牛血清(FBS)购自美国Gibco公司;DMEM高糖培养基购自美国Hyclone公司;L-多聚赖氨酸、青霉素与链霉素混合液、2.5 g/L胰蛋白酶液以及PBS磷酸盐缓冲液均购自北京索莱宝公司。
1.3 小胶质细胞的培养
大鼠小胶质细胞HAPI株复苏后,置于含10×104U/L青霉素与0.1 g/L 链霉素的DMEM培养基中,于37 ℃、含体积分数0.05 CO2的恒温箱中进行培养,待细胞融合度约达70%时,胰蛋白酶消化并吹打成单细胞悬液,按照1∶3传代。
1.4 分组及处理
取对数生长期的小胶质细胞,以5×105/孔接种于6孔板之中,37 ℃下置于含体积分数0.05 CO2的培养箱中培养,待细胞融合度约达70%时,采用随机数字表法将细胞分为空白对照组(C组)、10-7mol/L吗啡组(L组)和10-4mol/L吗啡组(H组)3组。C组不作任何处理,L组和H组分别加入终浓度为10-7mol/L和10-4mol/L的吗啡培养液孵育24 h。
1.5 Western Blotting方法检测各组小胶质细胞中CD11b、iNOS和Arg-1蛋白表达
将6孔板中孵育后的各组小胶质细胞以PBS清洗后,按照1 mL RIPA裂解液加入10 μL PMSF(100 mmol/L)加10 μL磷酸酶抑制剂的比例每孔加入120 μL裂解液,摇匀置于冰上离心后收集上清液,以BCA法进行蛋白定量,以30 μg蛋白量计算每组的上样体积,加入上样缓冲液,煮沸变性。用微量注射器上样,经SDS-PAGE电泳分离蛋白,转移至转膜液中进行恒流湿转。转膜成功后,用50 g/L的脱脂奶封闭PVDF膜2 h,随后分别加入CD11b(1∶1 000)、Arg-1(1∶1 000)、CD206(1∶1 200)、CD86(1∶1 500)、iNOS(1∶1 000)以及β-actin(1∶2 000)一抗,4 ℃摇床过夜。以TBST液洗膜3次,每次10 min,完成后加入二抗(1∶5 000)孵育1.5 h。以TBST液洗膜3次后,用镊子夹出膜带,加入显色剂,以BIORAD系统测定各组条带灰度值,计算目的蛋白的表达水平,每组实验重复3次,实验结果取均值。
1.6 实时荧光定量PCR(RT-qPCR)方法检测各组小胶质细胞中BDNF、IL-1β mRNA的表达
将6孔板中孵育后的各组小胶质细胞用PBS清洗后,以Trizol法提取细胞总RNA,检测RNA的浓度和纯度,逆转录合成cDNA。以cDNA为模板进行PCR反应。按照试剂盒说明书的要求配制成20 μL PCR反应体系,并应用Prism®7300型荧光定量PCR仪进行扩增,扩增条件设置为:94 ℃预变性30 s;94 ℃变性20 s,60 ℃退火延伸30 s,循环45次。每个样品设置3个复孔,得到各组样品CT值后,以2-ΔΔCT方法计算各组mRNA的相对表达量,实验重复3次,取均值。β-actin引物序列:正义链5′-CACGATGGAGGGGCCGGACTCATC-3′,反义链5′-TAAAGACCTCTATGCCAACACAGT-3′;BDNF引物序列:正义链5′-AGCCTCCTCTGCTC-TTTCTGCT-3′,反义链5′-TGCCTTTTGTCTAT-GCCCCTG-3′;IL-1β引物序列:正义链5′-GGTT-TCCCTTTCTGGCGTCCTG-3′,反义链5′-TCCC-TCCCTCCCTCCCTTTCC-3′。
1.7 免疫荧光法检测各组小胶质细胞中CD86和CD206蛋白表达
将处于对数生长期的小胶质细胞接种到各组预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,以PBS浸洗后,以40 g/L的多聚甲醛固定爬片15 min,以体积分数为0.005的Triton X-100(PBS配制)室温通透20 min。在玻片上滴加正常山羊血清,室温封闭30 min。吸水纸吸掉封闭液,不清洗,每张玻片分别滴加足够量的稀释好的一抗(CD11b抗体、CD86抗体、CD206抗体)并放入湿盒,4 ℃孵育过夜。加荧光二抗,用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察同时采集图像,采用Image-J软件测定各组荧光图片的荧光强度,以此表示CD86和CD206蛋白的表达量。每组实验重复3次,取均值。
1.8 统计学处理
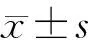
2 结 果
2.1 各组小胶质细胞中CD11b的表达
C、L、H组小胶质细胞中CD11b蛋白表达量比较差异有显著性(F=85.634,P<0.05);L、H组与C组比较,差异均有显著性(t=12.639、13.220,P<0.05)。见图1、表1。
2.2 不同浓度吗啡对小胶质细胞M1/M2型极化状态的影响
C、L、H组小胶质细胞中CD86、CD206、iNOS及Arg-1蛋白的表达量比较,差异具有显著统计意义(F=30.660~85.968,P<0.05);L组小胶质细胞中CD206、Arg-1蛋白的表达量与C组比较,差异有显著性(t=9.740、10.574,P<0.05);H组小胶质细胞中CD86、iNOS蛋白的表达量与C组比较,差异均有显著性(t=6.043、11.582,P<0.05);L组小胶质细胞中CD86、CD206、iNOS、Arg-1蛋白的表达量与H组比较,差异均具有显著意义(t=3.992~8.278,P<0.05)。见图1、2及表1。
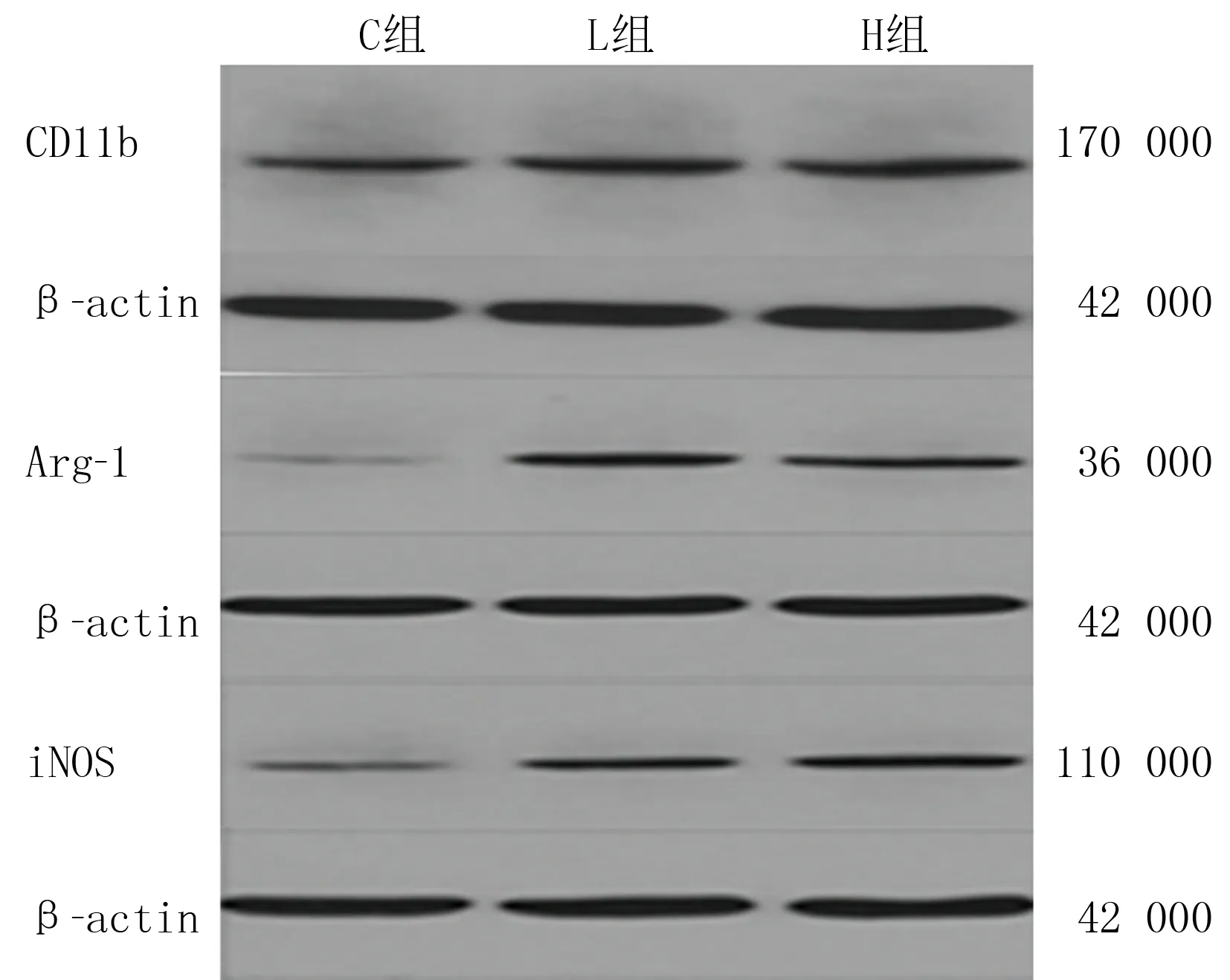
图1 不同浓度吗啡对小胶质细胞各标记物表达的影响

图2 不同浓度吗啡对小胶质细胞M1、M2标记物表达的影响

表1 不同浓度吗啡对小胶质细胞各标记物表达的影响
2.3 吗啡对小胶质细胞IL-1β以及BDNF mRNA表达的影响
C、L、H组小胶质细胞中BDNFmRNA的表达水平分别为1.000±0.001、3.327±0.210、1.656±0.104,IL-1β mRNA的表达水平分别为1.000±0.001、1.381±0.177、1.838±0.099,三组比较差异有显著性(F=236.808、13.986,P<0.05);L、H组与C组比较,差异有显著性(t=3.732~19.223,P<0.05);L组与H组相比较,差异具有显著意义(t=11.843、3.901,P<0.05)。
3 讨 论
吗啡是治疗中重度疼痛阿片类药物的代表,但长期使用会导致患者耐受和(或)痛觉过敏,影响其在临床上的应用。近年来,针对吗啡耐受和痛觉过敏产生及调节机制进行了多方面的研究并取得了一些进展,但由于吗啡耐受和痛觉过敏的机制极其复杂,很多研究尚未得到确切结论。本研究结果表明,L组小胶质细胞中CD206、Arg-1蛋白以及BDNFmRNA表达上调,H组小胶质细胞中CD86、iNOS蛋白和IL-1β mRNA表达上调,提示低浓度吗啡诱导小胶质细胞向M2型极化状态分化,而高浓度吗啡诱导小胶质细胞向M1型极化状态分化。
小胶质细胞是中枢神经系统的巨噬细胞,在健康机体中,其处于静止状态,能够通过调控自身的结构功能,从而调控突触之间的信号传递。当机体受到诸如神经损伤等外界刺激时,小胶质细胞会进一步活化,呈现出形态学的改变,从分支状变成变形虫样,其间伴随着小胶质细胞标记蛋白CD11b的表达增加[9]。当存在吗啡慢性刺激时,脊髓胶质细胞激活,小胶质细胞活化标记物CD11b的表达增多[10],促炎细胞因子释放增加,这是吗啡耐受和痛觉过敏的主要机制[11-12]。抑制脊髓小胶质细胞活化和(或)促炎性细胞因子释放,均能降低吗啡耐受和痛觉过敏的产生[13]。本研究显示,L组和H组小胶质细胞中CD11b的表达均上调,提示不论是低浓度还是高浓度吗啡均能活化小胶质细胞。
与外周的巨噬细胞相似,小胶质细胞的极化状态有M1型和M2型两种[14]。M1型小胶质细胞主要分泌IL-1β等促炎细胞因子[15],其中,IL-1β通路的激活对吗啡耐受的形成起到了重要作用[16],其能够增加IFN-γ、IL-6以及TNF-α等促炎因子的释放,从而增强中枢神经系统的炎症反应[17],这些炎症反应最终导致了吗啡耐受的形成[18]。另外有报道称,一些药物能够通过抑制小胶质细胞内IL-1β通路的激活,来达到减缓吗啡耐受的目的[19]。本研究结果显示,H组M1型小胶质细胞极化标记物蛋白和IL-1β mRNA表达显著上调,提示高浓度吗啡(10-4mol/L)刺激小胶质细胞向M1型转化,并增加IL-1β的合成释放,这可能是导致吗啡耐受的可能机制。M2型小胶质细胞可分泌BDNF等大量生长因子[20]。BDNF可激活脊髓背角次级感觉神经元上的TrkB受体,增加K+-Cl-共转运体KCC2的表达,造成胞内Cl-浓度升高和神经元超极化,从而引起痛觉过敏[21]。反之,通过抑制BDNF的表达也能够有效减缓痛觉过敏[22-23]。本研究结果显示,H组M2型小胶质细胞极化标记物蛋白和BDNFmRNA表达上调,提示低浓度吗啡(10-7mol/L)刺激小胶质细胞向M2型转化,并增加了BDNF的合成与释放,这可能是吗啡导致的痛觉过敏产生的可能机制。
综上所述,不同浓度吗啡诱导小胶质细胞不同极化状态,高浓度吗啡诱导小胶质细胞活化为M1型,低浓度吗啡诱导小胶质细胞活化为M2型,这可能分别是产生吗啡耐受和痛觉过敏的机制。

